介紹 1.病因(1)環境因素:接觸
電離輻射 有利於白血病的發生,二次世界大戰時日本發生
核子彈 爆炸後當地白血病發病率增高即證實這一點。接觸治療性輻射也增加白血病的發病率。長期接觸苯等有毒化學物品與
急性非淋巴細胞白血病 有關其他與ALL發病可能有關的化學物品有
除草劑 、殺蟲劑孕婦酗酒、
避孕藥 、菸草及化學溶劑,但這些因素與ALL發病的確切關係尚不肯定。
(2)感染因素:Smith等研究發現孕婦宮內胎兒感染可增加5歲以下兒童患ALL的危險感染導致ALL危險性增加的機制可能是感染導致基因組的不穩定性增加資料證明
EB病毒感染 可能與L3型ALL相關也有ALL發病與
HIV感染 相關的
病例報告 A型肝炎病毒感染與兒童ALL高發病率有關改善公共衛生狀況可降低母親孕期感染及
新生兒感染 對降低ALL的危險性將起到不可忽視的作用
母乳餵養 可降低嬰兒感染性疾病的發生餵養方式與兒童急性白血病(AL)的相關性報導不一,目前的觀點傾向於母乳餵養可降低
兒童白血病 發生的危險
與感染相關的其他因素包括免疫接種動物接觸史、藥物套用史(如
氯黴素 )季節變化等它們與兒童白血病的確切相關性尚無定論
(4)先天性
基因 (遺傳)因素:早期文獻報導對確診時年齡2個月和14歲的同卵雙胞胎通過分子生物學方法研究證明來自宮內同一胎兒同一細胞擴增或突變後的
同卵雙生 的同胞ALL的發生是一致的由於這種疾病在
雙胞胎 沒有臨床的和生物學上的差異。有人猜測某些獨生子的白血病可能起源於胎內並且進一步推測附加因素或出生後環境因素導致在出生後的任何時間發生白血病。為驗證這一假設研究者用新生兒血印記檢測現有的克隆或與患者相關的特殊白血病相關融合基因序列(TEL-AML1),發現t(12;21)與TEL的非易位
等位基因 的缺失之間的相關性在B系ALL最常見這些研究提示兒童
急性淋巴細胞白血病 為胎
內起源 。
有報告
白血病 患兒(包括ALL)同胞的白血病發病率比普通人群高2~4倍。
單卵雙胎 中一個發生白血病後另一個發生白血病的機會高達25%;發病年齡越小另一個發病的機會越高;當發病年齡>7歲時,另一個發病的機會明顯減少說明白血病的發生可以有先天性遺傳因素參與,但確切的基因因素尚未十分明了
2.分型 根據
形態學 免疫學和遺傳學分型(即MIC分型),可分為幾個亞型。治療及預後與分型密切相關
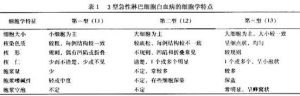
(1)形態學分型:目前國際通用FAB分型,即按照細胞大小、核漿比例、
核仁 大小及數目、胞漿嗜鹼程度將急淋分為L1~L3三型(表1)。
小兒ALL以L1型最多見,占70%左右,L2型為25%左右L3型僅占0%~4%。
(2)免疫學分型:白血病發生學的成熟遏制學說認為白血病是造血細胞的某一克隆被阻滯在某一分化階段上並異常增殖的結果因此
白血病 細胞具有相應的正常
細胞分化 階段的免疫標誌國際上用“分化簇”(CD:cluster of differentiation)對單克隆抗體(McAb)統一命名
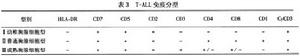
將ALL主要分為T細胞系和B細胞系兩大類兒童ALL以B細胞係為主占80%左右。B細胞系ALL又可分為若干亞類目前尚無統一標準,各家不一,有的分為4型(表2),有的分為6型T細胞學ALL一般分為3型(表3)
由於
白血病 細胞具有“異質性”和“非同步性”,其免疫表型的表達差異非常大少數病人可以同時或先後表達兩種或兩種以上系列的特徵稱為
混合性白血病 (mixed lineage leukemiaMAL)或
雜合性 白血病(hybrid leukemiaHAL)這類白血病可能起源於
多能幹細胞 一般分為3型:
①雙表型:指同一個白血病細胞同時表達淋系和髓系特徵。
②雙系型(雙克隆型):指同時存在具有淋系和髓系特徵的兩群獨立細胞群
③轉換型:指白血病細胞由一個系列向另一個系列轉化
①數量異常:
A.超二倍體:約占ALL的1/4以前B-ALL多見雖然
二倍體 可累及任何一條
染色體 ,但以4、610141718、2021及
X染色體 最常見
A.t(1;19)(q23;p13):多見於兒童pre-BALL。位於19p13的
E2A基因 是一種
看家基因 屬於
HOX基因 家族。E2A/PBXI
融合基因 的pre-BALL預後和治療效果較差
B.t(12;21)(p13;q22):這是近些年才被發現的一種較為常見的
染色體易位 。位於12p13的TEL基因具有螺旋-迴轉-
螺旋結構 同樣編碼一種轉錄因子。具有這種易位的ALL預後較好,原因不清。
C.t(8;21)(q22;q22)易位:主要見於AML-M2位於8q22的ETO基因含有2個
鋅指結構 可能編碼一種轉錄因子。但目前認為AML1/ETO
融合基因 的形成並非
白血病 發病的關鍵因素必須有其他遺傳學改變才能造成發病。
D.t(9;22)(q34;q11):見於95%的CML和3%~5%的兒童ALL。這是最為經典的白血病
染色體易位 ,其結果是產生了
BCR /ABL(break-point cluster region gene,
Abelson oncogene)融合基因。這被認為是細胞惡變的根本原因另外
BCR/ABL融合基因 還被認為是檢測微小殘留病(MRD)的重要標誌。
E.t(15;17)(q24;q21):見於AML-M3形成PML/RARα融合基因具有這種易位的AML-M3對全反式維A酸治療較敏感,同時,PML/RARα也被認為是檢測MRD的重要標誌
G.涉及MLL基因的
染色體畸變 :MLL基因位於11q23又稱為ALL1HRX、Hrtx1基因具有轉錄因子和DNA
甲基轉移酶 的許多特性涉及它的染色體畸變包括t(1;11)、t(4;11)t(6;11)t(9;11)t(10;11)、t(11;17)、t(x;11)等多見於嬰兒
白血病 ,包括ALL、AML和MDS等因此被稱為mixed lineage leukemia gene患兒預後多較差
由於白血病涉及的染色體易位如此眾多如何快速簡便地檢出這些畸變便成為臨床亟待解決的問題。北京兒童醫院目前已建立並開始採用
多重PCR 方法檢測新診斷白血病患兒的染色體易位情況這種方法採用8個平行PCR反應,同時檢測29種白血病相關的染色體結構畸變/易位(包括87種mRNA剪接變異株)。已檢出的畸變有t(1;19)t(7;10)、t(8;21)、t(9;22)t(12;21)、t(15;17)TAL1Ddup(11q23)等8種
染色體畸變 (13種剪接變異株)
(4)MIC分型:1985年4月在比利時組成了MIC協作組,將形態學免疫學和細胞遺傳學結合起來,制定了MIC分型(表45)。
(5)臨床分型:臨床一般將ALL分為標危(standard riskSR)和高危(high risk,HR)兩大類。1998年6月山東蓉城
中華醫學會 兒科
血液學 組“小兒急淋
白細胞 診療建議”分型如下:
C.
染色體核型 為t(4;11)或t(9;22)異常
F.
潑尼松 誘導試驗60mg/(m2·d)×7天第8天外周血白血病細胞≥1×109/L(1000/μl),定為潑尼松不良效應者
G.標危ALL誘導化療6周不能獲完全緩解(CR)者
②根據上述危險因素,臨床分型分為2型:
A.高危ALL(HR-ALL):具備上述任何一項或多項危險因素者。
B.標危ALL(SR-ALL):不具備上述任何一項危險因素者,伴有或不伴有t(12;21)
染色體核型 和≥50條染色體的高二倍體B系ALL。
發病機制 染色體易位在許多白血病中可以見到。易位可隱藏一個基因到新的位置,使新的初始致癌基因變為
啟動子 或在其他獨特基因上成為增強因子。例如在t(8;14)這個染色體易位上
免疫球蛋白 重鏈基因的增強因子是與
MYC基因 接近的並列成分,導致Burkitts
淋巴瘤 。易位也可以發生在兩個基因之內導致
基因重排 和
嵌合蛋白 如在ALL和CML上發現的t(9;22)易位
混合
白血病 (mix linge leukemiaMLL)基因重排和11q23異常可以發生在淋巴系和髓系白血病如
Ph染色體 可以在Ph染色體陽性ALL的髓系或紅細胞系的早期細胞中檢出提示在ALL患者除
淋巴系統 外可累及多系
造血幹細胞 。
臨床表現 各類型
小兒急性白血病 臨床表現相似其主要臨床表現歸結為
貧血 、出血發熱和
白血病 細胞對全身各臟器組織浸潤引起的症狀。除T-ALL起病較急外一般起病相對緩慢。通常表現為進行性蒼白乏力、
食慾減退 盜汗 、虛弱
低熱 和
出血傾向 亦有最初表現為
上呼吸道感染 的症狀或出現
皮疹 然後出現無力等症狀從起病到診斷可長達數月,也可以驟然起病,以不規則發熱急速的進行性蒼白、明顯的出血症狀和骨關節疼痛等症為首發表現起病數天至數周即得以診斷但多數病人在起病後2~6周內明確診斷
1.貧血 常早期出現輕重不等表現為進行性蒼白以皮膚和口唇黏膜較明顯可出現活動後氣促心悸、顏面水腫、虛弱無力等症狀T-ALL由於發病較急確診時貧血反而不嚴重。貧血和出血程度常不成比例。
2.出血 極大部分患兒均有不同程度的皮膚和黏膜出血表現為皮膚
紫癜 、烏青和
瘀斑 甚至發生
皮下血腫 。
齒齦出血 、鼻出血、口腔黏膜滲血嚴重者可出現眼底
視網膜 出血,導致視力減退
顱內壓增高 。消化道和泌尿道出血臨床表現為便血、嘔血和尿血
顱內出血 時表現為頭痛、嘔吐抽搐和昏迷等。
出血原因除
血小板 的質與量異常外,亦可由於
白血病 細胞對
血管壁 的浸潤性損害使滲透性增加。T-ALL偶可發生DIC,可能由於原始T-ALL細胞釋放
凝血酶 、激酶等物質所致。
(2)
骨關節 浸潤:約有1/4的患兒以骨或關節痛為起病的主要症狀。這是由於白血病細胞浸潤
骨膜 或骨膜下出血所致。表現為持續性並陣發性加劇的骨關節疼痛或腫痛,行動受礙多見於膝、
脛骨 胸骨 踝、肩、腕
肘關節 處易被誤診為風濕關節炎或
骨髓炎 (4)
腮腺 浸潤:表現為兩側腮腺無痛性增大質地較硬,無
壓痛 或輕度壓痛
(5)
睪丸 浸潤:睪丸浸潤時有單側或雙側睪丸無痛性腫大,質地堅硬壓痛不明顯
透光試驗 呈陰性。隨著病程的延長,若不採用有效預防措施睪丸
白血病 的發生將增多。合併睪丸白血病的平均病程為13個月,大多在骨髓處於完全緩解時發生若不及時治療,則可導致骨髓復發。
(6)腎浸潤:ALL時腎浸潤並不少見可因
水腫 、
尿量 尿色 改變而就診有時腎臟明顯腫大可在兩側腹部觸及腹部B型超聲或CT可見腎臟有多發性浸潤灶。
併發症: 1.貧血和出血 貧血進行性加重可出現心悸耳鳴
溶血 和不同程度的出血。可發生
皮下血腫 眼底視網膜出血,導致視力減退。
消化道 和泌尿道出血
顱內出血 時、
顱內壓增高 ,表現為頭痛嘔吐、抽搐和昏迷等。消化道和顱內出血可致患兒死亡
診斷 臨床上出現典型的症狀體徵,
外周血 中查見
白血病 細胞,骨髓中原始加
幼稚細胞 ≥30%。此時診斷急性白血病並不困難。若是發病初期症狀、體徵不典型,外周血不見原幼細胞此時診斷有一定難度
1.
感染性發熱 對不明原因的貧血出血發熱和不能以感染完全解釋的發熱以及多臟器浸潤症狀表現者應考慮本病診斷。
2.貧血肝、脾
淋巴結腫大 對體格檢查中發現有與出血程度不相符的貧血肝脾淋巴結腫大者尤其有
腮腺 、
睪丸 和軟組織浸潤腫大者,以及伴有
骨關節 痛明顯者應考慮本病的診斷
3.實驗室檢查 外周血發現≥2個系列異常或見有幼稚細胞者應考慮到本病的可能進一步做
骨髓塗片 檢查
骨髓檢查 對於診斷十分重要,但應注意
白血病 細胞在體內分布不均勻現象,必要時行多部位穿刺方能確診。
鑑別診斷 應與下列疾病進行鑑別:
3.
惡性組織細胞病 本病是單核-
巨噬細胞系統 惡性增殖性疾病臨床上可出現發熱貧血出血肝、脾和淋結腫大以及全身廣泛浸潤性病變,很難與白血病鑑別。外周血象也與白血病相似出現Hb和BPc下降白細胞降低者超過半數且可發現幼稚紅細胞和幼稚粒細胞,只是若發現惡性組織細胞則高度提示本病骨髓增生活躍或減低,網狀細胞增多,可見到多少不等的組織細胞,按形態可分為一般異常組織細胞、單核樣組織細胞、淋巴樣組織細胞、多核巨型組織細胞和吞噬型組織細胞,如果見到大量吞噬型組織細胞且出現一般異常組織細胞,則支持診斷本病惡性組織細胞增生症缺乏特異性診斷手段
骨髓象 支持而臨床不符合者不能診斷,反之臨床支持而骨髓象不符合者不能排除診斷所以本病依靠綜合分析診斷有時骨髓及
淋巴結 等活檢可以提兒童血液與腫瘤疾病供一定證據。
6.
骨髓增生異常綜合徵 (myelo dysplastic syndrome,
MDS ) 是一組因造血幹細胞受損而致骨髓
病態造血 和功能紊亂性疾病本病以貧血為主要表現,可伴有不同程度的出血、肝脾
淋巴結腫大 ,少數病例還有骨痛MDS不僅應與急性白血病相鑑別而且有20%~30%的病例最終轉變成急性白血病本症骨髓象呈現三系或二系或任一系的病態造血紅系如比例過高(>60%)或過低(<5%),出現環鐵粒幼紅細胞核分葉碎裂或多核等紅細胞巨核系可出現
淋巴 樣小巨核單圓核小巨核多圓核
巨核細胞 等粒-單核系可見原粒或
幼單核細胞 增多和形態改變,但是原始細胞(或原單+幼單)的比例<30%,因而不能診為急性白血病。
國外有人提出ANLL的診斷步驟可按圖1進行臨床考慮其中包括與MDS的鑑別診斷。
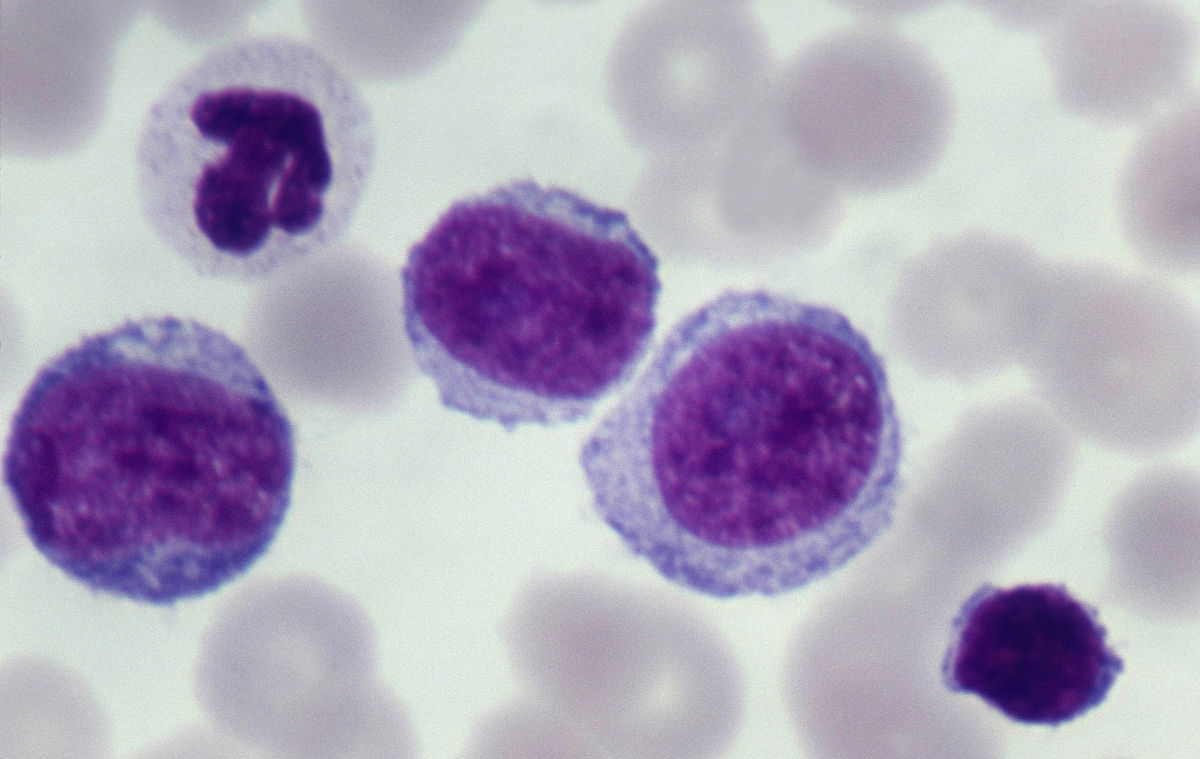
檢查 實驗室檢查: 1.外周
血象 白細胞 的改變是本病的特點白細胞總數可高於100×109/L,約30%在5×109/L以下。低增生性ALL時白細胞數可很低,外周血象類似
再生障礙性貧血 ,三系均降低,也未見
幼稚細胞 。高增生性時可高至數十萬,較多患兒
外周血 中可見到幼稚細胞未成熟
淋巴細胞 在分類中的比例可因診斷早晚和分型而不同多數超過20%,亦有高達90%以上者。少數病人在早期不存在未成熟淋巴細胞,此類白血病分類中以淋巴細胞為主。
外周血象紅系髓系和巨核系中常有≥2系的異常變化,多數患兒有貧血貧血一般為正細胞正色素性。但嚴重者其MCV可能增高可能由於骨髓
紅細胞生成 障礙所致。網織
紅細胞 正常或低下貧血程度輕重不一發病急者貧血程度較輕。
血小板 大多減少,約25%在正常範圍。
少數患兒可因
外周血 變化不明顯或基本正常而被忽略並延誤診斷。外周血的異常變化不能作為
白血病 的診斷依據,當臨床懷疑白血病時,需及時作
骨髓穿刺 塗片以明確診斷。
2.
骨髓象 (
細胞形態學 檢查)
骨髓檢查 是確立診斷和評定療效的重要依據絕大多數白血病
骨髓塗片 表現為有核細胞增生活躍明顯活躍或極度活躍5%~10%的急性白血病骨髓增生低下稱之為
低增生性白血病 。診斷ALL的主要依據是骨髓
有核細胞 中原始和幼稚
淋巴細胞 總和≥30%多超過50%以上甚至高達90%以上。有的骨髓幾乎全部被
白血病 細胞所占據,此時正常的紅系、巨核細胞系粒系常明顯受抑甚至消失。除了白血病細胞明顯增生外有時可伴有不同程度的骨髓纖維組織增生此時抽取骨髓液較為困難,稱之為“
乾抽 ”現象。ALL骨髓塗片
組織化學 染色的典型表現為
糖原 呈陽性或強陽性,
過氧化物酶 陰性,非特異性酯酶呈陰性。根據法國美國和英國(FAB)形態學分類,ALL分為L1、L2L3型90%兒童ALL形態分型為L1細胞形態較小;L3型
腫瘤細胞 的形態與
Burkitt淋巴瘤 細胞相似;L2細胞大小不均介於L1和L3之間。僅依靠
骨髓細胞 形態學不能鑑別ALL還是
非霍奇金淋巴瘤 骨髓浸潤。
(1)T系
淋巴細胞 型(T-ALL):約占兒童ALL 10%~15%常表達
T淋巴細胞 分化抗原標誌如CD1、CD2、CD3、CD4CD5CD7、
CD8 以及TdT等。臨床上可伴有縱隔增寬
外周血 白細胞計數 高。
(2)B系淋巴細胞型(B-ALL):約占兒童ALL 80%~90%可大致分為未成熟型(以發育成熟過程依次包括B
淋巴 祖細胞 性早期前
B淋巴細胞 性和前B淋巴細胞型)和相對成熟型。胞漿免疫球蛋白(CyIg)從無到有繼之
細胞膜 表面免疫球蛋白(SmIg)的出現反映了
B細胞 向成熟方向發育的過程。SmIg陽性常提示為相對成熟型B系
淋巴細胞 其他常用的分化抗原標記有TdTHLA-DRCD19CD22、CD10、CD20以及CD24其中CD20、CD10齣現較晚至前B淋巴細胞型才出現。成熟B淋巴細胞
白血病 和B細胞性
非霍奇金淋巴瘤 細胞一樣常表達smIg。
4.細胞遺傳學檢查
(2)
染色體結構異常 :常見的相對
成熟B細胞 型ALL
染色體異常 有t(8;14)t(2;8)t(8;22),與
B細胞 性非霍奇金淋巴瘤相同B系未成熟型ALL常見的染色體結構異常有t(11;v)t(9;22)、t(1;19)t(4;11)、t(12;21)等。常見的T-ALL染色體結構異常有t(11;14)t(8;14)t(10;14)t(1;14)t(4;11)等。
現代
白血病 診斷應包含形態學(Morphology,M)、免疫學(Immunology,I)和細胞遺傳學(Cytogenetics,C)即MIC綜合診斷。ALL還應作出臨床危險型診斷以指導臨床治療方案的選擇。
6.臨床危險程度分型 小兒ALL有明顯影響
預後 的危險因素,包括:
(2)年齡1歲或>12歲
(3)診斷時有CNSL
(4)
染色體核型 為t(9;22)或t(4;11)異常者。
(5)
潑尼松 誘導試驗60mg/(m2·d)×7天,第8天外周血
白血病 細胞≥1×109/L(1000/μl)或治療15~19天時骨髓幼稚淋巴細胞比例仍大於25%具備上述危險因素≥1項者為高危ALL(HR-ALL)提示預後較差,需較強烈的治療方案;不存在其中任何一項者為標危ALL(SR-ALL),提示
預後 較好在合理治療下,長期無病
生存率 可達70%~85%
7.其他檢查 出血時間延長可能由於
血小板 質與量異常所致。白血病發病時可造成凝血酶原和
纖維蛋白 原減少,從而導致
凝血酶原時間 延長和出血。
其它輔助檢查: 1.X線平片
(1)胸部X線平片檢查:有5%~15%的患兒可見
縱隔 增寬和腫物為
胸腺 浸潤或縱隔
淋巴結腫大 。
(2)骨X線平片:長骨片約50%可見廣泛骨質稀疏,骨幹骺端近側可見密度減低的橫線或橫帶即“白血病線”。有時可有蟲蝕樣病變,可見骨質缺損及骨膜增生等改變
2.腹部B型超聲或CT 可發現部分病例有不同程度的腎臟肝臟的浸潤性病變及腹腔淋巴結腫大。有骨浸潤時
骨掃描 有異常濃集灶。
治療 由於新的抗
白血病 藥物不斷出現新的化療方案和治療方法不斷改進ALL的
預後 明顯改善現代的治療已不是單純獲得緩解,而是爭取長期存活最終達到治癒,並高質量生活。
1.原則
聯合化療 是白血病治療的核心並貫徹治療的始終其目的是儘量殺滅白血病細胞,清除體內的
微量殘留白血病 細胞,防止耐藥的形成恢復骨髓
造血功能 儘快達到完全緩解儘量少損傷正常組織,減少治療晚期的後遺症。
ALL化療的主要原則是按臨床危險型選擇不同強度的治療方案,強調早期連續合理強烈化療和堅持長期持續化療,同時給予
鞘內 化療預防CNSL的發生。化療過程中應密切觀察,進行有效的對症治療和併發症的預防和治療包括瘤細胞性栓塞
腫瘤溶解綜合徵 ,水、
電解質 平衡貧血,出血DIC,各臟器特別是心肝、腎正常功能的維持,各種感染及各種
化療藥物 毒性反應 的防治同種異體
造血幹細胞移植 適用於難治性及復發性病例,宜在CR後進行移植。
2.ALL化療 包括誘導緩解治療、緩解後鞏固治療CNSL預防
性治療 、再誘導治療、維持和定期強化治療。
①完全緩解(CR):
A.臨床無貧血、出血、感染及白血病細胞浸潤表現。
②部分緩解:臨床、血象及骨髓象3項中有1或2項未達到完全緩解標準,骨髓象中原始細胞加早幼細胞<20%
③未緩解:臨床血象及骨髓象三項均未達到完全緩解標準骨髓象中原始細胞加早幼細胞>20%,其中包括無效者。
(2)緩解治療:此階段治療目的是在
白血病 細胞還沒產生耐藥前,用化療的方法迅速最大限度去殺傷白血病細胞,恢復骨髓正常
造血功能 同時避免發生致命的
化療藥物 毒性反應 及感染。通常用幾種藥物
聯合化療 能殺死99%的白血病細胞,惡性細胞從1012減少至108使骨髓中原幼淋<5%即達到CR小兒ALL的誘導緩解治療中套用2種藥物VP使90%以上小兒獲CR,加L-ASP,CR率僅稍有提高在高危小兒ALL治療中用四、五種藥聯合化療,CR率雖然不增加並且增加了藥物毒性帶來的風險,但主要的是減少復發提高長期EFS率。此階段支持治療是保證強化療順利進行的關鍵需合理輸注紅細胞、
血小板 和
非格司亭 (G-CSF)預防和治療感染,使病人能安全度過
骨髓抑制 期。
ALL誘導緩解治療首選國內外常用的標準方案VDLP方案:即
長春新鹼 (VCR)1.5mg/m2,每周1次×4次;
柔紅黴素 (
DNR )30mg/m2,每周1次,共2~3次(HR-ALL用3次,SR-ALL用2次);
門冬醯胺酶 (L-Asparaginase,L-ASP)6000~10000U/m2隔天1次,共6~8次(HR-ALL用8次,SR-ALL用6次);
潑尼松 (Prednisone)每天60mg/m2分3次口服共28天,減停7天。95%病人在28~35天時能達完全緩解(CR)。
白血病 達緩解後如沒有進一步的治療,剩下108白血病細胞將增殖,導致復發。在CR後進一步減少殘留白血病細胞的治療包括鞏固治療維持治療及中樞神經系統預防
性治療 (3)緩解後鞏固治療:鞏固治療或後期強化療指在CR後立即進行幾個療程的強烈化療早期強化療在用哪些藥物聯合鞏固強度上各治療組尚無統一的方案。
BFM治療組在維持治療早期再重複誘導緩解方案VDLP。美國SJCRH則用替尼泊苷和
阿糖胞苷 (Ara-C)改進了高危型ALL的
預後 。
推薦用CAT方案,
環磷醯胺 (CTX)800~1000/m2第1天,阿糖胞苷(Ara-C)每天100mg/m2×7天2次/d(每12個小時1次),皮下注射,
硫鳥嘌呤 (6-TG)或
巰嘌呤 (
6-MP ),每天75mg/m2,晚間頓服×7天;HR-ALL時可採用中大劑量阿糖胞苷(Ara-C),1~2g/m2每12個小時1次×(4~6)次,環磷醯胺(CTX)和巰嘌呤(6-MP)同上
(4)CNSL及其他髓外
白血病 預防:由於體記憶體在“血-
腦脊液 屏障”和“
血睪屏障 ”等白血病細胞的天然藥物性庇護所髓外白血病的復發直接影響白血病的存活時間,導致全身復發,因此庇護所預防
性治療 日益受重視若不進行庇護所預防,有40%的小兒ALL在CR後3年內發生CNSL,CNSL占小兒ALL復發的75%。男孩7.7%發生
睪丸 白血病CNSL發生是因為中樞神經系統是
白血病 細胞的庇護所往往微量白血病細胞在診斷ALL時已潛入,由於
血腦屏障 的存在,常用的
化療藥物 如
長春新鹼 (VCR)、
柔紅黴素 (
DNR )、
阿糖胞苷 (Ara-C)、
環磷醯胺 (CTX)
門冬醯胺酶 (L-ASP)等不易透過血腦屏障殺滅腦脊液中的白血病細胞,而往往在腦膜上增殖並發生CNSL繼而導致骨髓及其他髓外復發。因此庇護所預防
性治療 十分重要,應從化療之初就開始並貫穿整個維持治療。主要措施:
①採用大劑量
甲氨蝶呤 (HD-MTX)增加血液和
腦脊液 中的藥物濃度,可有效預防CNSL及
睪丸 白血病的發生。誘導治療開始後2~5天起每周
鞘內注射 甲氨蝶呤(
MTX )阿糖胞苷(Ara-C)
地塞米松 (DX)“三聯”化療1次共5~6次,以後每3個月1次至治療結束甲氨蝶呤(MTX)劑量為12.5mg/m2(最大12.5mg);
阿糖胞苷 (Ara-C)1mg/kg(最大50mg);地塞米松(DX)0~2歲為2.5mg>2歲5mg
③
鞘內 化療:
鞘內注射 甲氨蝶呤 (
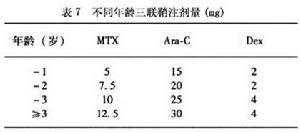
MTX )和(或)阿糖胞苷(Ara-C)對預防和治療CNSL有肯定的療效,目前多主張按年齡的三聯鞘注給藥
大劑量甲氨蝶呤(HD-MTX)在鞏固治療休療結束後開始,每隔10~15天1次,用3次,以後每3個月1次,高危(HR-ALL)共用6~9次,低危(LR-ALL)共用4~6次。每次甲氨蝶呤(MTX)劑量為3000mg/m2,1/6
靜脈推注 15min(不超過500mg),餘量於24h內均勻滴入。在推注後30~120min
鞘內 注入“三聯”化療。於治療起第37小時用四氫葉酸鈣(
CF )151mg/m2共6~8次,首劑靜注,以後可改每6小時1次口服有條件者檢測血漿MTX濃度(<0.1mol/L為無毒性濃度),以調整四氫葉酸鈣(CF)套用的次數和劑量若44h時<1mol68h時<0.1mol則CIF用6次即可,否則要延長並增加解救劑量。
預防毒性措施包括水化鹼化,化療前3天起口服碳酸氫鈉0.5~1.0g,3次/d化療當天起用5%碳酸氫鈉5ml/kg靜滴,每天補液1/5張含鈉溶液3000ml/m224h內均勻滴入,共4天。用藥前肝腎功能必須正常。
④顱腦放療:放療對小兒智力生長發育的影響越來越多地引起人們的關注因此目前大部分治療組主張放棄顱腦放療作為中樞神經系統預防治療在整個化療過程中每2個月1次鞘注或大劑量
甲氨蝶呤 (HD-MTX)靜注及同時鞘注只對有CNSL發生高危因素的患兒進行顱腦放療,而且放療劑量由24Gy減至18Gy
(5)再誘導治療:一般在第3次大劑量甲氨蝶呤(HD-MTX)+
四氫葉酸 鈣(
CF )10~14天起,HR-ALL的早期強化治療分2個階段第1階段用VDLP與誘導治療的不同之處是
柔紅黴素 (
DNR )和
長春新鹼 (VCR)每周1次共2次
潑尼松 劑量每天45mg/m2共14天逐漸減量7天內停藥口服第2階段用
依託泊苷 (VP-16)每次200mg/m2
阿糖胞苷 (Ara-C)每次300mg/m2每3天1次,共3次靜滴SR-ALL的早期強化只用VDLP
(6)維持治療和定期強化治療:如果在誘導緩解及CNSL預防後不再化療,幾周至幾個月內
白血病 就會復發維持治療目的是進一步減少白血病細胞主要用藥硫
嘌呤 (
6-MP )和
甲氨蝶呤 (
MTX )間斷加用
長春新鹼 (VCR)和
潑尼松 這種治療對60%~80%的標危ALL均有效並能很好地耐受。硫嘌呤(6-MP)和甲氨蝶呤(MTX)的強度對治療是否能成功很重要,化療中低的累計劑量伴隨一個高復發率。在維持治療中,
白細胞計數 控制在小於3.5×109/L的ALL復發少於
白細胞 高者。口服
化療藥物 的
生物利用度 有很大不同這可能是導致失敗的原因口服標準劑量硫
嘌呤 (6-MP)和甲氨蝶呤(MTX)後
血藥濃度 可有6~20倍之差因此對每個個體進行血藥濃度特別是細胞內藥物濃度監測來調整硫嘌呤(6-MP)和甲氨蝶呤(MTX)劑量很有必要。硫嘌呤(6-MP)和甲氨蝶呤(MTX)生物利用度通過藥時動力因此晚上服藥比早上好。對維持治療中每隔4~12周加
長春新鹼 (VCR)和VP有爭論。北京兒童醫院主張每隔4周加用這些藥。
後期強化治療:許多治療組主張在維持治療早期加上再誘導緩解強化治療,如BFM加上VDLP及硫嘌呤(
6-MP )、
阿糖胞苷 (Ara-C)和
環磷醯胺 (CTX)CCG用VALD,SJCRH則用替尼泊苷和阿糖胞苷(Ara-C)。
維持治療時間:維持治療需要多長時間是個有爭議的問題。多數的ALL在臨床CR一年內MRD陽性,第2年仍有許多病人呈現陽性。理論上講治療應繼續直至剷除所有
白血病 細胞。為此所需時間無疑對每個病人都不同一般總治療時間2~3.5年
甲氨蝶呤(
MTX )
肌注 20~30mg/m2每周1次共3周,同時
巰嘌呤 (
6-MP )每天75mg/m2共21天口服;後接
長春新鹼 (VCR)1.5mg/m2次,
潑尼松 劑量每天45mg/m2共7天;如此每4周1個周期,周而復始,並根據個體外周血
白細胞計數 調整
甲氨蝶呤 (MTX)和巰嘌呤(6-MP)劑量,使白細胞計數維持在(2.8~3.0)×109/L。HR-ALL患兒每12個月用VDLP一療程(同再誘導第一階段)作為強化治療SR-ALL總治療期限男孩為3年女孩2.5年;HR-ALL則各延長6~12個月。
(7)CNSL治療:按劑量“三聯”鞘注化療8次隔天1次至
腦脊液 中
腫瘤細胞 消失(一般鞘注2~3次後腦脊液大多轉陰),以後每周2次至總共8次。如CNSL發生在骨髓CR期,則需在腦脊液轉陰後增加1次全身強化治療,以避免CNSL後全身復發,然後做全顱放療(60Co或
直線加速器 )治療,總劑量為18Gy,分成15次照射對已有足夠身高的大年齡患兒同時做全
脊髓 放療,對小年齡患兒則在全顱放療的同時增加
鞘內 化療每周1次共2次如起病時已有CNSL則在再誘導治療結束後做全顱全脊髓放療放療後每8周鞘注“三聯”1次,直至終止治療
(8)
睪丸 白血病 (TL)治療:
睪丸異常 腫大,懷疑為TL時,最好能做活檢以確診。如為雙側TL,則做雙側睪丸放療總劑量為24~30Gy。若是單側TL,可做病側睪丸放療(以病側為主,但對側常受影響)或病側
睪丸切除 如起病時已有TL,應按原治療方案進行全身性誘導鞏固等治療在誘導結束後做TL局部治療若CR中發生TL在治療TL的同時給予VDLDX和
依託泊苷 (VP-16)+
阿糖胞苷 (Ara-C)方案各1個療程做全身治療,以免由TL引發骨髓復發。
(9)併發症的預防及支持治療:
①防止
腫瘤細胞 溶解綜合徵:
淋巴細胞白血病 細胞對化療常十分敏感在化療開始時大量的腫瘤細胞被藥物殺傷破壞溶解因此而誘發腫瘤細胞溶解綜合徵,此種情況常發生在
化療 剛開始1周內主要表現為
高尿酸血症 、
高血鉀 高血磷、低血鈉
低血鈣 等
電解質紊亂 ,
酸鹼平衡 失調和
少尿 無尿 、DIC等為減慢腫瘤細胞溶解的速度避免腫瘤細胞溶解綜合徵形成,對於
外周血 白細胞計數 大於50×109/L者初始化療應相對減弱,如僅給
潑尼松 (強的松)和
長春新鹼 ,在3~7天后才給予較強的化療對所有誘導期第1~2周的新病人均應給予3000ml/m2水化5%碳酸氫鈉5ml/kg鹼化血液和尿液,監測電解質、
尿酸 、DIC指標,保證
水電解質 平衡同時服用
別嘌醇 200~300mg(m2·d),以減少尿酸的形成防止尿酸性
腎小管 栓塞所致的
腎 功能不全
②預防感染:注意食品及環境衛生,減少感染機會套用磺胺甲噁唑(
SMZ ) 25~50mg/(kg·d)
誘導期 可全程套用,緩解後每周用3天,防止發生
卡肺囊蟲肺炎 靜脈套用
人血丙種球蛋白 每次200~400mg/kg可能減少某些感染的機會
化療 期間禁止接種活疫苗以避免疫苗散布感染。加強口腔和
肛門 護理,及時治療如
齲齒 等潛在感染灶以減少
內源性感染 。及時處理淺表
真菌感染 以減少深部真菌感染。
③套用
門冬醯胺酶 (L-ASP):套用門冬醯胺酶(L-ASP)時宜
低脂飲食 ,減少合併
急性胰腺炎 的機會;注意血白蛋白水平,明顯低下時及時補充以避免低蛋白血症加重感染定期進行心肝
腎功能檢查 避免臟器功能不全
④套用造血刺激因子:適當套用造血刺激因子縮短
骨髓抑制 期,可能減少感染機會。可套用
莫拉司亭 (GM-CSF)或
非格司亭 (G-CSF)對緩解中病人在強
化療 48h後根據化療強度適時套用3~5μg/(kg·d)至白細胞>3.0×109/L
⑤血製品套用:在貧血出血的預防和治療中十分重要。
(10)隨訪與病人管理:應將
白血病 治療視為一個系統性工程隨訪及病人管理是其中十分重要的部分以保證按時實施治療計畫要做到正確記錄
臨床實驗室 檢查結果和所有的治療,詳細向病人交代下一階段的治療計畫及離院後的注意事項未按時來院接受治療及隨訪時主動與家長聯繫減少失訪者以提高治癒率和統計的正確性。
3.復發的治療 小兒ALL復發最常見的部位是骨髓,其次是中樞神經系統和
睪丸 。少見復發部位有
淋巴結 、
胸膜腔 、骨皮膚等。
美國SJCRH資料表明80%小兒ALL獲長期存活,20%ALL在第1年內發生復發從第2年到第4年復發每年為2%~3%4年後不再發生。德國BFM研究表明若自診斷起活6年者無復發,則獲長期存活和治癒是可能的。
大多數復發是由於原來惡性克隆組織的再生在治療期復發的主要原因被認為是細胞產生了耐藥。偶爾有復發的
白血病 細胞的MIC分型不同於診斷時的惡性克隆。另外一種是完全不同於白血病的繼發腫瘤。
北京兒童醫院 在1000餘例小兒ALL治療停止後4例病人發生
肝癌 ,即繼發腫瘤。
復發經
化療 有可能獲第2次緩解,但取決於第1次持續完全緩解時間第1次時間短於18個月者
預後 差,獲第2次緩解很少超過數月。只有20%患兒獲存活患兒CCR時間超過18個月和那些經治療後停藥復發而且用不強烈的藥獲第1次緩解的約75%能獲存活復發部位也是治療成敗的重要條件骨髓復發比單純髓外復發差;男孩病理髮現的
睪丸 白血病比明顯臨床睪丸復發治療有效。
(1)骨髓復發:骨髓復發病人的治療比初治者困難,如在治療過程中復發,則需選擇未用過的藥物或加大劑量組成新的治療方案如用
伊達比星 (去甲氧柔紅)替尼泊苷、
米托蒽醌 異
環醯胺 、
阿柔比星 (
阿克拉黴素 )等停止治療後的復發可採用原誘導方案如VDLD方案或加大藥物劑量患兒一旦獲緩解,有條件者應做
骨髓移植 (BMT),BMT後CCR可達20%。如無條件作BMT需繼續採用強維持及加強治療CNS預防治療也是必不可少的
(2)CNSL復發:儘管在ALL治療中採取了CNSL預防治療,仍有5%~10%患兒發生CNSL。CNSL可單獨復發,也可伴骨髓復發或其他髓外復發復發經常是無症狀,患兒定期做CNSL預防
性治療 ——
鞘內注射 時,常規做
腦脊液檢查 時發現目前CNSL診斷標準為
腦脊液 白細胞計數>5/mm3伴細胞離心沉澱發現
幼稚細胞 ;或
CNS 受累不伴腦脊液陽性發現;美國CCG研究表明腦脊液
白細胞計數 <5/mm3而發現TdT(+)的幼稚細胞診斷也可成立雖然90%CNSL患兒能獲緩解但CNSL復發往往同時或繼發骨髓復發或其他髓外復發因此長期存活僅20%~35%影響患兒的存活因素有:單獨CNSL;患兒CCR一年以上;CNSL復發前僅接受鞘注而未用放療做CNSL預防治療者
預後 均較好。
對CNSL患兒先做三聯鞘注,第1周3次,第2周2次,第3、4周各1次同時對全身做強
化療 ,然後做頭顱24Gy及脊髓12Gy照射,此後堅持每8周鞘注1次國外有採用Ommaga貯存等。植入顱內做腦室內
化療藥物 直接注入
側腦室 ,使藥物均勻分布於整個
蛛網膜下腔 ,並可減少反覆
腰椎穿刺 帶來的痛苦。但有合併感染的危險
(3)
睪丸 白血病 :睪丸白血病復發多在CCR 2年後,停止化療後復發者較多見
有研究表明在化療後2~3年繼續臨床緩解者中有10%男孩有隱匿的睪丸白血病。單純睪丸白血病如發生在接受化療期間僅20%獲3年的長期存活;在治療後發生48%獲長期存活;在停止化療後發生者100%可獲長期存活睪丸白血病多無自覺症狀,僅出現硬腫開始多為一側腫大若不進行治療可波及對側。睪丸白血病的治療主要是同時對兩側睪丸進行放療,總量24Gy。同時需進行全身再誘導緩解治療
治療方案:國內外各治療組治療原則相同基礎上根據各自種族經濟特點及臨床經驗有許多方案目前國內常用方案:
①標危方案:
A.誘導緩解治療:採用VDLD方案(28天)。
VCR(V):1.5mg/(m2·d)(最大量2mg/次)靜推,每周1次,共4次(d1、d8d15、d22)。
Dex(De):6mg/m2口服分3次1~21天、第22天起減停1周
DNR (D):30mg/(m2·d),靜注1~2天。
L-ASP(L):5000U/(m2·d)肌注隔天共8次。若第15天骨髓原、幼淋>5%,則追加L-ASP3針。
化療 第15天複查骨髓如未緩解原幼淋5%~20%,繼續用L-ASP同時追加DNR一次;如第28天仍未達CR即原、幼淋≥20%,為失敗病例,應更換方案,如替尼泊苷+
阿糖胞苷 (Ara-C)或Idarubincin+Ara-C等
用L-ASP結束後休息6天,化療第29天並且
中性粒細胞絕對值 (ANC)≥1000時用以下鞏固方案
B.鞏固治療(14天):採用CAT方案
環磷醯胺 (CTX)600mg/m2,靜滴,於第1天水化鹼化尿液。
阿糖胞苷(Ara-C)100mg/m2,分2次(每12小時1次)肌注第1~7天。
6MP 75mg/m2,口服每晚睡前1次,第1~7天休息7天進行下一療程治療。
當ANC≥1000肝腎功能正常開始給藥按3g/(m2·d),每隔10天為1個療程共3療程。總量1/5:氨甲蝶呤(
MTX )靜推,其餘4/5(不超過500mg/次)在6h內均勻滴注。於靜推氨甲蝶呤(MTX)後2h鞘注1次於靜推氨甲蝶呤(MTX)後36h予CF解救第一次CF劑量為30mg/m2/次,靜推,以後CF 15mg/(m2·d)口服每6小時1次:42h48h、54h60h66h、72h,共7次。用大劑量
氨甲蝶呤 (HD-MTX)同時用VP一周[VCR 1.5mg/(m2·d),Pred 40mg/(m2·d)]當天及次日需水化鹼化尿液予5%NaHCO3 80~100ml/m2靜注,使尿pH≥7同時予充分的液體2000~3000ml/(m2·d)。
D.早期強化治療(21天):替尼泊苷 150mg/(m2·d)靜注;同時用
阿糖胞苷 (Ara-C)300mg/(m2·d)靜注隔2天1次,共3次。療程結束後一般需休息2周,
血象 才能恢復
E.維持治療:VCR+Dex及硫
嘌呤 (
6-MP )+氨甲蝶呤(
MTX )
序貫治療 :第1周用VCR 1.5mg/(m2·d),靜注1次,Dex 6mg/(m2·d)口服×7天第2~4周硫嘌呤(6-MP)75mg/(m2·d)每晚睡前口服1次×3周,
氨甲蝶呤 (MTX)20mg/(m2·d)口服或靜點每周1次×3周。
F.定期強化:
a.第1次加強時間:自骨髓達CR後第25周開始,方案為VDLD+2療程大劑量氨甲蝶呤(HD-MTX)。
長春新鹼 (VCR):1.5mg/(m2·d),靜推,每周1次×2周。
門冬醯胺酶(L-Asp):6000ku/(m2·d)肌注第天1次隔天1次×6次。
Dex:6mg/(m2·d),口服×14天。
b.第2次加強時間:第2年開始(距第1次加強半年),方案為替尼泊苷+
阿糖胞苷 (Ara-C)+2療程大劑量氨甲蝶呤(HD-MTX)。
c.第3次加強時間:第2.5年開始(即第19個月起),方案為CODDX+2療程大劑量氨甲蝶呤(HD-MTX)
d.第4次加強時間:第3年始(距第2次加強1年)方案為替尼泊苷+阿糖胞苷(Ara-C)。
G.
鞘內注射 :誘導治療第11529天各三聯鞘注,以後每8周三聯鞘注1次,第3年起每12周鞘注1次。不同年齡鞘注劑量見表7。
②高危方案:
A.誘導治療:CVDLP 4周:
環磷醯胺 (CTXC)800mg/m2稀釋於5%
葡萄糖 液100ml在1h內快速
靜脈滴注 ,第8天(1次);
長春新鹼 (VCR)1.5mg/m2(每次最大量不大於2mg/m2)
靜脈注射 每周1次於第8天第15天、第22天第29天;
柔紅黴素 (DNRD)30mg/m2,用5%葡萄糖液100ml稀釋快速靜脈滴注(30~40min)於第8~10天,共3次;
門冬醯胺酶 (L~ASP)5000~10000U/m2靜脈滴注或肌注(根據不同產品的生物活性和特性選用劑量和施藥途徑)於第9天第11天第13天第15天第17天、第19天第21天、第23天,共8次;潑尼松60mg/(m2·d)第1~28天(第1~7天為潑尼松試驗)3次/d第29天起每2天減半1周內減停
對於高
白細胞 血症(白細胞≥100×109/L)者,若有條件,做
血漿置換 1~2次,或
潑尼松 試驗(第1~7天)後白細胞仍>100×109/L者
DNR 推遲到白細胞<50×109/L時開始連用3天。
於誘導緩解
化療 的第19天必須複查骨髓塗片,可能出現3種不同的結果:①M1:骨髓明顯抑制原淋+幼淋25%。M1者提示療效和預後良好;M2者提示療效較差須加用2次L-Asp或1次DNRM3:提示無效,屬
難治性白血病 必須及時更換更為強烈的化療方案
B.鞏固治療:鞏固治療在誘導緩解治療28天后達CR時,儘早在第29~36天開始。替尼泊苷(威猛)或
依託泊苷 (VPl6)+
阿糖胞苷 (Ara-C):替尼泊苷(VM26 ) 150mg/m2或VPl6 200mg/m2靜滴,接阿糖胞苷(Ara-C)300mg/m2靜滴,第1天,第4天,第7天。
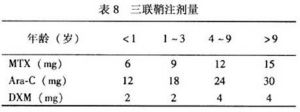
a.三聯鞘注(IT):於誘導治療的第1天起僅用阿糖胞苷(Ara-C)+Dex(劑量同上)此後第8天第15天第22天用三聯(劑量見表8)誘導期間共4次,早期強化治療結束用1次
b.HD-MTX+CF(大劑量氨甲蝶呤-
四氫葉酸 鈣)療法:於鞏固治療休息1~2周后視
血象 恢復情況,待
中性粒細胞 (ANC)>1×109/L
白細胞 ≥3×109/L,肝、腎功能無異常時儘早開始每10天1療程共3個療程
大劑量
氨甲蝶呤 (HD-MTX)3.0/m2,1/5量(不超過500mg/次)作為突擊量在30min內快速靜脈滴入餘量於6h內均勻滴入突擊量氨甲蝶呤(
MTX )滴入後2h內行三聯IT 1次。開始滴注氨甲蝶呤(MTX)36h後用
CF 解救劑量為30mg/m2首劑
靜脈注射 以後每6小時1次,口服,共6~8次。有條件者檢測血漿氨甲蝶呤(MTX)濃度(<0.1μmol/L為無毒性濃度),以調整CF套用的次數和劑量。
大劑量氨甲蝶呤(HD-MTX)治療前後3天口服
碳酸氫鈉 1.0g3次/d,並在治療當天給5%碳酸氫鈉3~5ml/kg靜滴使尿pH≥7用大劑量氨甲蝶呤(HD-MTX)當天及後3天需水化治療[2000~3000ml/(m2·d)]。
在用大劑量氨甲蝶呤(HD-MTX)同時每天用硫
嘌呤 (
6-MP ) 50mg/m2,共7天
c.顱腦放療:原則上適用於3歲以上患兒,凡診斷時
白細胞計數 ≥50×109/L,t(9;22)t(4;11),診斷時有CNSL,因種種原因不宜做HDMTX治療者,於完全緩解(CR)後6個月時進行,總劑量18Gy分15次於3周內完成同時每周IT 1次。放療用VDex及VADex每周交替各2次,VCR 1.5mg/m2靜注1次Dex 8mg/(m2·d)×7天口服。Ara-C 100mg/(m2·d)×5天,分2次肌注。
D.早期強化治療:方案VDLDex:VCRDNR均於第1天,第8天,劑量同前。L-Asp 5000~10000U/m2,第2天、第4天、第6天、第8天,共4次;Dex 8mg/(m2·d),第1~14天第3周減停。休息1~2周(待血象恢復,肝腎功能無異常)接替尼泊苷(VM26 ) +
阿糖胞苷 (Ara-C)3次(劑量與用法同前)。
E.維持及加強治療:
a.維持治療:VDex/硫
嘌呤 (
6-MP )+氨甲蝶呤(
MTX )方案:硫嘌呤(6-MP) 75mg/(m2·d)夜間睡前頓服,21天;氨甲蝶呤(MTX) 20~30mg/(m2·d),
肌注 ,每周1次連用3周接著VDex如此反覆序貫用藥,遇強化治療時暫停。
在硫嘌呤(6-MP)+
氨甲蝶呤 (MTX)用藥3周末保持
白細胞計數 3×109/L左右ANC 1.0×109/L根據
白細胞 和ANC計數,調整硫嘌呤(6-MP)和氨甲蝶呤(MTX)劑量。
b.小加強治療:CVADex:自維持治療起,每年第3第9個月各用1療程(CTX為600mg其餘劑量和用法同前)。
c.大加強強化治療:維持治療期每年第6個月VDLDex(用法同早期強化)。每年第12個月用替尼泊苷(VM26)或
依託泊苷 (VP16)+
阿糖胞苷 (Ara-C)(同早期強化方案)。
d.未做顱腦放療者,維持治療第2個月進行大劑量氨甲蝶呤(HD-MTX)+
四氫葉酸 鈣(
CF )治療,每3個月1次或每6個月2次共8次。然後每3個月三聯鞘注1次。做顱腦放療者不能再作大劑量
氨甲蝶呤 (HD-MTX)+四氫葉酸鈣(CF)治療只能採用三聯鞘注每12周1次,直至終止治療。
F.總療程:自維持治療算起,女孩3年,男孩3.5年
4.
骨髓移植 骨髓移植(bone marrow transplantation,BMT)治療白血病是通過植入
多能幹細胞 使白血病患兒因強烈化療和放療而受到嚴重損害的骨髓功能得到恢復並通過移植引起的移植物抗
白血病 作用(graft versus leukemiaGVL)消滅化療和放療後
微量殘留白血病 細胞(minimal residual leukemic cellMRLC)。由於BMT技術和方法不斷改進,移植成功率亦隨之提高,為白血病的治療開闢了一條新的途徑由於聯合化療對ALL效果較好,故先不採用BMT治療。但對於部分高危復發和難治的病例,BMT往往是最有效的治療手段。參見
骨髓移植 。
預後預防 預後 : 自然病程較短,若不治療一般多在6個月內死亡平均病程約3個月自從套用
聯合化療 以來預後有了明顯改善。緩解率可達95%以上目前已開發國家如德國BFM協作組,美國St.Jude兒童研究醫院(SJCRH)的5年無病生存率已達到80%國內5年無病生存率達74%以上。隨著長期無病生存率的提
高長生 存ALL患兒的遠期生活質量越來越受到重視通過對生長發育心肺、肝腎等臟器功能以及運動功能神經心理等方面的隨訪調查認為未接受放療的ALL患兒可健康無病生存兒童ALL被認為是一種可治癒的
惡性腫瘤 。
1.治療前的預後因素 小兒ALL的預後優於成人ALL影響小兒ALL預後因素很多因此主張根據不同的預後因素將小兒ALL分為標危和高危型兩組(表9)有些主張分為標危、中危、高危型對於小兒ALL預後影響較大的因素主要包括:年齡、
白細胞 總數、染色體改變免疫學及形態學分型以及是否合併CNSL等目前公認的影響
預後 最主要因素:
(1)年齡:幾乎所有文獻均肯定年齡是重要的獨立因素2~10歲的小兒ALL預後好,CR率可達95%5年無事件生存率(EFS)達70%以上而年齡小於12個月的嬰兒預後
極差 ,這可能與嬰兒多伴染色體t(4;11)易位和
急性雜合性白血病 有關。
(2)
外周血 白細胞總數:大量研究表明,白細胞總數對CR率及EFS均有十分重要的影響。白細胞總數是影響小兒ALL預後最關鍵因素。一般認為
白細胞 ≥50×109/L定為高危因素無論對ALL或AML高白細胞高於100×109/L臨床治療中CR率低存活期短
預後 差。
(3)細胞遺傳學異常:隨著
染色體分帶 技術的發展幾乎所有的研究都肯定
染色體異常 對ALL的CR存活期均有十分重要的意義是判定高危因素的關鍵指標。PH1(+)ALL染色體異常中兒童占5%。他們存活期短預後差。檢查病人的BCR-ABL
融合基因 常比t(9;22)
染色體易位 更易發現。有染色體異常的t(9;22)及t(4;11)預後差。大多數t(4;11)ALL具有前B-ALL的免疫表型並可同時表達髓系抗原提示此類ALL可能為更早期的幹細胞來源。
(4)免疫學分型:由於強
化療 改變ALL亞型和
預後 以及細胞
染色體技術 研究的深入,免疫學分型與預後的關係的報告不盡相同。過去認為CD10+ALL預後較好,新的研究表明CD10+ALL的預後好壞主要取決是否伴有Ph1(+)或BCR-ABL融合基因一般認為在兒童ALL中早期前B-ALL、C-ALL及前B-ALL亞型預後好。B-ALL少見僅占1%~2%。大多數具有L3的
形態學 特徵和伯基特(Burkitt)淋巴瘤的細胞遺傳學特徵。過去認為預後差,由於強化療套用出現戲劇性的改變兒童B-ALL長期存活可達50%以上。T-ALL約占ALL的10%~15%多發生在10歲以上年長兒,多伴高白細胞,縱隔腫物預後較差。對ALL伴髓系抗原表達(My+)的
預後 意義有不同觀點。一般認為兒童ALL伴髓系抗原表達(My+)預後意義不大,但認為ALL有CD34表達的預後差但需進一步研究證實。
根據以上評分標準積分≥3分者為高危ALL積分不到3分者為標危ALL。
在上述諸因素中,發病年齡和外周血白細胞總數是最重要的預後因素有研究指出,這兩項占預後因素比重的60%。如白細胞數大於100×109/L,常合併
中樞神經系統白血病 ;如白細胞數大於50×109/L年齡小於1歲或大於10歲其4年無病
生存率 僅為64%
2.治療相關的
預後 因素 近年來通過多箇中心的ALL療效總結髮現治療反應對預後的意義很大即用
潑尼松 每天60mg/m2 1周,
外周血 幼稚細胞 ≥1×109/L者為高危因素此即為潑尼松誘導試驗(prednisone induced test)同時還發現,有髓外浸潤[如中樞神經系統白血病及(或)
睪丸 白血病 ]的ALL亦為高危因素。但要確診中樞神經系統白血病需要在
腦脊液 中找到白血病細胞。
另一種治療反應是誘導緩解治療後第19天複查骨髓,可能出現3種情況:①骨髓明顯抑制原淋+幼淋25%其中第1種情況
預後 較好,第3種情況預後較差。如這時周圍血仍有幼稚細胞則不論其骨髓中的原淋與幼淋多少,亦為預後不良的指征
(1)最重要的治療相關的因素是誘導緩解治療達CR時間研究表明凡化療後5天內,
外周血 中幼稚細胞減少一半或化療後2周骨髓中原
幼淋巴細胞 下降至5%以下的預後好北京兒童醫院小兒ALL誘導緩解治療中,採用強化療後90%以上的患兒在2周時骨髓達CR大大提高了生存期,使標危及高危型的5年EFS均達74%。
(2)骨髓達CR後對微小殘留病(minimal residual disease,
MRD )的治療也很重要。在小兒ALL治療需堅持長期的維持治療及庇護所的預防治療,療程需2.5~3年
(3)原發和繼發
白血病耐藥 是化療失敗的重要原因近十年來對多藥耐藥(MDR1)的臨床研究進展迅速,有望使MDR1基因逆轉從而克服此治療中的不利因素
影響小兒ALL的
預後 因素很多,各因素是相互關聯相互影響的而且人體是很複雜的機體,單因素或多因素回歸分析等方法研究均有局限性治療前危險因素中年齡
白細胞 數細胞遺傳學異常等對預後影響較大,但通過調整治療方案強烈化療,個體化治療或採用骨髓移植可明顯減低ALL的危險因素
3.判斷預後的指標 為根據多年來對影響ALL的認識1998年
中華醫學會 兒科分會
血液學 組在山東榮成訂出的判斷預後的指標為:
(2)診斷時已有
中樞神經系統 白血病或
睪丸 白血病(或其他明確的髓外白血病的臨床表現)。
(3)
染色體核型 為t(4;11)或t(9;22)異常
(5)診斷時
外周血 白細胞 >50×109/L(或病史中外周血白細胞有過≥50×109/L)
(6)
潑尼松 誘導試驗第8天外周血幼稚細胞≥1×109/L
(7)標危急淋(SR-ALL)
誘導化療 6周不能獲得完全緩解者
具備上述任何一項或多項者均為高危急淋的診斷依據不具備上述任何一項或染色體有t(12;21)改變的B-ALL為標危急淋。
預防: 1.避免接觸有害因素 避免接觸有害化學物質、
電離輻射 等引起
白血病 的因素接觸毒物或放射性物質時,應加強各種防護措施;避免環境污染尤其是室內環境污染;注意合理用藥,慎用
細胞毒 藥物等
2.大力開展防治各種感染性疾病,尤其是病毒感染性疾病。做好預防接種。
3.做好優生工作,防止某些
先天性疾病 ,如21-三體、
范可尼貧血 等。加強體育鍛鍊,注意飲食衛生保持心情舒暢勞逸結合,增強機體抵抗力。
[2] 火罐網