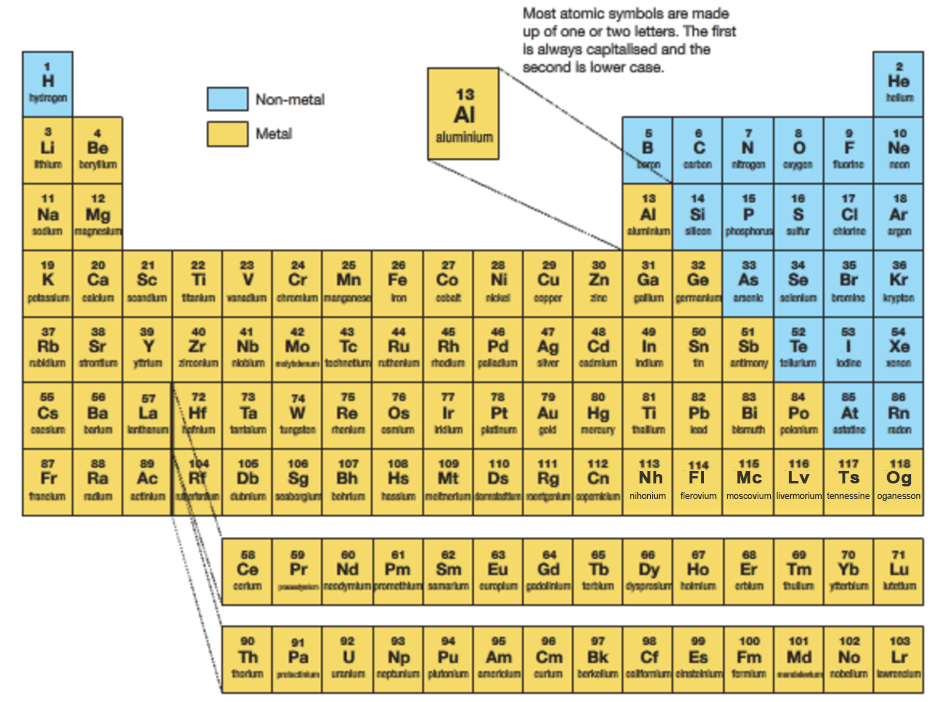
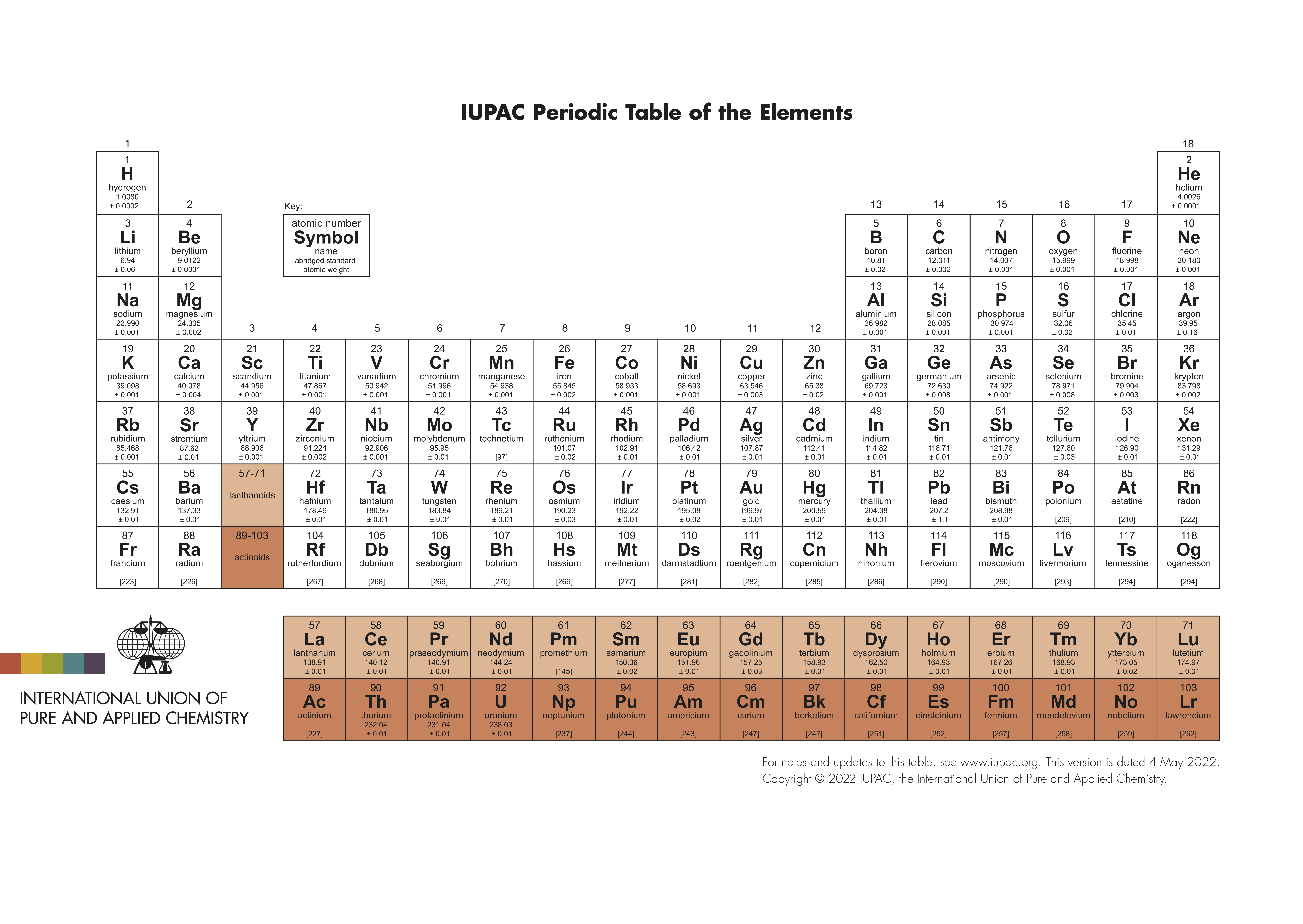
化學元素周期表(Periodic table of elements)是根據元素原子核電荷數從小至大排序的化學元素列表。列表大體呈長方形,某些元素周期中留有空格,使特性相近的元素歸在同一族中,如鹼金屬元素、鹼土金屬、鹵族元素、稀有氣體,非金屬,過渡元素等。這使周期表中形成元素分區且分有七主族、七副族、Ⅷ族、18族。由於周期表能夠準確地預測各種元素的特性及其之間的關係,因此它在化學及其他科學範疇中被廣泛使用,作為分析化學行為時十分有用的框架。
俄國化學家德米特里·伊萬諾維奇·門捷列夫(Dmitri Mendeleev)於1869年總結髮表此周期表(第一代元素周期表),此後不斷有人提出各種類型周期表不下170餘種,歸納起來主要有:短式表(以門捷列夫為代表)、長式表(以維爾納式為代表)、特長表(以波爾塔式為代表);平面螺線表和圓形表(以達姆開夫式為代表);立體周期表(以萊西的圓錐柱立體表為代表)等眾多類型表。
註:中國教學上長期使用的是長式周期表,即維爾納式為代表。
基本介紹
- 中文名:元素周期表
- 外文名:periodic table of elements
- 別名:元素表
- 所屬學科:化學
- 創造者:德米特里·伊萬諾維奇·門捷列夫
- 概念:化學元素周期列表
- 發表時間:1869年
- 元素分區:七主族、七副族、Ⅷ族、18族
發展歷程

元素區
分區名稱 | 詳細介紹 |
|---|---|
s區元素 | |
p區元素 | |
d區元素 | |
f區元素 |
周期表內容
注*的是人造元素 | ||||||||||||||||||
周期 | ⅠA | ⅡA | ⅢB | ⅣB | ⅤB | ⅥB | ⅦB | Ⅷ | ⅠB | ⅡB | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 18 | ||
1 | - | |||||||||||||||||
2 | - | |||||||||||||||||
3 | ||||||||||||||||||
4 | ||||||||||||||||||
5 | ||||||||||||||||||
6 | Tl | At | ||||||||||||||||
7 | Bh 𬭛* | |||||||||||||||||
Eu | |||||||||||||||
Ac |
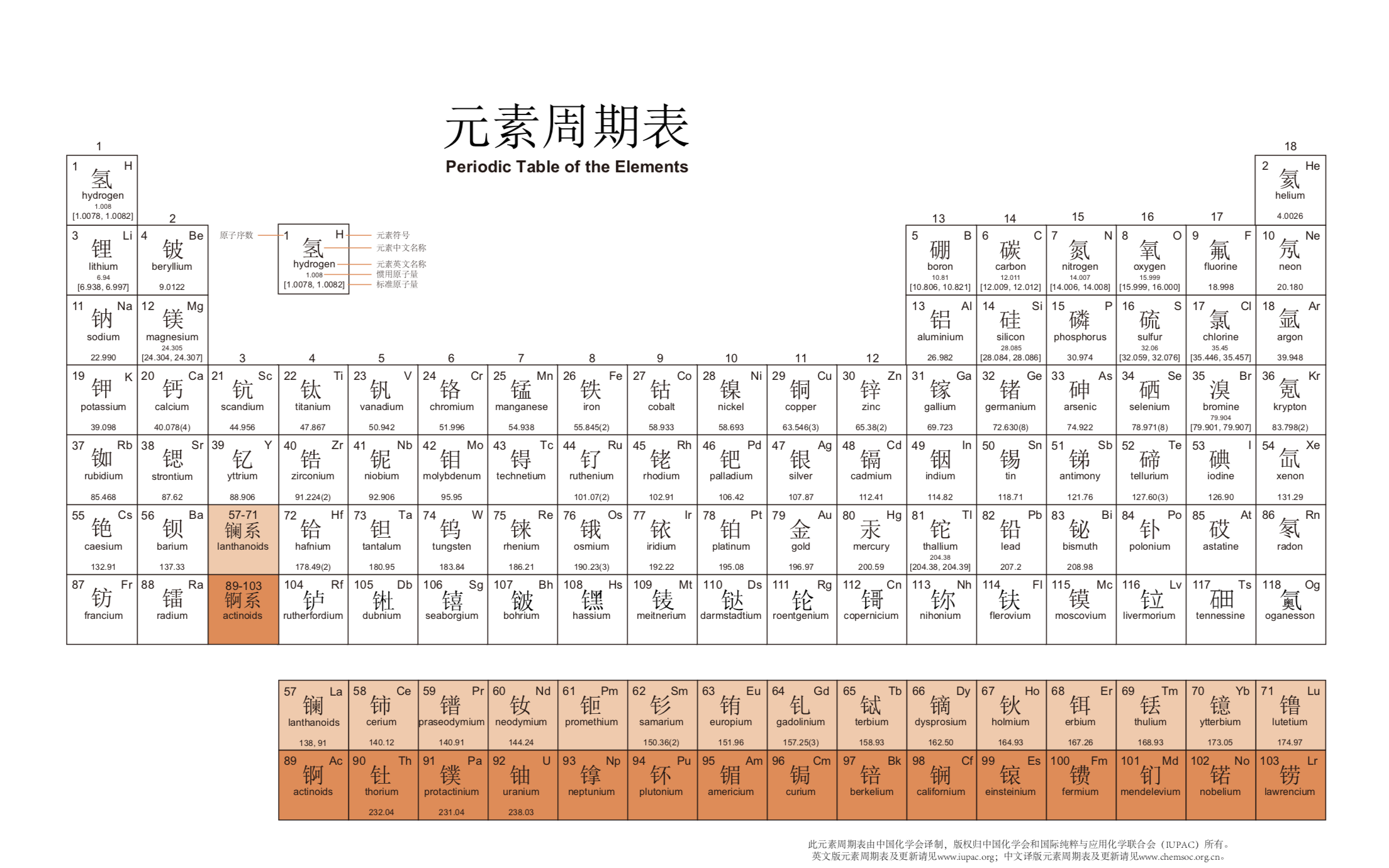
元素列表
原子序數 | 符號 | 中文 | 讀音 | 相對原子質量 | 價電子 | 常見化合價 | 分類 | 英文名 | 簡介 |
|---|---|---|---|---|---|---|---|---|---|
1 | H | 氫 | qīng | 1.008 | 1s | +1、-1 | 主族 非金屬 | Hydrogen | 密度最小的元素,同位素為氕、氘和氚 |
2 | He | 氦 | hài | 4.003 | 1s | 0 | 18族 非金屬 稀有氣體 | Helium | |
3 | Li | 鋰 | lǐ | 6.941 | 2s | +1 | 主族 金屬 鹼金屬 | Lithium | |
4 | Be | 鈹 | pí | 9.012 | 2s | +2 | 主族 金屬 鹼土金屬 | Beryllium | 最輕鹼土金屬元素,有劇毒,與水幾乎不反應 |
5 | B | 硼 | péng | 10.81 | 2s2p | +3 | 主族 類金屬 | Boron | |
6 | C | 碳 | tàn | 12.01 | 2s2p | 無機+2、 +4、-4, 有機不規則 | 主族 非金屬 | Carbon | 硬度最高(金剛石)、導電(石墨),細胞乾重中含量最高,是生命的基本構架 |
7 | N | 氮 | dàn | 14.01 | 2s2p | -3、+1、 +2、+3、 +4、+5 | 主族 非金屬 | Nitrogen | 空氣中含量最多的元素,不活潑,其氧化物是大氣污染物 |
8 | O | 氧 | yǎng | 16.00 | 2s2p | -2、-1(過氧) | 主族 非金屬 | Oxygen | 地殼中最多,生物體內最多,支持燃燒和需氧型生物呼吸 |
9 | F | 氟 | fú | 19.00 | 2s2p | -1 | 主族 非金屬 鹵素 | Fluorine | 最活潑的非金屬元素,化合價沒有正價,單質不能被氧化 |
10 | Ne | 氖 | nǎi | 20.18 | 2s2p | 0 | 18族 非金屬 稀有氣體 | Neon | 稀有氣體,用於光源 |
11 | Na | 鈉 | nà | 22.99 | 3s | +1 | 主族 金屬 鹼金屬 | Sodium | 活潑,與空氣或水接觸發生反應,只能儲存在石蠟、煤油或稀有氣體中,鈉光燈是重要黃光光源 |
12 | Mg | 鎂 | měi | 24.31 | 3s | +2 | 主族 金屬 鹼土金屬 | Magnesium | |
13 | Al | 鋁 | lǚ | 26.98 | 3s3p | +3 | 主族 金屬 | Aluminium | 地殼裡含量最多的金屬元素,具有非金屬性,套用廣泛 |
14 | Si | 矽 | guī | 28.09 | 3s3p | +4、-4 | 主族 類金屬 | Silicon | 地殼中含量僅次於氧,外表很像金屬,是晶片的重要元素 |
15 | P | 磷 | lín | 30.97 | 3s3p | -3、+3、+5 | 主族 非金屬 | Phosphorus | 有白磷和紅磷,白磷有劇毒且在常溫下可以自燃 |
16 | S | 硫 | liú | 32.06 | 3s3p | -2、+4、+6 | 主族 非金屬 | Sulphur | 黃色固體,質地較軟且輕,與火山活動密切相關 |
17 | Cl | 氯 | lǜ | 35.45 | 3s3p | -1、+1、 +3、+4、 +5、+7 | 主族 非金屬 鹵素 | Chlorine | 黃綠色有毒氣體,活潑,支持燃燒 |
18 | Ar | 氬 | yà | 39.95 | 3s3p | 0 | 18族 非金屬 稀有氣體 | Argon | 稀有氣體,在空氣中含量最多的稀有氣體 |
19 | K | 鉀 | jiǎ | 39.10 | 4s | +1 | 主族 金屬 鹼金屬 | Potassium | 比鈉還活潑,遇水即燃,鉀離子可促進植物體內糖類和澱粉的形成 |
20 | Ca | 鈣 | gài | 40.08 | 4s | +2 | 主族 金屬 鹼土金屬 | Calcium | 空氣中會與氮化合,能與水反應,是石灰、骨骼主要組成成分 |
21 | Sc | 鈧 | kàng | 44.96 | 3d4s | +3 | 副族 金屬 | Scandium | |
22 | Ti | 鈦 | tài | 47.87 | 3d4s | +3、+4 | 副族 金屬 | Titanium | 能在氮氣中燃燒,熔點高,被稱為“太空金屬” |
23 | V | 釩 | fán | 50.94 | 3d4s | +3、+5 | 副族 金屬 | Vanadium | 高熔點稀有金屬,抗腐蝕能力較強 |
24 | Cr | 鉻 | gè | 52.00 | 3d4s | +3、+4、+6 | 副族 金屬 | Chromium | 硬度最高的金屬,主要用於製作不鏽鋼 |
25 | Mn | 錳 | měng | 54.94 | 3d4s | +1、+2、+3、+4、+5、+6、+7 | 副族 金屬 | Manganese | 在地殼中分布廣泛,高錳鋼可用於製造軍用頭盔或裝甲 |
26 | Fe | 鐵 | tiě | 55.85 | 3d4s | +2(亞鐵)、+3、+6 | Ⅷ族 金屬 | Iron | 地殼含量第二高的金屬,單質產量最高,有磁性 |
27 | Co | 鈷 | gǔ | 58.93 | 3d4s | +2、+3 | Ⅷ族 金屬 | Cobalt | 有磁性,可作藍色鈷顏料,同位素Co被套用於X光發生器中 |
28 | Ni | 鎳 | niè | 58.69 | 3d4s | +2、+3 | Ⅷ族 金屬 | Nickel | 有磁性和良好可塑性,可用於製作充電電池,甘肅金昌鎳礦 |
29 | Cu | 銅 | tóng | 63.55 | 3d4s | +1(亞銅)、+2 | 副族 金屬 | Copper | 人類發現較早的金屬之一,可塑性很好,導電性能優 |
30 | Zn | 鋅 | xīn | 65.39 | 3d4s | +2 | 副族 金屬 | Zinc | 人體需要的微量元素,用於白鐵和乾電池負極 |
31 | Ga | 鎵 | jiā | 69.72 | 4s4p | +3 | 主族 金屬 | Gallium | 熔點低沸點高,用於半導體 |
32 | Ge | 鍺 | zhě | 72.64 | 4s4p | +2、+4 | 主族 類金屬 | Germanium | 具有兩性,是一種重要的半導體材料 |
33 | As | 砷 | shēn | 74.92 | 4s4p | -3、+3、+5 | 主族 類金屬 | Arsenic | 又稱砒,毒性很強,三氧化二砷俗稱砒霜 |
34 | Se | 硒 | xī | 78.96 | 4s4p | -2、+4、+6 | 主族 非金屬 | Selenium | 可用於製作硒鼓,可使玻璃致色為鮮紅色 |
35 | Br | 溴 | xiù | 79.90 | 4s4p | -1、+5、+7 | 主族 非金屬 鹵素 | Bromine | 紅棕色液體,活潑,不易溶於水,易溶於有機溶劑 |
36 | Kr | 氪 | kè | 83.80 | 4s4p | +2 | 18族 非金屬 稀有氣體 | Krypton | 稀有氣體,可與氟化合 |
37 | Rb | 銣 | rú | 85.47 | 5s | +1 | 主族 金屬 鹼金屬 | Rubidium | |
38 | Sr | 鍶 | sī | 87.62 | 5s | +2 | 主族 金屬 鹼土金屬 | Strontium | 是鹼土元素中豐度最小的元素,與水反應會使溶液變白 |
39 | Y | 釔 | yǐ | 88.91 | 4d5s | +3 | 副族 金屬 | Yttrium | 人工合成的釔鋁榴石曾被當做鑽石的替代品 |
40 | Zr | 鋯 | gào | 91.22 | 4d5s | +4 | 副族 金屬 | Zirconium | 氧化物立方氧化鋯為鑽石的人工替代品 |
41 | Nb | 鈮 | ní | 92.91 | 4d5s | +5 | 副族 金屬 | Niobium | 用於製作超導材料,鈮鋼被用於製作汽車外殼 |
42 | Mo | 鉬 | mù | 95.96 | 4d5s | +4、+6 | 副族 金屬 | Molybdenum | 銀白色金屬,熔點非常高,可用於半導體,植物生長所需的微量元素 |
43 | Tc | 鎝 | dé | 98 | 4d5s | +4、+7 | 副族 金屬 | Technetium | 原子序數最小的放射性元素,第一個人工合成的元素 |
44 | Ru | 釕 | liǎo | 101.1 | 4d5s | +1、+4、+8 | Ⅷ族 金屬 | Ruthenium | 硬而脆呈淺灰色的多價稀有金屬元素 |
45 | Rh | 銠 | lǎo | 102.9 | 4d5s | +3,+4 | Ⅷ族 金屬 | Rhodium | 現代珠寶製作過程進行表面處理的必須元素 |
46 | Pd | 鈀 | bǎ | 106.4 | 4d | +2、+4 | Ⅷ族 金屬 | Palladium | 銀白色金屬,可吸收氫氣,鈀金可用於製作首飾和鑲嵌寶石 |
47 | Ag | 銀 | yín | 107.9 | 4d5s | +1 | 副族 金屬 | Silver | 貴金屬,導電性最好,銀鏡反應用於製作鍍銀玻璃鏡 |
48 | Cd | 鎘 | gé | 112.4 | 4d5s | +2 | 副族 金屬 | Cadmium | 重金屬,有毒,過量攝入會導致痛痛病,可用於吸收中子 |
49 | In | 銦 | yīn | 114.8 | 5s5p | +3 | 主族 金屬 | Indium | 可塑性強,有延展性,In是主要的放射性同位素 |
50 | Sn | 錫 | xī | 118.7 | 5s5p | +2、+4 | 主族 金屬 | Tin | 人類最早發現套用的元素之一,被用於製造青銅器 |
51 | Sb | 銻 | tī | 121.8 | 5s5p | -3、+3、+5 | 主族 類金屬 | Antimony | 熔點低,被用於製作保險絲,其氧化物可作防火材料,湖南冷水江銻礦 |
52 | Te | 碲 | dì | 127.6 | 5s5p | -2、+4、+6 | 主族 類金屬 | Tellurium | 密度最大的非金屬,碲酸含6個羥基 |
53 | I | 碘 | diǎn | 126.9 | 5s5p | -1、+5、+7 | 主族 非金屬 鹵素 | Iodine | 紫黑色固體,可升華,活潑,甲狀腺所需的微量元素 |
54 | Xe | 氙 | xiān | 131.3 | 5s5p | +4、+6、+8 | 18族 非金屬 稀有氣體 | Xenon | 稀有氣體,可與氟化合,可用於光源 |
55 | Cs | 銫 | sè | 133 | 6s | +1 | 主族 金屬 鹼金屬 | Cesium | 具有金色光澤的鹼金屬,熔點很低,比銣更活潑,遇水即爆 |
56 | Ba | 鋇 | bèi | 137.3 | 6s | +2 | 主族 金屬 鹼土金屬 | Barium | 與水反應不變白,氫氧化鋇可溶於水,硫酸鋇被套用於鋇餐透視 |
57 | La | 鑭 | lán | 139 | 5d6s | +3 | 副族 金屬 鑭系元素 | Lanthanum | 銀白色金屬,質軟,活潑,必須保存於石蠟或礦物油中 |
58 | Ce | 鈰 | shì | 140 | 4f5d6s | +3、+4 | 副族 金屬 鑭系元素 | Cerium | 銀灰色稀土金屬,用刀刮即可在空氣中燃燒,用來製造打火石 |
59 | Pr | 鐠 | pǔ | 141 | 4f6s | +3 | 副族 金屬 鑭系元素 | Praseodymium | 銀白色金屬,質軟,是用量較大的稀土元素 |
60 | Nd | 釹 | nǚ | 144 | 4f6s | +3 | 副族 金屬 鑭系元素 | Neodymium | 化學性質較活潑,可在空氣中點燃,磁性強,主要用作永磁材料 |
61 | Pm | 鉕 | pǒ | 145 | 4f6s | +3 | 副族 金屬 鑭系元素 | Promethium | 有放射性,用於β射線源、熱源及原子電池等 |
62 | Sm | 釤 | shān | 150.5 | 4f6s | +3 | 副族 金屬 鑭系元素 | Samarium | 銀白色稀土金屬,容易磁化卻很難退磁 |
63 | Eu | 銪 | yǒu | 152 | 4f6s | +3 | 副族 金屬 鑭系元素 | Europium | 稀土元素中最活潑的金屬,能直接與空氣和水反應,能放出紅光 |
64 | Gd | 釓 | gá | 157 | 4f5d6s | +3 | 副族 金屬 鑭系元素 | Gadolinium | 銀白色金屬,有磁性,未配對電子達到上限,用途較廣 |
65 | Tb | 鋱 | tè | 159 | 4f6s | +3 | 副族 金屬 鑭系元素 | Terbium | 銀灰色稀土金屬,通電時改變形狀,用於印表機的列印頭等精密設備 |
66 | Dy | 鏑 | dī | 162.5 | 4f6s | +3 | 副族 金屬 鑭系元素 | Dysprosium | |
67 | Ho | 鈥 | huǒ | 165 | 4f6s | +3 | 副族 金屬 鑭系元素 | Holmium | 銀白色,質軟,可用來制磁性材料 |
68 | Er | 鉺 | ěr | 167 | 4f6s | +3 | 副族 金屬 鑭系元素 | Erbium | 銀灰色,質軟,可用來制特種合金,雷射器等 |
69 | Tm | 銩 | diū | 169 | 4f6s | +3 | 副族 金屬 鑭系元素 | Thulium | 銀白色,質軟,可用來制X射線源等 |
70 | Yb | 鐿 | yì | 173 | 4f6s | +2、+3 | 副族 金屬 鑭系元素 | Ytterbium | 銀白色,質軟,可用來制特種合金,也用作雷射材料等 |
71 | Lu | 鑥 | lǔ | 175 | 4f5d6s | +3 | 副族 金屬 鑭系元素 | Lutetium | 銀白色,質軟,可用於核工業 |
72 | Hf | 鉿 | hā | 178.5 | 5d6s | +4 | 副族 金屬 | Hafnium | 銀白色,熔點高。可用來制耐高溫合金,也用於核工業等 |
73 | Ta | 鉭 | tǎn | 181 | 5d6s | +5 | 副族 金屬 | Tantalum | 鋼灰色,耐腐蝕質硬,熔點高。可用於航天工業及核工業 |
74 | W | 鎢 | wū | 184 | 5d6s | +4、+6 | 副族 金屬 | Tungsten | 穩定金屬元素中熔點最高,白熾燈絲首選,江西大余鎢礦 |
75 | Re | 錸 | lái | 186 | 5d6s | +7 | 副族 金屬 | Rhenium | 最晚被發現的穩定元素,金屬熔點僅次於鎢,可作燈絲 |
76 | Os | 鋨 | é | 190 | 5d6s | +4,+6,+8 | Ⅷ族 金屬 | Osmium | 密度最大的金屬,熔點極高(3000℃以上),硬度大,用於軸承 |
77 | Ir | 銥 | yī | 192 | 5d6s | +3,+4、+6、+9 | Ⅷ族 金屬 | Iridium | 熔點高,質硬而脆。可用來制科學儀器等 |
78 | Pt | 鉑 | bó | 195 | 5d6s | +2,+4 | Ⅷ族 金屬 | Platinum | 化學性質極穩定,被套用於珠寶首飾中的貴金屬,俗稱鉑金 |
79 | Au | 金 | jīn | 197 | 5d6s | +1、+3 | 副族 金屬 | Gold | 化學性質極穩定,人類最早發現及套用的貴金屬,全球硬通貨 |
80 | Hg | 汞 | gǒng | 200.6 | 5d6s | +1、+2 | 副族 金屬 | Mercury | 水銀,常溫下為液態的金屬,汞光燈是重要光源,貴州銅仁汞礦,有毒 |
81 | Tl | 鉈 | tā | 204.5 | 6s6p | +3 | 主族 金屬 | Thallium | 銀白色,質軟。可用來制合金等。鉈的化合物有劇毒 |
82 | Pb | 鉛 | qiān | 207 | 6s6p | +2、+4 | 主族 金屬 | Lead | 密度大,熔點低,對人體有毒性。許多化妝品中必須含有的元素 |
83 | Bi | 鉍 | bì | 209 | 6s6p | +3、+5 | 主族 金屬 | Bismuth | 合金熔點很低,可用來做保險絲和汽鍋上的安全塞等, 有極微弱的放射性 |
84 | Po | 釙 | pō | 209 | 6s6p | -2、+6 | 主族 類金屬 | Polonium | 銀白色金屬,放射性,能在黑暗中發光,用作中子源 |
85 | At | 砹 | ài | 210 | 6s6p | +5 | 主族 非金屬 鹵素 | Astatine | 單質外表與碘相似,放射、活潑,地球中含量最小的天然元素 |
86 | Rn | 氡 | dōng | 222 | 6s6p | +2 | 18族 非金屬 稀有氣體 | Radon | 放射性氣體,鐳射氣 |
87 | Fr | 鍅 | fāng | 223 | 7s | +1 | 主族 金屬 鹼金屬 | Francium | 放射性鹼金屬,地球中含量極小,金屬性可能不如銫 |
88 | Ra | 鐳 | léi | 226 | 7s | +2 | 主族 金屬 鹼土金屬 | Radium | 放射性鹼土金屬,其射線可用於治療癌症 |
89 | Ac | 錒 | ā | 227 | 6d7s | +3 | 副族 金屬 錒系元素 | Actinium | 放射性,能在暗處發光,空氣中可被氧化,鹼性較強 |
90 | Th | 釷 | tǔ | 232 | 6d7s | +4 | 副族 金屬 錒系元素 | Thorium | 放射性,半衰期可長達上百億年,可用於裂變 |
91 | Pa | 鏷 | pú | 231 | 5f6d7s | +5 | 副族 金屬 錒系元素 | Protactinium | 放射性,鏷231半衰期3萬多年 |
92 | U | 鈾 | yóu | 238 | 5f6d7s | +3、+4,+6 | 副族 金屬 錒系元素 | Uranium | 放射性,半衰期長達幾十億年,同位素鈾235被用於製作核子彈 |
93 | Np | 鎿 | ná | 237 | 5f6d7s | +5、+7 | 副族 金屬 錒系元素 | Neptunium | 放射,在鈾礦中少量存在 |
94 | Pu | 鈽 | bù | 244 | 5f7s | +4、+6、+8 | 副族 金屬 錒系元素 | Plutonium | 放射,在鈾礦中少量存在,用於裂變核燃料 |
95 | Am | 鎇 | méi | 243 | 5f7s | +3、+5、+7、+8 | 副族 金屬 錒系元素 | Americium | 人造 放射 用於煙霧報警器中 |
96 | Cm | 鋦 | jú | 247 | 5f6d7s | +3、+6、+7 | 副族 金屬 錒系元素 | Curium | 人造 放射 |
97 | Bk | 錇 | péi | 247 | 5f7s | +3、+5 | 副族 金屬 錒系元素 | Berkelium | 人造 放射 |
98 | Cf | 鐦 | kāi | 251 | 5f7s | +3、+5 | 副族 金屬 錒系元素 | Californium | 人造 放射 |
99 | Es | 鑀 | āi | 252 | 5f7s | +3 | 副族 金屬 錒系元素 | Einsteinium | 人造 放射 |
100 | Fm | 鐨 | fèi | 257 | 5f7s | +3 | 副族 金屬 錒系元素 | Fermium | 人造 放射 |
101 | Md | 鍆 | mén | 258 | 5f7s | +3 | 副族 金屬 錒系元素 | Mendelevium | 人造 放射 |
102 | No | 鍩 | nuò | 259 | 5f7s | +2、+3 | 副族 金屬 錒系元素 | Nobelium | 人造 放射 |
103 | Lr | 鐒 | láo | 260 | 5f7s7p | +3 | 副族 金屬 錒系元素 | Lawrencium | 人造 放射 |
原子序數 | 符號 | 簡體中文 | 繁體中文 | 漢語拼音 | 相對原子質量 | 價電子 | 常見化合價 | 分類 | 英文名 | 簡介 |
|---|---|---|---|---|---|---|---|---|---|---|
104 | Rf | 𬬻 | 鑪 | lú | 261 | 6d7s | +4 | 副族 金屬 | Rutherfordium | 人造 放射 |
105 | Db | 𬭊 | 𨧀 | dù | 262 | 6d7s | +5 | 副族 金屬 | Dubnium | 人造 放射 |
106 | Sg | 𬭳 | 𨭎 | xǐ | 263 | 6d7s | +6 | 副族 金屬 | Seaborgium | 人造 放射 |
107 | Bh | 𬭛 | 𨨏 | bō | 264 | 6d7s | +7 | 副族 金屬 | Bohrium | 人造 放射 |
108 | Hs | 𬭶 | 𨭆 | hēi | 265 | 6d7s | +8 | VIII族 金屬 | Hassium | 人造 放射 |
109 | Mt | 鿏 | 䥑 | mài | 266 | 6d7s | 0 | VIII族 金屬 | Meitnerium | 人造 放射 |
110 | Ds | 𫟼 | 鐽 | dá | 269 | 6d7s | 0 | VIII族 金屬 | Darmstadtium | 人造 放射 |
111 | Rg | 𬬭 | 錀 | lún | 272 | 6d7s | 0 | 副族 金屬 | Roentgenium | 人造 放射 |
112 | Cn | 鿔 | 鎶 | gē | 277 | 6d7s | 0 | 副族 金屬 | Copernicium | 人造 放射 |
113 | Nh | 鿭 | 鉨 | nǐ | 286 | 5f6d7s7p | +3,+1 | 主族 金屬 | Nihonium | 人造 放射 |
114 | Fl | 鈇 | 鈇 | fū | 289 | 5f6d7s7p | ,0,+3 | 主族 金屬 | Flerovium | 第一種表現出惰性氣體特徵的超重元素,人造 放射 |
115 | Mc | 鏌 | 鏌 | mò | 289 | 5f6d7s7p | +1,+3 | 主族 金屬 | Moscovium | 人造 放射 |
116 | Lv | 𫟷 | 鉝 | lì | 293 | 5f6d7s7p | +4 | 主族 金屬 | Livermorium | 人造 放射 |
117 | Ts | 鿬 | \ | tián | 294 | 5f6d7s7p | -1 | 主族 非金屬 鹵素 | Tennessine | 人造 放射 |
118 | Og | 鿫 | \ | ào | 294 | 5f6d7s7p | - | 18族 非金屬 稀有氣體 | Oganesson | 人造 放射 |
基本物理性質
鹼金屬單質 | 顏色和狀態 | 密度(×10kg/m) | 熔點(℃) | 沸點(℃) |
|---|---|---|---|---|
氫(不屬於鹼金屬) | 無色,氣體 | 0.0000899 | -259.125 | -252.882 |
鋰 | 銀白色,柔軟 | 0.534 | 180.5 | 1347 |
鈉 | 銀白色,柔軟 | 0.97 | 97.81 | 882.9 |
鉀 | 銀白色,柔軟 | 0.86 | 63.65 | 774 |
銣 | 銀金色,柔軟 | 1.532 | 38.89 | 688 |
銫 | 金色,柔軟 | 1.879 | 28.40 | 678.4 |
鍅 | 紅色,柔軟 | 1.87 | 27 | 677 |
鹼土金屬單質 | 顏色和狀態 | 密度(×10kg/m) | 熔點(℃) | 沸點(℃) |
|---|---|---|---|---|
鈹 | 鋼灰色,較硬 | 1.848 | 1278 | 2970(加壓) |
鎂 | 銀白色,柔軟 | 1.738 | 648.9 | 1090 |
鈣 | 銀白色,柔軟 | 1.550 | 839 | 1484 |
鍶 | 銀白色,柔軟 | 2.540 | 769(加壓) | 1384 |
鋇 | 銀白色,柔軟 | 3.594 | 729 | 1870 |
鐳 | 銀白色,柔軟 | 5 | 700 | 1737 |
IIIB族元素單質 | 顏色 | 密度(×10kg/m) | 熔點(℃) | 沸點(℃) |
|---|---|---|---|---|
鈧 | 銀白色 | 2.985 | 1541 | 2830 |
釔 | 灰色 | 4.4689 | 1522 | 3338 |
鑭系元素單質 | 顏色 | 密度(×10kg/m) | 熔點(℃) | 沸點(℃) |
|---|---|---|---|---|
鑭 | 銀白色 | 6.7 | 920 | 3469 |
鈰 | 灰色 | 6.9 | 799 | 3426 |
鐠 | 銀灰色 | 6.7 | 935 | 3212 |
釹 | 銀灰色 | 7.0 | 1024 | 3074 |
鉕 | 銀白色或灰色 | 6.5 | 1042 | 3000 |
釤 | 銀白色 | 7.5 | 1072 | 1791 |
銪 | 銀白色 | 5.0 | 826 | 1596 |
釓 | 銀白色 | 7.9 | 1313 | 3266 |
鋱 | 銀灰色 | 8.2 | 1356 | 3230 |
鏑 | 銀白色 | 8.5 | 1412 | 2562 |
鈥 | 銀色 | 8.8 | 1474 | 2695 |
鉺 | 銀白色 | 9.0 | 1529 | 2863 |
銩 | 銀白色 | 9.3 | 1545 | 1947 |
鐿 | 銀白色 | 7.0 | 824 | 1193 |
鑥 | 銀灰色 | 9.8 | 1656 | 3315 |
元素單質 | 顏色 | 密度(×10kg/m) | 熔點(℃) | 沸點(℃) |
|---|---|---|---|---|
鈦 | 銀白色 | 4.5 | 1660 | 3287 |
鋯 | 銀白色 | 6.5 | 1852 | 4377 |
鉿 | 銀白色 | 13.3 | 2227 | 4602 |
元素單質 | 顏色 | 密度(×10kg/m) | 熔點(℃) | 沸點(℃) |
|---|---|---|---|---|
釩 | 銀白色 | 6.1 | 1902 | 3380 |
鈮 | 銀白色 | 8.6 | 2468 | 4742 |
鉭 | 銀白色 | 16.6 | 2996 | 5425 |
元素單質 | 顏色 | 密度(×10kg/m) | 熔點(℃) | 沸點(℃) |
|---|---|---|---|---|
鉻 | 銀白色 | 7.2 | 1857 | 2642 |
鉬 | 銀色 | 10.2 | 2610 | 4615 |
鎢 | 銀色 | 19.3 | 3410 | 5555 |
元素單質 | 顏色 | 密度(×10kg/m) | 熔點(℃) | 沸點(℃) |
|---|---|---|---|---|
錳 | 銀白色 | 7.44 | 1246 | 2061 |
鎝 | 銀色 | 11.487 | 2172 | 4277 |
錸 | 銀色 | 21.04 | 3180 | 5627 |
元素單質 | 顏色 | 密度(×10kg/m) | 熔點(℃) | 沸點(℃) |
|---|---|---|---|---|
鐵 | 銀白色 | 7.86 | 1535 | 2861 |
鈷 | 銀灰色 | 8.9 | 1495 | 2527 |
鎳 | 銀白色 | 8.9 | 1453 | 2913 |
釕 | 銀白色 | 12.3 | 2310 | 4150 |
銠 | 銀色 | 12.41 | 1966 | 3695 |
鈀 | 銀色 | 12.02 | 1552 | 2963 |
鋨 | 銀灰色 | 22.48 | 3027 | 5012 |
銥 | 銀白色 | 22.421 | 2443 | 4428 |
鉑 | 銀白色 | 21.45 | 1772 | 3825 |
元素單質 | 顏色 | 密度(×10kg/m) | 熔點(℃) | 沸點(℃) |
|---|---|---|---|---|
銅 | 紫紅色 | 8.92 | 1084.6 | 2562 |
銀 | 銀白色 | 10.5 | 961 | 2162 |
金 | 金黃色 | 19.3 | 1046.68 | 2856 |
元素單質 | 顏色 | 密度(×10kg/m) | 熔點(℃) | 沸點(℃) |
|---|---|---|---|---|
鋅 | 銀白色 | 7.14 | 419.6 | 907 |
鎘 | 銀灰色 | 8.65 | 320.9 | 765 |
汞 | 銀白色 | 13.59 | -38.87 | 356.6 |
元素單質 | 顏色 | 密度(×10kg/m) | 熔點(℃) | 沸點(℃) |
|---|---|---|---|---|
硼 | 黑色 | 2.34 | 2076 | 3927 |
鋁 | 銀白色 | 2.7 | 660 | 2327 |
鎵 | 銀白色 | 5.904 | 29.76 | 2403 |
銦 | 銀白色 | 7.31 | 156.2 | 2080 |
鉈 | 銀白色 | 11.85 | 308.5 | 1457 |
元素單質 | 顏色 | 密度(×10kg/m) | 熔點(℃) | 沸點(℃) |
|---|---|---|---|---|
碳 | 黑色(石墨、炭黑等)或無色(金剛石) | 2.267 | 3550 | 4827 |
矽 | 黑色 | 2.33 | 1414 | 2900 |
鍺 | 銀白色 | 5.35 | 938.25 | 2833 |
錫 | 銀白色 | 7.28 | 231.89 | 2260 |
鉛 | 銀白色 | 11.3437 | 327.502 | 1749 |
元素單質 | 顏色 | 密度(×10kg/m) | 熔點(℃) | 沸點(℃) |
|---|---|---|---|---|
氮 | 無色 | 0.0012506 | -209.86 | -195.8 |
磷 | 黃白色(白磷) | 1.828 | 44.1 | 280.5 |
深紅色(紅磷) | 2.34 | 280 | 590 | |
砷 | 灰黑色(灰砷) | 5.73 | 817 | 614(升華) |
銻 | 銀白色 | 6.697 | 630.63 | 1587 |
鉍 | 銀白色,因為氧化膜常帶彩色 | 9.78 | 271 | 1564 |
元素單質 | 顏色 | 密度(×10kg/m) | 熔點(℃) | 沸點(℃) |
|---|---|---|---|---|
氧 | 無色 | 0.00143 | -217.65 | -182.95 |
硫 | 淡黃色 | 2.07 | 115.36 | 444.6 |
硒 | 紅色(紅硒) | 4.81 | 221 | 685 |
碲 | 銀白色 | 8.24 | 449.65 | 988 |
釙 | 銀白色 | 9.4 | 254 | 962 |
元素單質 | 顏色 | 密度(×10kg/m) | 熔點(℃) | 沸點(℃) |
|---|---|---|---|---|
氟 | 淺黃綠色 | 0.0017 | -219.52 | -188.12 |
氯 | 綠色 | 0.00321 | -100.84 | -34.04 |
溴 | 棕紅色 | 3.119 | -7.1 | 58.8 |
碘 | 紫黑色 | 4.93 | 113.5 | 184.3 |
砹 | 黑色 | 10 | 302 | 370 |
元素單質 | 顏色 | 通電後發光顏色 | 密度(×10kg/m) | 熔點(℃) | 沸點(℃) |
|---|---|---|---|---|---|
氦 | 無色 | 紫色 | 0.00013 | -272.98(加壓) | -268.93 |
氖 | 無色 | 紅色 | 0.0009 | -248.45 | -246.08 |
氬 | 無色 | 天藍色 | 0.00178 | -189.19 | -185.95 |
氪 | 無色 | 淡紅色 | 0.00374 | -157.22 | -153.22 |
氙 | 無色 | 白色 | 0.00589 | -111.7 | -108.12 |
氡 | 無色 | 紅色 | 0.00973 | -71 | -61.7 |
原子序數 | 元素單質 | 密度(×10kg/m) | 熔點(℃) | 沸點(℃) |
|---|---|---|---|---|
43 | 鎝 | 11.487 | 2157 | 4877 |
61 | 鉕 | 7.22 | 931 | 3000 |
84 | 釙 | 9.4 | 254 | 962 |
85 | 砹 | 10 | 302 | 370 |
86 | 氡 | 0.00973 | -71 | -61.7 |
87 | 鍅 | 1.87 | 27 | 677 |
88 | 鐳 | 5 | 700 | 1737 |
89 | 錒 | 10.07 | 1050 | 3198 |
90 | 釷 | 11.71 | 1755 | 4788 |
91 | 鏷 | 15.37 | 1600 | 4027 |
92 | 鈾 | 19.05 | 1132 | 4131 |
93 | 鎿 | 20.05 | 640 | 4000 |
94 | 鈽 | 19.86 | 640 | 3228 |
95 | 鎇 | 13.67 | 994 | 2607 |
96 | 鋦 | 13.57 | 1067 | 3110 |
97 | 錇 | 14.79 | 986 | 3710 |
98 | 鐦 | 15.1 | 1652 | 3900 |
元素命名