基本性質
氯化物一般具有較高的熔點和沸點(氯化銨會“升華”)。部分常見氯化物的熔沸點及相關性質見表1。部分金屬(如金)溶解在王水時會產生一種叫氯某酸(如氯金酸),一氧化氮和水。最常見的氯化物為氯化鈉,氯化鈉是食鹽的主要成分,化學式為NaCl。氯化鈉的用途廣泛,其電解產生氯氣、氫氣和氫氧化鈉,氯氣和氫氣用來製備鹽酸;氯化鈉和氯化鈣熔融後電解用來製取金屬鈉;氯化鈉也是氨鹼法制純鹼時的原料。
氯化物 | 熔點/℃ | 沸點/℃ | 相關性質 |
氯化鈉 | 801 | 1413 | 易溶於水,極微溶於乙醇,幾乎不溶於濃鹽酸。 |
氯化鉀 | 770 | 1500(部分會升華) | 易溶於水、醚、甘油及鹼類,微溶於乙醇,但不溶於無水乙醇。 |
氯化鋰 | 605 | 1350 | 易溶於水,乙醇、丙酮、吡啶等有機溶劑。 |
氯化鐵 | 282 | 315 | 棕黑色結晶,易溶於水並且有強烈的吸水性,不溶於甘油。 |
氯化亞鐵 | 670-674 | | 無水氯化亞鐵為黃綠色吸濕性晶體,可溶於水、乙醇和甲醇。 |
氯化鈣 | 772 | >1600 | 室溫下為白色、硬質碎塊或顆粒,易溶於水,溶解時放熱。 |
氯化銅 | 620 | 993 | 綠色至藍色粉末或斜方雙錐體結晶。在濕空氣中潮解。 |
物理性質
含有水結晶的氯化物大多是無色的晶體(但氯化銅是藍色晶體,氯化亞鐵是綠色晶體,氯化鐵是棕褐色晶體);易溶於水(氯化銀和
氯化亞汞不溶,氯化鉛在冷水中微溶),並形成離子,這也是氯化物溶液
導電的原因。氯化物一般具有較高的熔點和沸點(氯化銨會“升華”)。
檢驗方法
因為
硝酸銀遇到
氯離子會產生不溶於硝酸的白色氯化銀沉澱,因此可用來檢驗氯離子的存在。
製備方法
金屬在氯氣中燃燒
通過金屬在氯氣中燃燒,可以獲得該金屬的氯化物,比如金屬鈉在氯氣中燃燒,形成氯化鈉,屬於
氧化還原反應。
活潑金屬與鹽酸反應
某些活潑的金屬與鹽酸溶液反應,也可形成該金屬的氯化物,屬於氧化還原反應。但是需要注意的一點,不是所有的金屬都可以與鹽酸反應形成鹽,只有在
金屬活動性順序列表中排在氫之前的金屬才可以與鹽酸反應而形成氯化物和氫氣,比如鎂,鋁,鈣,鉀,鐵,鋅等,而金,
鉑等在金屬活動順序表中排在氫後的、較不活潑的金屬則不能與鹽酸反應形成氯化物。鉀、鈣、鈉等金屬會與鹽酸直接反應。
另外也可以通過氧化物、碳酸鹽、氫氧化物等與鹽酸反應來得到氯化物。
常見的氯化物
氯化氫
1、基本性質:
氯化氫(HCl),一個氯化氫分子是由一個氯原子和一個氫原子構成的,是無色而有
刺激性氣味的氣體。其水溶液俗稱
鹽酸,學名氫氯酸。
相對分子質量為36.46。氯化氫極易溶於水,在0℃時,1體積的水大約能溶解500體積的氯化氫。
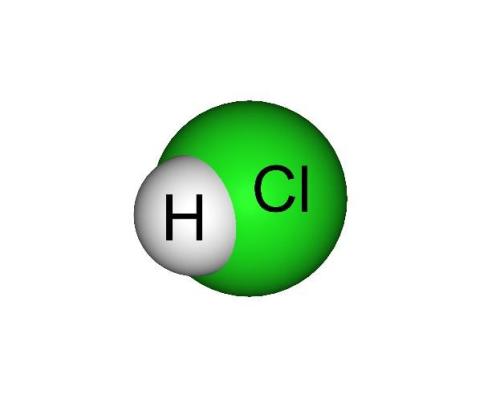 氯化氫分子結構
氯化氫分子結構氯化氫主要用於制
染料、香料、藥物、各種氯化物及腐蝕抑制劑。
2、實驗室製取氯化氫:
一般是用固體氯化鈉和濃硫酸起反應,不加熱或稍微加熱,分別生成
硫酸氫鈉和氯化氫。
NaCl+H
2SO
4= NaHSO
4+HCl↑
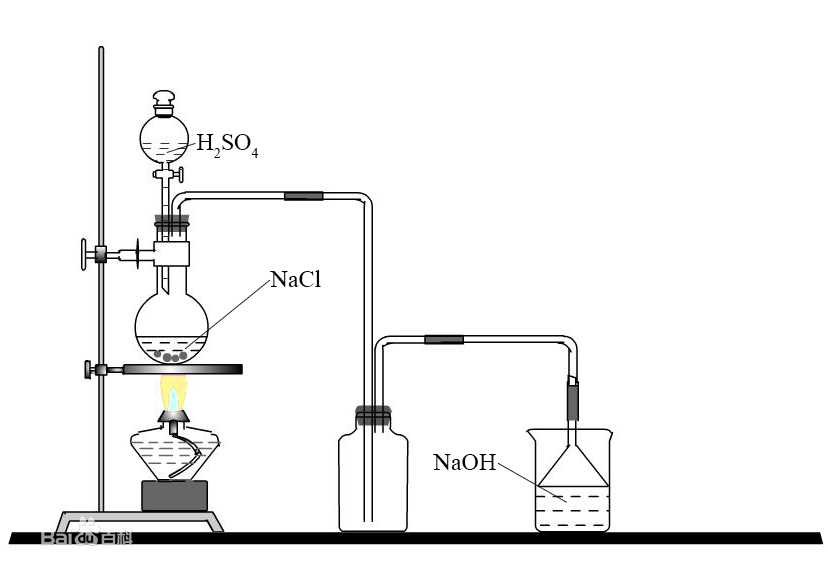 實驗室製取氯化氫裝置
實驗室製取氯化氫裝置然後在500℃到600℃的條件下,繼續起反應而生成氯化氫和
硫酸鈉。
NaHSO4+NaCl = Na2SO4+HCl↑
總的化學方程式可以表示如下:
2NaCl+H2SO4= Na2SO4+2HCl↑(註:加熱且缺水環境下HCl才加↑)
2NaCl+2H2O =通電= 2NaOH+H2↑+Cl2↑
H2+Cl2=點燃= 2HCl
氯化鈉
氯化鈉 (Sodium chloride),化學式NaCl,無色立方結晶或細小結晶粉末,味鹹。外觀是白色晶體狀,其來源主要是海水,是食鹽的主要成分。易溶於
水、
甘油,微溶於
乙醇(酒精)、
液氨;不溶於
濃鹽酸。不純的氯化鈉在空氣中有潮解性。穩定性比較好,其水溶液呈中性,工業上一般採用電解飽和氯化鈉溶液的方法來生產氫氣、氯氣和燒鹼(氫氧化鈉)及其他化工產品(一般稱為氯鹼工業)也可用於礦石冶煉(電解熔融的氯化鈉晶體生產活潑金屬鈉),醫療上用來配置生理鹽水,生活上可用於調味品。
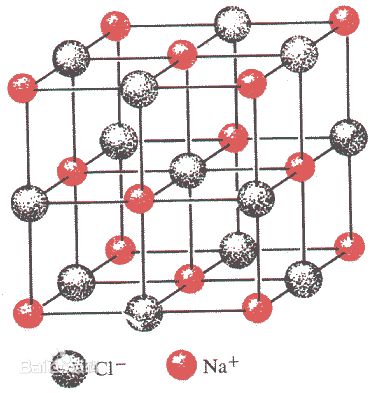 氯化鈉分子結構
氯化鈉分子結構氯化銀
氯化銀難溶於水,難溶於稀硝酸。因此在實驗室中它常被用來測定樣品氯化銀的含銀量。
AgCl懸濁液中還是有
銀離子的,所以Zn可以與銀離子反應,置換出銀,所以AgCl懸濁液能和Zn反應:
2AgCl+Zn = ZnCl2+2Ag
硫化銀的溶解度比氯化銀還小,根據沉澱轉化的原理,氯化銀可以和硫離子反應生成硫化銀:
2AgCl+Na2S = Ag2S+2NaCl
在很古老的,不是非常敏感的照片膠捲、膠版和膠紙上有使用氯化銀。但一般膠捲上使用的是化學性質上類似,但是更加對光敏感的
溴化銀AgBr。
三氯化磷
三氯化磷的分子式是PCl
3,是一種無色透明液體,沸點76℃,遇乙醇和水起水解反應:
 三氯化磷
三氯化磷 3PCl3+3H2O = H3PO3+3HCl;
三氯化磷在空氣中可生成鹽酸霧。對皮膚、黏膜有刺激腐蝕作用。短期內吸入大量蒸氣可引起上呼吸道刺激症狀,出現咽喉炎、支氣管炎,嚴重者可發生喉頭水腫致窒息、肺炎或肺水腫。皮膚及眼接觸,可引起刺激症狀或灼傷。嚴重眼灼傷可致失明。慢性影響:長期低濃度接觸可引起眼及呼吸道刺激症狀。可引起磷毒性口腔病。
氯元素與人體
氯元素以氯化鈉的形式廣泛存在於人體,一般成年人體內大約含有75-80克
氯化鈉,主要以氯離子形式廣泛存在於組織與體液中,其是
細胞外液數量最多的
陰離子。它與
碳酸氫根的含量密切。其對調節人體內的水分、滲透壓與酸鹼
平衡等都有重要作用。體內氯離子常與鈉離子相伴吸收與代謝,變化也常一致。另外在人體的骨骼和胃酸里也含有氯化物,成年人比較合適的氯化鈉日攝取量是2-5克。人體內缺少氯會導致腹瀉,缺水等症狀。
嬰兒如果由於遺傳的因素而缺氯,會導致生長障礙。有專家認為,過多的氯化鈉攝取量會導致高血壓。
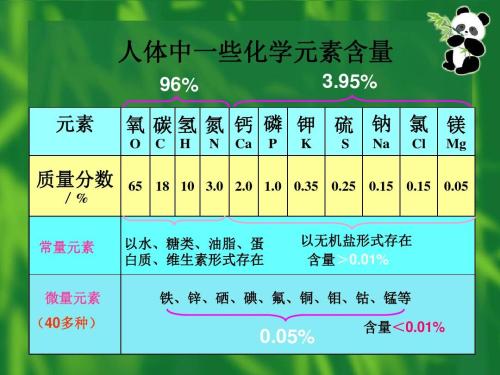 人體中的一些化學元素
人體中的一些化學元素 血清氯化物(Cl)正常值:
以氯化物計:98~106mmol/L (98~106mEq/L)。
以氯計: 100~106mmol/L (55~376mg/dl)。
血清氯化物(Cl)臨床意義:
(1)增高:
①排出減少:急、慢性腎功能
衰竭、
腎小管性酸中毒、梗阻性腎病等。
④高滲性脫水(失水>失鈉)。
⑤溴化鉍中毒。
(2)降低:
①嚴重嘔吐、高位腸梗阻、慢性幽門梗阻等。
③慢性腎上腺皮質功能減退。
⑤出汗過多未及時補足氯化鈉。
⑥心功能不全和腎炎長期無鹽或
低鹽飲食並大量利尿後。
 氯化氫分子結構
氯化氫分子結構 實驗室製取氯化氫裝置
實驗室製取氯化氫裝置 氯化鈉分子結構
氯化鈉分子結構 三氯化磷
三氯化磷 人體中的一些化學元素
人體中的一些化學元素
 氯化銀
氯化銀