基本介紹
- 中文名:碳酸
- 英文名:carbonic acid
- 別稱:甲二酸
- 化學式:H2CO3
- 分子量:62
- CAS登錄號:463-79-6
- 熔點:低沸點酸
- 水溶性:可溶於水
- 密度:1.668 g/cm3
- 外觀:是一種粉末狀固體溶液為無色液體
- 套用:產生二氧化碳
- 安全性描述:安全
- 酸性:弱酸性
理化性質
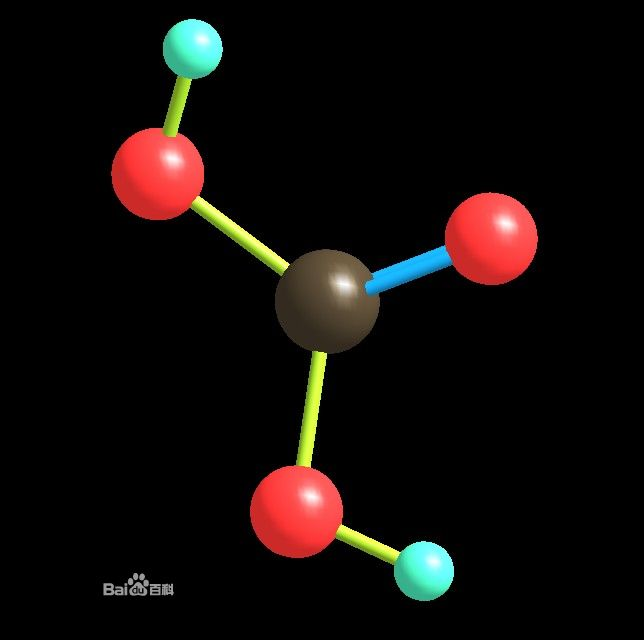 三維模型
三維模型
 三維模型
三維模型碳酸(H₂CO₃)是一種二元弱酸,電離常數都很小。但也有認為其為中強酸,因為根據無機酸酸性強弱判斷式(OH)nROm可判斷其酸性與磷酸相似。在常溫、常壓下,...
碳酸岩(carbonatite)是主要由碳酸鹽礦物(體積分數>50%)組成的一種火山岩或侵入岩。在空間上和成因上與鹼超基性雜岩體有關的、主要由碳酸鹽礦物組成的火成岩。1...
碳酸鈉 [497-19-8](Na2CO3),分子量105.99 。化學品的純度多在99.5%以上(質量分數),又叫純鹼,但分類屬於鹽,不屬於鹼。國際貿易中又名蘇打或鹼灰。它是...
碳酸飲料(汽水)類產品是指在一定條件下充入二氧化碳氣的飲料。碳酸飲料,主要成分包括:碳酸水、檸檬酸等酸性物質、白糖、香料,有些含有咖啡因,人工色素等。除糖類能...
碳酸鑭,英文名為Lanthanum carbonate,商品名為FOSRENOL, 開發與上市廠商為Shire,已上市劑型為咀嚼片,規格為250mg、500mg、750mg、1g,適應證為本品適用於治療終末期...
無水碳酸(Carbon Dioxyde)一種無色無臭氣體,分子量為44.01,蒸氣壓為1013.25kPa/-39℃,熔點-56.6℃/527kPa,沸點-78.5℃/升華,溶於水、烴類等多數有機...
碳酸甲酯編輯 鎖定 討論999 急性毒性:LD5013000mg/kg(大鼠經口);6000mg/kg(小鼠經口) 危險特性:易燃,遇明火、高熱易燃。在火場中,受熱的容器有爆炸危險。 ...
碳酸鋁是粉末狀白色小顆粒,不穩定,遇水分解。氫氧化鋁和二氧化碳在熔融狀態下反應可以生產碳酸鋁。碳酸鋁水解: Al2(CO3)3+3H2O= 2Al(OH)3↓ +3CO2↑。...
碳酸水(英文:Carbonated water),是溶入了二氧化碳的水。在溶入過程叫做碳酸化。碳酸的化學分子式是H2CO3。
碳酸銨,化學式(NH4)2·CO3。無色立方晶體,常含1分子結晶水;易溶於水,水溶液呈鹼性。不溶於乙醇、二硫化碳及濃氨水。在空氣中不穩定,會逐漸變成碳酸氫銨及...
碳酸泉的主要成分為游離二氧化碳,其含量在1克/升以上時稱為碳酸泉,俗稱“天然汽水”。又根據游離二氧化碳的含量,分為低濃度碳酸泉、中等濃度碳酸泉和高濃度碳酸泉...
碳酸酒,一種既有一定的酒精度數,又有充足氣體(即二氧化碳氣)的一種飲料,逐漸流行於年輕人的聚會之中。...
碳酸乙酯,diethyl carbonate,C5H10O3,118.13。危險化學品。本品為輕度刺激劑和麻醉劑。吸入後引起頭痛、頭昏、虛弱、噁心、呼吸困難等。液體或高濃度蒸氣有刺激性...
碳酸錳用途 編輯 它是製造電信器材軟磁鐵氧體、合成二氧化錳和製造其他錳鹽的原料,用作脫硫的氧化劑、瓷釉、塗料和清漆的顏料,也用作肥料和飼料添加劑。它同時...
碳酸鈣(CaCO₃)是一種無機化合物,俗稱:灰石、石灰石、石粉、大理石等。碳酸鈣呈中性,基本上不溶於水,溶於鹽酸。它是地球上常見物質之一,存在於霰石、方解石...
聚碳酸酯(簡稱PC)是分子鏈中含有碳酸酯基的高分子聚合物,根據酯基的結構可分為脂肪族、芳香族、脂肪族-芳香族等多種類型。其中由於脂肪族和脂肪族-芳香族聚...
碳酸鋰,一種無機化合物,化學式為Li2CO3,為無色單斜晶繫結晶體或白色粉末。密度2.11g/cm3。熔點618℃(1.013*10^5Pa)。溶於稀酸。微溶於水,在冷水中溶解...
碳酸氫鉀是一種化學物質,有著無色透明單斜晶繫結構。相對密度為2.17 g/cm³,在空氣中是穩定的物質。是生產生產碳酸鉀、醋酸鉀、亞砷酸鉀的原料。...
碳酸二乙酯(CAS: 105-58-8,英語名:Diethyl carbonate)是乙醇的二碳酸酯,常溫下為無色清澈液體。主要用作硝酸纖維素、樹脂和一些藥物(如紅黴素)的溶劑,及有機...
碳酸二甲酯(dimethyl carbonate,DMC),是一種低毒、環保性能優異、用途廣泛的化工原料,它是一種重要的有機合成中間體,分子結構中含有羰基、甲基和甲氧基等官能團,...
碳酸亞鐵(iron carbonate),是菱鐵礦的主要成分。分子式為FeCO3,,CAS號為563-71-3。不溶於水。遇水和氧氣會發生反應。...
1787年,拉瓦錫在發表的論述中講述將木炭放進氧氣中燃燒後產生的“固定空氣”,肯定了“固定空氣”是由碳和氧組成的,由於它是氣體而改稱為“碳酸氣”。同時,拉瓦錫...
