發展歷史,鈦的發現,國外發展歷程,國內發展歷程,含量分布,信息介紹,物理性質,化學性質,化學反應,鈦的化合物,鈦的分類,分布,元素來源,地理分布,總體狀況,設備製造,冶煉方法,十大性能,耐腐蝕性能,耐熱性能好,耐低溫性能好,抗阻尼性能強,無磁性、無毒,換熱性能好,彈性模量低,吸氣性能,鈦的用途,應急處置,超高純鈦,中國鈦谷,鈦產能過剩,
發展歷史 鈦的發現 1、格雷戈爾( Reverend William Gregor,1762—1817):1791年,鈦以含鈦礦物的形式在英格蘭的康沃爾郡被發現,發現者是英格蘭業餘礦物學家格雷戈爾(Reverend William Gregor),當時正業為負責康沃爾郡的克里特(Creed)教區的牧師。他在鄰近的馬納坎(Manaccan)教區中小溪旁找到了一些黑沙,後來他發現了那些沙會被磁鐵吸引,他意識到這種礦物(鈦鐵礦)包含著一種新的元素。經過分析,發現沙裡面有兩種金屬氧化物:氧化鐵(沙受磁鐵吸引的原因)及一種他無法辨識的白色金屬氧化物。意識到這種未被辨識的氧化物含有一種未被發現的金屬,格雷戈爾對康沃爾郡皇家地質學會及德國的《化學年刊》發表了這次的發現。大約就在同時,米勒·馮·賴興斯泰因(Franz-Joseph Müller von Reichenstein)也製造出類似的物質,但卻無法辨識它。
格雷戈爾 2、克拉普羅特 (Martin Heinrich Klaproth ,1743—1817):1795年德國化學家克拉普羅特在分析匈牙利產的紅色金紅石時也發現了這種氧化物。他主張採取為鈾(1789年由克拉普羅特發現的)命名的方法,引用希臘神話中泰坦神族“Titanic”的名字給這種新元素起名叫“Titanium”。中文按其譯音定名為鈦。當他聽聞到格雷戈爾較早前的發現之後,克拉普羅特取得了一些馬納坎礦物的樣本,並證實它含鈦。
克拉普羅特 3、亨特(Matthew A. Hunter):格雷戈爾和克拉普羅特當時所發現的鈦是粉末狀的二氧化鈦,而不是金屬鈦。因為鈦的氧化物極其穩定,而且金屬鈦能與氧、氮、氫、碳等直接激烈地化合,所以單質鈦很難製取。直到1910年才被美國化學家亨特第一次用鈉還原TiCI製得純度達99.9%的金屬鈦。
亨特 國外發展歷程 1940年盧森堡科學家W.J.Kroll用
鎂 還原TiCl4製得了純鈦。從此,鎂還原法(又稱為克勞爾法)和鈉還原法(又稱為亨特法)成為生產海綿鈦的工業方法。美國在1948年用鎂還原法制出2噸海綿鈦,從此開始了鈦的工業化生產 。
1947年,人們才開始在工廠里冶煉鈦。當年,產量只有2噸。1955年產量激增到2萬噸。1972年,年產量達到了 20萬噸。鈦的
屈服強度 比鋼鐵要高,而它的重量幾乎只有同體積的鋼鐵的一半,鈦雖然稍稍比鋁重一點,它的屈服強度卻比鋁大2倍。鈦的比強度高於鋁和鋼,比模量與鋁、鋼十分接近。在
宇宙火箭 和飛彈中,就大量用鈦代替鋼鐵。據統計, 世界上每年用於宇宙航行的鈦,已達一千噸以上。極細的鈦粉,還是火箭的好燃料,所以鈦被譽為宇宙金屬,空間金屬。
鈦在高溫下極易和空氣發生反應,但熔點高達1668℃。在常溫下,鈦不怕王水和稀硝酸腐蝕,但不耐5%以上濃度的硫酸和7%鹽酸腐蝕。鈦不怕常溫的海水,有人曾把一塊鈦沉到海底,五年以後取上來一看,上面粘了許多小動物與海底植物,卻一點也沒有生鏽,依舊亮閃閃的。
人們開始用鈦來製造潛艇——
鈦 潛艇 。由於鈦非常結實,能承受很高的壓力,這種潛艇可以在深達4500米的深海中航行。
國內發展歷程 中國鈦工業起步於20世紀50年代。1954,
北京有色金屬研究總院 開始進行海綿鈦製備工藝研究,1956年國家把鈦當作戰略金屬列入了12年發展規劃,1958年在
撫順鋁廠 實現了海綿鈦工業試驗,成立了中國第一個海綿鈦生產車間,同時在瀋陽有色金屬加工廠成立了中國第一個鈦板帶加工材生產試驗車間。
20世紀60-70年代,在國家的統一規劃下,先後建設了以
遵義 鈦廠為代表的10餘家海綿鈦生產單位;在1967年在洛陽銅加工廠成立了中國第一個鈦管棒加工材生產試驗車間和第二條鈦板帶材生產試驗車間,並為主承擔了當時國內第一艘核潛艇、第一艘飛彈驅逐艦及航空用鈦材的試製開發任務,直到1972年寶雞有色金屬加工廠建成投產後,洛陽銅加工將工藝資料移交北京有色研究總院,按照冶金部的專業劃分,不再承擔鈦材料的開發試製工作;以北京有色研究總院、瀋陽鋁鎂院、撫順鋁廠、瀋陽有色金屬加工廠、東北輕合金加工廠、洛陽銅加工廠等單位為主,援建了寶雞有色金屬加工廠和寶雞貴金屬所,從此按照行業劃分,以寶雞有色金屬加工廠和寶雞貴金屬所為主,承擔了國內大部分鈦加工材料的生產開發試製工作。同時中國也成為繼美國、前蘇聯和日本之後的第四個具有完整鈦工業體系的國家。
1980年前後,中國海綿鈦產量達到2800噸,然而由於當時大多數人對
鈦金屬 認識不足,鈦材的高價格也限制了鈦的套用,鈦加工材的產量僅200噸左右,中國鈦工業陷入困境。在這種情況下,由當時國務院副總理
方毅 同志倡導,朱鎔基和
袁寶華 同志支持,於1982年7月成立了跨部委的全國鈦套用推廣領導小組,專門協調鈦工業的發展事宜,促成了20世紀80年代至90年代初期中國海綿鈦和鈦加工材產銷兩旺、鈦工業快速平穩發展的良好局面。
綜上所述,中國鈦工業大致經歷了三個發展期:即20世紀50年代的開創期,60-70年代的建設期和80-90年代的初步發展期。在新世紀,得益於國民經濟的持續、快速發展,中國鈦工業也進入了一個快速成長期。
含量分布 地球表面十公里厚的地層中,含鈦達千分之六,比銅多61倍,在地殼中的含量排第十位(地殼中元素排行:氧、矽、鋁、鐵、鈣、鈉、鉀、鎂、氫、鈦),隨便從地下抓起一把泥土,其中都含有千分之幾的鈦,世界上儲量超過一千萬噸的
鈦礦 並不稀罕。
鈦 地球上有成億噸的砂石,鈦和
鋯 這兩種比砂石重的
礦物 ,就混雜在砂石中,經過海水千百萬年晝夜不停地淘洗,把比較重的
鈦鐵礦 和
鋯英砂 礦沖在一起,在漫長的海岸邊,形成了一片一片的鈦礦層和鋯礦層。這種礦層是一種黑色的砂子,通常有幾厘米到幾十厘米厚。鈦沒有鐵磁性,用鈦建造的
核潛艇 不必擔心磁性
水雷 的攻擊。
鈦礦石 信息介紹 CAS No.:7440-32-6
EINECS號:241-036-9
元素在海水中的含量:(ppm)
0.00048
元素在太陽中的含量:(ppm)
銀白色有光澤的金屬鈦 4
元素類型:金屬
核電荷數:22
外圍電子層排布:3d2 4s2
電子層:K-L-M-N
10.64
地殼中含量:(ppm)
5600
以下為增加內容:
氧化態:
Main Ti+4
Other Ti-1,Ti0,Ti+2,Ti+3
所屬周期:4
所屬族數:ⅣB
氫化物:TiH4
氧化物:TiO
密度:4.54g/立方厘米
熔點:1660.0℃
沸點:3287.0℃
M - M+ 658
M+ - M2+ 1310
M2+ - M3+ 2652
M3+ - M4+ 4175
M4+ - M5+ 9573
M5+ - M6+ 11516
M6+ - M7+ 13590
M7+ - M8+ 16260
M8+ - M9+ 18640
M9+ - M10+ 20830
a = 295.08 pm
b = 295.08 pm
c = 468.55 pm
α = 90°
β = 90°
γ = 120°
顏色和狀態:銀灰色金屬
發現人:格雷戈爾 發現年代:1791年
已知的鈦的
同位素 有13種,包括鈦-41至鈦-53。其中鈦的
穩定同位素 有鈦-46,鈦-47,鈦-48,鈦-49,鈦-50共五種,其餘的同位素均有
放射性 。
物理性質 鈦具有金屬光澤,有延展性。密度為4.5克/立方厘米。熔點1660±10℃。沸點3287℃。化合價+2、+3和+4。電離能為6.82
電子伏特 。鈦的主要特點是密度小,機械強度大,容易加工。鈦的塑性主要依賴於純度。鈦越純,塑性越大。有良好的抗腐蝕性能,不受大氣和海水的影響。在常溫下,不會被7%以下鹽酸、5%以下硫酸、硝酸、王水或稀鹼溶液所腐蝕;只有氫氟酸、濃鹽酸、濃硫酸等才可對它作用。
鈦是鋼與合金中重要的合金元素,鈦的密度為4.506-4.516克/立方厘米(20℃),高於鋁而低於
鐵 、銅、鎳。
但 比強度 位於金屬之首 。熔點1668±4℃,熔化潛熱3.7-5.0千卡/克原子,沸點3260±20℃,汽化潛熱102.5-112.5千卡/克原子,臨界溫度4350℃,
臨界壓力 1130大氣壓。鈦的導熱性和導電性能較差,近似或略低於不鏽鋼,鈦具有超導性,純鈦的
超導臨界溫度 為 0.38-0.4K。在25℃時,鈦的熱容為0.126卡/克原子·度,熱焓1149卡/克原子,熵為7.33卡/克原子·度,金屬鈦是
順磁性物質 ,導磁率為1.00004。
鈦具有可塑性,
高純鈦 的延伸率可達50-60%,斷面收縮率可達70-80%,但收縮強度低(即收縮時產生的力度)。鈦中雜質的存在,對其
機械性能 影響極大,特別是間隙雜質(氧、氮、碳)可大大提高鈦的強度,顯著降低其塑性。鈦作為結構材料所具有的良好機械性能,就是通過嚴格控制其中適當的雜質含量和添加
合金元素 而達到的。
化學性質 化學反應 鈦在較高的溫度下,可與許多元素和化合物發生反應。各種元素,按其與鈦發生不同反應可分為四類:
第一類:
鹵素 和氧族元素與鈦生成
共價鍵 與離子鍵化合物;
第二類:過渡元素、氫、鈹、硼族、碳族和氮族元素與鈦生成金屬間化物和有限固溶體;
第三類:鋯、鉿、釩族、鉻族、鈧元素與鈦生成無限固溶體;
第四類:
惰性氣體 、
鹼金屬 、鹼土金屬、
稀土元素 (除鈧外),錒、釷等不與鈦發生反應或基本上不發生反應。與化合物HF和氟化物氟化氫氣體在加熱時與鈦發生反應生成TiF
4 ,反應式為
Ti+4HF=TiF4 +2H2 +135.0千卡
不含水的
氟化氫 液體可在鈦表面上生成一層緻密的四氟化鈦膜,可防止HF浸入鈦的內部。氫氟酸是鈦的最強溶劑。即使是濃度為1%的氫氟酸,也能與鈦發生激烈反應:
2Ti+6HF=2TiF3 +3H2
無水的氟化物及其水溶液在低溫下不與鈦發生反應,僅在高溫下熔融的氟化物與鈦發生顯著反應。 HCl和氯化物
氯化氫 氣體能腐蝕金屬鈦,乾燥的氯化氫在>300℃時與鈦反應生成TiCl
4: Ti+4HCl=TiCl4 +2H2 +94.75千卡
濃度<5%的鹽酸在室溫下不與鈦反應,20%的鹽酸在常溫下與鈦發生瓜在生成紫色的TiCl3:
2Ti+6HCl=2TiCl3 +3H2
當溫度長高時,即使稀鹽酸也會腐蝕鈦。各種無水的氯化物,如鎂、錳、鐵、鎳、銅、鋅、汞、錫、鈣、鈉、鋇和NH
4 + 離子及其水溶液,都不與鈦發生反應,鈦在這些氯化物中具有很好的穩定性。硫酸和
硫化氫 鈦與5%的硫酸有明顯的反應,在常溫下,約40%的硫酸對鈦的腐蝕速度最快,當濃度大於40%,達到60%時腐蝕速度反而變慢,80%又達到最快。加熱的稀酸或50%的
濃硫酸 可與鈦反應生成硫酸鈦:
Ti+H2 SO4 =TiSO4 +H2
2Ti+3H2 SO4 =Ti2 (SO4 )3 +3H2
加熱的濃硫酸可被鈦還原,生成SO2:
2Ti+6H2 SO4 =Ti2 (SO4 )3 +3SO2 +6H2 O+202千卡
常溫下鈦與硫化氫反應,在其表面生成一層保護膜,可阻止硫化氫與鈦的進一步反應。但在高溫下,硫化氫與鈦反應析出氫:
Ti+H2 S=TiS+H2 +70千卡
粉末鈦在600℃開始與硫化氫反應生成鈦的硫化物,在900℃時反應產物主要為TiS,1200℃時為Ti
2 S
3 。
硝酸 和王水 緻密的表面光滑的鈦對硝酸具有很好的穩定性,這是由於硝酸能快速在鈦表面生成一層牢固的氧化膜,但是表面粗糙,特別是海綿鈦或粉末鈦,可與次、熱稀硝酸發生反應:
3Ti+4HNO3 +4H2 O=3H4 TiO4 +4NO
3Ti+4HNO3 +H2 O=3H2 TiO3 +4NO
高於70℃的濃硝酸也可與鈦發生反應:
Ti+8HNO3 =Ti(NO3 )4 +4NO2 +4H2 O
常溫下,鈦不與王水反應。溫度高時,鈦可與王水反應生成TiCl
2 。 Ti+8HNO
3 =Ti(NO
3 )
4 +4NO
2 +4H
2 O ⑾ 綜上所述,鈦的性質與溫度及其存在形態、純度有著極其密切的關係。緻密的金屬鈦在自然界中是相當穩定的,但是,粉末鈦在空氣中可引起自燃。鈦中雜質的存在,顯著的影響鈦的物理、化學性能、機械性能和耐腐蝕性能。特別是一些間隙雜質,它們可以使鈦晶格發生畸變,而影響鈦的的各種性能。常溫下鈦的化學活性很小,能與氫氟酸等少數幾種物質發生反應,但溫度增加時鈦的活性迅速增加,特別是在高溫下鈦可與許多物質發生劇烈反應。鈦的冶煉過程一般都在800℃以上的高溫下進行,因此必須在真空中或在惰性氣氛保護下操作。金屬鈦的物理性質金屬鈦(Ti),灰色金屬。原子序數為22,
相對原子質量 47.87。核外電子在亞層中的排布情況為1S2 2S2 2P6 3S2 3P6 3d2 4S2。金屬活動性在鎂、鋁之間,常溫下並不穩定,因此在自然界中只以化合態存在,常見的鈦的化合物有鈦鐵礦(FeTiO3)、金紅石(TiO2)等。鈦在地殼中含量較高,排行第九,達5600ppm,換算成百分比為0.56%。純鈦密度為4.54×103kg/m3,摩爾體積為10.54cm3/mol,硬度較差,莫氏硬度只有4左右,因此延展性好。鈦的熱穩定性很好,熔點為1660±10℃,沸點為3287℃。金屬鈦的化學性質 金屬鈦在高溫環境中的還原能力極強,能與氧、碳、氮以及其他許多元素化合,還能從部分
金屬氧化物 (比如氧化鋁)中奪取氧。常溫下鈦與氧氣化合生成一層極薄緻密的氧化膜,這層氧化膜常溫下不與硝酸,稀硫酸,稀鹽酸反應,以及酸中之王——王水。它與
氫氟酸 、
濃鹽酸 、濃硫酸反應。
鈦耐腐蝕,所以在化學工業上常常要用到它。過去,
化學反應器 中裝熱硝酸的部件都用不鏽鋼。不鏽鋼也怕那強烈的腐蝕劑——熱硝酸,每隔半年,這種部件就要統統
換掉 。用鈦來製造這些部件,雖然成本比不鏽鋼部件貴一些,但是它可以連續不斷地使用五年,計算起來反而合算得多。
在電化學中,鈦是單向閥型金屬,
電位 很負,通常無法用鈦作為陽極進行分解。
鈦的最大缺點是難於提煉。主要是因為鈦在高溫下化合能力極強,可以與氧、碳、氮以及其他許多元素化合。因此,不論在冶煉或者鑄造的時候,人們都小心地防止這些元素“侵襲”鈦。在冶煉鈦的時候,空氣與水當然是嚴格禁止接近的,甚至連冶金上常用的氧化鋁
坩堝 也禁止使用,因為鈦會從氧化鋁里奪取氧。人們利用鎂與
四氯化鈦 在惰性氣體——
氦氣 或
氬氣 中相作用,來提煉鈦。
人們利用鈦在高溫下化合能力極強的特點,在煉鋼的時候,氮很容易溶解在鋼水裡, 當鋼錠冷卻的時候,鋼錠中就形成氣泡,影響鋼的質量。所以煉鋼工人往鋼水裡加進金屬鈦,使它與氮化合,變成
爐渣 一—氮化鈦,浮在鋼水表面,這樣鋼錠就比較純淨了。
當
超音速飛機 飛行時,它的機翼的溫度可以達到500℃。如用比較耐熱的
鋁合金 製造機翼,一到二三百度也會吃不消,必須有一種又輕、又韌、又耐高溫的材料來代替鋁合金而鈦恰好能夠滿足這些要求。鈦還能經得住零下一百多度的考驗,在這種低溫下,鈦仍舊有很好的
韌性 而不發脆。
利用鈦和鋯對空氣的強大吸收力,可以除去空氣,造成真空。比方,利用鈦製成的
真空泵 ,可以把空氣抽到只剩下十萬億分之一。
鈦的化合物 鈦的氧化物為
二氧化鈦 ,天然TiO
2 是金紅石,純淨的TiO
2 是雪白的粉末,是最好的白色顏料,俗稱鈦白,冷時為白色,熱時呈淺黃色。以前,人們開採鈦礦,主要目的便是為了獲得二氧化鈦。鈦白的粘附力強,不易起
化學變化 ,永遠是雪白的,是極好的白色塗料,它折射率高,著色里強,遮蓋力大,化學性能穩定。其他白色塗料,如
鋅白 ZnO和
鉛白 2PbCO
3 ·Pb(OH)
2 等,不具有鈦白的這些優良性能。特別可貴的是鈦白無毒。它的熔點很高,被用來製造耐火玻璃,釉料,
琺瑯 、陶土、耐高溫的實驗器皿等。
二氧化鈦是世界上最白的東西, 1克二氧化鈦可以把 450多平方厘米的面積塗得雪白。它比常用的白顏料一—
鋅鋇白 還要白5倍,因此是調製白油漆的最好顏料。世界上用作顏料的二氧化鈦,一年多到幾十萬噸。二氧化鈦可以加在紙里,使紙變白並且不透明,效果比其他物質大10倍,因此,鈔票紙和美術品用紙就要加二氧化鈦。此外,為了使塑膠的顏色變淺,使人造絲光澤柔和,有時也要添加二氧化鈦。在橡膠工業上,二氧化鈦還被用作為白色橡膠的填料。
四氯化鈦非常有趣,它在通常狀況下為無色液體(熔點-25℃,沸點136.4℃),有刺鼻氣味,在
濕空氣 中便會大冒白煙——它
水解 了,變成白色的二氧化鈦的水凝膠。在水中則強烈水解為偏鈦酸H
2 TiO
3 。在軍事上,人們便利用四氯化鈦的這股怪脾氣,作為人造煙霧劑。特別是在海洋上,水氣多,一放四氯化鈦,濃煙就象一道白色的長城,擋住了敵人的視線。在農業上,人們利用四氟化鈦來防霜。
TiCl3 是紫色晶體,其水溶液可用做還原劑。Ti3+ 比Sn2+ 有更強的還原性。
鈦酸鋇晶體 有這樣的特性:當它受壓力而改變形狀的時候,會產生電流,一通電又會改變形狀。於是,人們把鈦酸鋇放在超音波中,它受壓便產生電流,由它所產生的電流的大小可以測知超音波的強弱。相反,用高頻電流通過它,則可以產生超音波。幾乎所有的超音波儀器中,都要用到
鈦酸鋇 。除此之外,鈦酸鋇還有許多用途。例如:鐵路工人把它放在鐵軌下面,來測量火車通過時候的壓力;醫生用它製成脈搏記錄器。用鈦酸鋇做的水底探測器,是銳利的水下眼睛,它不只能夠看到魚群,而且還可以看到水底下的暗礁、冰山和敵人的潛水艇等。
冶煉鈦時,要經過複雜的步驟。把鈦鐵礦變成四氯化鈦,再放到密封的
不鏽鋼罐 中,充以氬氣,使它們與金屬鎂反應,就得到“海綿鈦”。這種多孔的“海綿鈦”是不能直接使用的,還必須把它們在
電爐 中融化成液體,才能鑄成
鈦錠 。但製造這種電爐又談何容易!除了電爐的空氣必須抽乾淨外,更傷腦筋的是,簡直找不到盛裝液態鈦的坩堝,因為一般
耐火材料 都含有氧化物,而其中的氧就會被液態鈦奪走。後來,人們終於發明了一種“水冷銅坩堝”的電爐。這種電爐只有中央一部分區域很熱,其餘部分都是冷的,鈦在電爐中熔化後,流到用水冷卻的銅坩堝壁上,馬上凝成鈦錠。用這種方法已經能夠生產幾噸重的鈦塊,但它的成本就可想而知了。
鈦的分類 工業純鈦:工業純鈦的雜質含量較化學純鈦要多,因此其強度、硬度也稍高,其力學性能及化學性能與不鏽鋼相近,比起鈦合金純鈦強度較好,在抗
氧化性 方面優於
奧氏體不鏽鋼 ,但耐熱性較差,TA1、TA2、TA3依次雜質含量增高,機械強度、硬度依次增強,但塑性韌性依次下降。
β 型鈦:β型鈦合金屬可
熱處理 強化,合金強度高、焊接性、壓力加工性良好,但性能不穩定,且熔煉工藝複雜。
A、β鈦板:0.5-4.0mm
B、眼鏡板(純鈦):0.8-8.0mm
C、標板(純鈦):1 x 2m 厚度:0.5-20mm
D、電鍍及其它行業用板(純鈦):0.1-50mm
用途:電子、化工、鐘錶、眼鏡、首飾、體育用品、機械設備、電鍍設備、環保設備、高爾夫球及精密加工等行業。
鈦管規格:φ6-φ120mm 壁厚:0.3-3.0mm
鈦管用途:環保設備、冷卻管、鈦發熱管、電鍍設備、
戒指 及各種精密電器用管等行業。
A、β鈦絲規格:φ0.8-φ6.0mm
B、眼鏡鈦絲規格:φ1.0-φ6.0mm專用鈦絲
C、鈦絲規格:φ0.2-φ8.0mm掛具專用
鈦絲用途:軍工、醫用、體育用品、眼鏡、耳環、頭飾、
電鍍掛具 、焊絲等行業。
A、方棒規格:方條:8-12mm
B、磨光圓棒:φ4-φ60mm
C、毛棒、黑皮棒:φ6-φ120mm
鈦棒用途:主要用於機械設備、電鍍設備、醫用、各種精密機件等行業。
分布 元素來源 鈦屬於
稀有金屬 ,實際上鈦並不稀有,其在地殼中的
豐度 占第七位,占0.45%,遠遠高於許多常見的金屬。但由於鈦的性質活潑,對冶煉工藝要求高,使得人們長期無法製得大量的鈦,從而被歸類為“稀有”的金屬。用於冶煉鈦的礦物主要有鈦鐵礦(FeTiO
3 )、金紅石(TiO
2 )和鈣鈦礦等。礦石經處理得到易揮發的四氯化鈦,再用鎂還原而製得純鈦。
地理分布 中國鈦資源總量9.65億噸,居世界之首,占世界探明儲量的38.85%,主要集中在四川、雲南、廣東、廣西及海南等地,其中攀西(攀枝花西昌)地區是中國最大的鈦資源基地,鈦
資源量 為8.7億噸。
中國探明的鈦
資源分布 在21個省(自治區、直轄市)共108個礦區(圖3.5.1及表3.5.4)。主要產區為四川,次有河北、海南、廣東、湖北、廣西、雲南、陝西、山西等省(區)。
鈦磁鐵礦 岩礦:主要礦床分布在四川省
攀枝花 的
鹽邊 紅格和
米易 白馬,西昌的
太和 ;河北省
承德 的大廟、
黑山 ,豐寧的招兵溝,
崇禮 的南天門;山西省
左權 的桐峪;陝西省
洋縣 的畢機溝;新疆的尾亞;河南省
舞陽 的趙案莊;廣東省
興寧 的霞嵐;黑龍江省的
呼瑪 ;北京市
昌平 的上莊和
懷柔 的新地。其中四川省表內儲量(TiO
2 44256.32萬t)占全國同類儲量(TiO
2 46522.83萬t)的95.1%,河北省(TiO
2 1544.46萬t)占3.3%,陝西省占0.46%,山西省占0.35%。
金紅石岩礦 主要礦床分布在湖北省
棗陽 的大阜山;山西省
代縣 的碾子溝;河南省新縣的
楊沖 ;山東省
萊西 縣的劉家莊。其中湖北省金紅石(TiO
2 )表內儲量(534.43萬t)占全國同類儲量(750.86萬t)的71.2%,山西省(154.79萬t)占20.6%,陝西省(44.4萬t)占5.9%。
鈦的主要礦石是金紅石TiO
2 和鈦鐵礦FeTiO
3 ,它的發現也正是從這兩種礦石的分析而來。早在1791年英國英格蘭西南端
康沃爾 (Cornwall)郡門拉陳(Menacan)教區的牧師格累高爾,也是一位科學家,分析出產在他教區內的一種黑色礦砂,也就是今天成為鈦鐵礦的礦石時發現了一種新的金屬物質並命名為menacenite。三年後,1795年,克拉普羅特分析了匈牙利布伊尼克(Boinik)地區出產的金紅石,認識到它是一種新金屬的氧化物,具有抵抗酸、鹼溶液的特性,借用希臘神話中大地的第一代兒子們泰坦神族Titans,命名這個金屬為titanium,
元素符號 定為Ti。兩年後,克拉普羅特證實格累高爾發現的menacenite就是鈦。
鈦對於酸、鹼具有較強的耐腐蝕性,已成為化工生產中重要的材料。
鈦一般被認為是稀有金屬,其實它在地殼中的含量相當大,比一般的常用的金屬鋅、銅、錫等都大,甚至比氯、磷都大。
總體狀況 截至1995年底,世界金紅石(包括銳鈦礦)儲量和
儲量基礎 分別為3330萬t和16440萬t,資源總量約2.3億t(TiO
2 含量,下同),主要集中在
南非 、印度、斯里蘭卡、澳大利亞。世界鈦鐵礦(TiO
2 )儲量和儲量基礎分別為2.743億t和4.353億t,資源總量約10億t;主要集中在南非、挪威、澳大利亞、加拿大和印度。
截至1996年底中國保有
原生鈦 (磁)鐵礦(折TiO
2 )儲量35704.09萬t(其中A+B+C級23191.50萬t);鈦鐵礦(砂礦)礦物儲量3803.19萬t(其中A+B+C級2147.17萬t);金紅石礦物儲量256.86萬t(其中A+B+C級73.73萬t);金紅石TiO
2 儲量750.86萬t(其中A+B+C級242.43萬t)。
若將中國1996年保有鈦鐵礦砂礦的A+B+C級礦物儲量2147.17萬t,按含TiO2 48%折算,則其TiO2 儲量為1030.64萬t,僅占同年世界鈦鐵礦(TiO2 )27000萬t的3.83%;若再將其與原生鈦磁鐵礦岩礦(TiO2 )的A+B+C級儲量(23 191.50萬t)中可利用的約占50%以粒狀鈦鐵礦產出的(TiO2 )儲量11595.75萬t相加,其TiO2 總儲量為12626.4萬t,則占世界鈦鐵礦(TiO2 )儲量27000萬t的47.76%,從這個意義上說,中國可稱為世界鈦鐵礦資源最豐富的國家。
若將中國1996年保有金紅石礦物的A+B+C級儲量73.73萬t按含TiO2 94%折算成TiO2 儲量為69.31萬t,再加上同年金紅石(TiO2 )的A+B+C級儲量242.43萬t,合計為311.74萬t,則占同年世界金紅石(TiO2 )儲量3330萬t的9.36%,由此可見中國金紅石資源並不豐富。
設備製造 1.反應釜:由於用戶因生產工藝、操作條件不盡相同,夾套加熱型式分為電熱棒加熱、蒸汽加熱、導熱油循環加熱;軸封裝置分為填料密封和機械密封;攪拌型式有錨式、漿式、鍋輪式、推進式或框式。開孔數量、規格或其它要求可根據用戶要求設計、製作。
2.冷凝器:
列管冷凝器 ,按材質分為複合鈦列管冷凝、鈦列管式冷凝器和
碳鋼 與鈦混合列管式冷凝三種,按形式分為固定管板式、浮頭式、U型管式
換熱器 , 按結構分為單管程、雙管程和多管程。傳熱面積0.5-500m
2 ,可根據用戶不同需要定製。
3.罐:我廠設計的發酵罐為標準式罐型,這種罐型當公稱容積在6m
3 以下時罐採用夾套式。發酵氣的冷卻或加熱,均由夾套來完成。公稱容積為6m
3 以上時,發酵氣的冷卻由立式排管來擔負,在罐內排管的連線方面我們作了改進。這主要避免在罐體上多開孔,開成死角。這種連續方式在實際使用中得到滿意的效果。發酵設備罐型可分為兩大類:一類是嫌氣發酵的錐型(如
酒精 發酵),另一類是為氣發酵的罐型(如標準式、伍式、自吸式等)。這類設備尤以標準式罐型使用最為普遍。我廠設計的發酵罐系列圖紙資料屬於標準式罐型。在設計各種規格的發酵設備時,做到設計結構嚴密,有足夠的強度和使用壽命,力求設備內部附屬檔案少,表面光滑,注意到要有良好的氣棗汽接觸和汽刺固混和性能,使物質傳遞,氣體交換有效地進行。有足夠的熱交換面積,以保證發酵能在最適宜的溫度下進行。重視設備的密封性能以保證滅菌操作。
4.冷卻器:
主要用途:主要適用於製藥、食品、化工等
工業部門 對液料的濃縮,並且亦能回收酒精和簡單的回流提取。 結構:本設備主要包括濃縮罐、第一冷凝器、汽液分離器、第二冷凝器、冷卻器、受液桶六個部件組成,全部有鈦製造。濃縮罐為夾套結構,冷凝器為列管式,冷卻器為蛇管式。【要求可根據用戶要求設計、製作】
冶煉方法 製取金屬鈦的原料主要為金紅石,其中含TiO
2 大於96%。缺少金紅石礦的國家,例如蘇聯,則採用鈦鐵礦製成的"
高鈦渣 ",其中含TiO
2 90%左右。因天然金紅石漲價和儲量日減,各國都趨向於用鈦鐵礦製成富鈦料,即高鈦渣和人造金紅石。鈦在1791年被發現,而第一次製得純淨的鈦卻是在1910年,中間經歷了一百餘年。原因在於:鈦在高溫下性質十分活潑,很易和氧、氮、碳等元素化合,要提煉出純鈦需要十分苛刻的條件。
製取鈦流程 工業上常用硫酸分解鈦鐵礦的方法製取二氧化鈦,再由二氧化鈦製取金屬鈦。濃硫酸處理磨碎的鈦鐵礦(
精礦 ),發生下面的
化學反應 :
FeTiO3 +3H2 SO4 == Ti(SO4 )2 +FeSO4 +3H2 O
FeTiO3 +2H2 SO4 == TiOSO4 +FeSO4 +2H2 O
FeO+H2 SO4 == FeSO4 +H2 O
Fe2 O3 +3H2 SO4 ==Fe2 (SO4 )3 +3H2 O
為了除去雜質Fe
2 (SO
4 )
3 ,加入鐵屑,Fe
3+ 還原為Fe
2+ ,然後將溶液冷卻至273K以下,使得FeSO
4 ·7H
2 O(
綠礬 )作為副產品結晶析出。
Ti(SO4 )2 和TiOSO4 水解析出白色的偏鈦酸沉澱,反應是:
Ti(SO4 )2 +H2 O == TiOSO4 +H2 SO4
TiOSO4 +2H2 O == H2 TiO3 +H2 SO4
H2 TiO3 == TiO2 +H2 O
工業上制金屬鈦採用金屬熱還原法還原四氯化鈦。將TiO2 (或天然的金紅石)和炭粉混合加熱至1000~1100K,進行氯化處理,並使生成的TiCl4 ,蒸氣冷凝。
TiO2 +2C+2Cl2 =TiCl4 +2CO
在1070K 用熔融的鎂在氬氣中還原TiCl4 可得多孔的海綿鈦:
TiCl4 +2Mg=2MgCl2 +Ti
這種海綿鈦經過粉碎、放入
真空電弧爐 里熔煉,最後製成各種鈦材。
也可以通過反應:Ti+2CI2 =TiCI4
得到的TiCI4 經過高溫(1250℃左右)情況下分解:
TiCI4 =Ti+2CI2
由此得到純鈦棒。
鈦及鈦合金的特性、用途
純鈦是銀白色的金屬,它具有許多優良性能。鈦的密度為4.54g/立方厘米,比鋼輕43% ,比久負盛名的
輕金屬 鎂稍重一些。機械強度卻與鋼相差不多,比鋁大兩倍,比鎂大五倍。鈦耐高溫,熔點1942K,比黃金高近1000K ,比鋼高近500K。
鈦屬於
化學性質 比較活潑的金屬。加熱時能與O
2 、N
2 、H
2 、S和鹵素等非金屬作用。但在常溫下,鈦表面易生成一層極薄的緻密的氧化物保護膜,可以抵抗強酸甚至
王水 的作用,表現出強的抗腐蝕性。因此,一般金屬在酸、鹼、鹽的溶液中變得千瘡百孔而鈦卻安然無恙。
液態鈦幾乎能溶解所有的金屬,因此可以和多種金屬形成合金。鈦加入鋼中製得的
鈦鋼 堅韌而富有彈性。鈦與金屬Al、Sb、Be、Cr、Fe等生成填隙式化合物或
金屬間化合物 。
鈦合金製成飛機比其它金屬製成同樣重的飛機多載旅客100多人。製成的潛艇,既能抗
海水腐蝕 ,又能抗深層壓力,其下潛深度比不鏽鋼潛艇增加80%。同時,鈦無磁性,不會被水雷發現,具有很好的反監護作用。
鈦具有“親生物”性。在人體內,能抵抗分泌物的腐蝕且無毒,對任何殺菌方法都適應。因此被廣泛用於制醫療器械,制人造髖關節、膝關節、肩關節、脅關節、頭蓋骨,主動心瓣、骨骼固定夾。當新的肌肉纖維環包在這些“鈦骨”上時,這些鈦骨就開始維繫著人體的正常活動。
鈦在人體中分布廣泛,正常人體中的含量為每70kg體重不超過15mg,其作用尚不清楚。但鈦能刺激吞噬細胞,使免疫力增強這一作用已被證實。
鈦的化合物及用途
重要的鈦化合物有:二氧化鈦(TiO2 )、四氯化鈦(TiCl4 )、偏鈦酸鋇(BaTiO3 )。
純淨的二氧化鈦是白色粉末,是優良的白色顏料,商品名稱“鈦白”。它兼有鉛白(PbCO3)的遮蓋性能和鋅白(ZnO)的持久性能。因此,人們常把鈦白加在油漆中,製成高級白色油漆;在
造紙工業 中作為填充劑加在紙槳中;
紡織工業 中作為人造纖維的消光劑;在
玻璃 、陶瓷、搪瓷工業上作為添加劑,改善其性能;在許多化學反應中用作催化劑。在化學工業日益發展的今天,二氧化鈦及鈦系化合物作為精細化工產品,有著很高的附加價值,前景十分誘人。
四氯化鈦是一種無色液體;熔點250K、沸點409K,有刺激性氣味。它在水中或潮濕的空氣中都極易水解,冒出大量的白煙。
TiCl4 +3H2 O == H2 TiO3 +4HCl
因此TiCl4在軍事上作為人造煙霧劑,猶其是用在海洋戰爭中。在農業上,人們用TiCl4形成的濃霧地面,減少夜間地面熱量的散失,保護蔬菜和農作物不受嚴寒、霜凍的危害。
將TiO2 和BaCO3 一起熔融製得偏鈦酸鋇:
TiO2 +BaCO3 == BaTiO3 十CO2
人工製得的BaTiO
3 具有高的介電常數,由它製成的電容器有較大的容量,更重要的是BaTiO
3 具有顯著的“壓電性能”,其晶體受壓會產生電流,一通電,又會改變形狀。人們把它置於超音波中,它受壓便產生電流,通過測量電流強弱可測出超音波強弱。幾乎所有的超音波儀器中都要用到它。隨著
鈦酸鹽 的開發利用,它愈來愈廣泛地用來製造非線性元件、介質放大器、電子計算機記憶元件、微型電容器、
電鍍 材料、航空材料、強磁、半導體材料、光學儀器、試劑等。
鈦、鈦合金及鈦化合物的優良性能促使人類迫切需要它們。然而,生產成本之高,使套用受到限制。我們相信在不久的將來,隨著鈦的冶煉技術不斷改進和提高,鈦、鈦合金及鈦的化合物的套用將會得到更大的發展。
鈦產品:
鈦及鈦合金是極其重要的輕質結構材料,在航空、航天、車輛工程、
生物醫學工程 等領域具有非常重要的套用價值和廣闊的套用前景。
類型:碘化鈦,
工業純鈦 , α 型鈦, β 型鈦, α +β型鈦
十大性能 密度小,比強度高
金屬鈦的密度為4.51g/立方厘米,高於鋁而低於鋼、銅、鎳,但比強度位於金屬之首。
耐腐蝕性能 鈦是一種非常活潑的金屬,其平衡電位很低,在介質中的熱力學腐蝕傾向大。但實際上鈦在許多介質中很穩定,如鈦在氧化性、中性和弱還原性等介質中是耐腐蝕的。這是因為鈦和氧有很大的親和力,在空氣中或含氧的介質中,鈦表面生成一層緻密的、附著力強、惰性大的氧化膜,保護了鈦
基體 不被腐蝕。即使由於
機械磨損 也會很快自愈或重新再生。這表明了鈦是具有強烈鈍化傾向的金屬。介質溫度在315℃以下鈦的氧化膜始終保持這一特性。
為了提高鈦的耐蝕性,研究出氧化、電鍍、等離子噴塗、離子氮化、離子注入和雷射處理等
表面處理 技術,對鈦的氧化膜起到了增強保護性作用,獲得了所希望的耐腐蝕效果。針對在硫酸、鹽酸、甲胺溶液、高溫濕氯氣和高溫氯化物等生產中對金屬材料的需要 ,開發出鈦-鉬、鈦-鈀、鈦-鉬-鎳等一系列耐蝕鈦合金。鈦
鑄件 使用了鈦-32
鉬合金 ,對常發生縫隙腐蝕或點蝕的環境使用了鈦-0.3鉬-0.8鎳合金或
鈦設備 的局部使用了鈦-0.2
鈀合金 ,均獲得了很好的使用效果。
耐熱性能好 新型鈦合金可在600℃或更高的溫度下長期使用。
耐低溫性能好 鈦合金TA7(Ti-5Al-2.5Sn),TC4(Ti-6Al-4V)和Ti-2.5Zr-1.5Mo等為代表的
低溫鈦合金 ,其強度隨溫度的降低而提高,但塑性變化卻不大。在-196-253℃低溫下保持較好的延性及韌性,避免了金屬冷脆性,是低溫容器,貯箱等設備的理想材料。
抗阻尼性能強 金屬鈦受到
機械振動 、電振動後,與鋼、銅金屬相比,其自身振動衰減時間最長。利用鈦的這一性能可作音叉、醫學上的超聲粉碎機振動元件和高級音響揚聲器的振動薄膜等。
無磁性、無毒 鈦是無磁性金屬,在很大的磁場中也不會被磁化,無毒且與人體組織及血液有好的相溶性,所以被醫療界採用。
抗拉強度與其屈服強度接近
鈦的這一性能說明了其屈強比(抗拉強度/屈服強度)高,表示了金屬鈦材料在成形時塑性變形差。由於鈦的屈服極限與
彈性模量 的比值大,使鈦成型時的回彈能力大。
換熱性能好 金屬鈦的導熱係數雖然比碳鋼和銅低,但由於鈦優異的耐腐蝕性能,所以壁厚可以大大減薄,而且表面與蒸汽的換熱方式為滴狀冷凝,減少了熱組,鈦表面不結垢也可減少熱阻,使鈦的換熱性能顯著提高。
彈性模量低 鈦的彈性模量在常溫時為106.4GPa,為鋼的57%。
吸氣性能 鈦是一種化學性質非常活潑的金屬,在高溫下可與許多元素和化合物發生反應。鈦吸氣主要指高溫下與碳、氫、氮、氧發生反應。
鈦的用途 鈦柱 鈦 是一種化學元素,化學符號Ti,原子序數22,是一種銀白色的
過渡金屬 ,其特徵為重量輕、強度高、具金屬光澤,亦有良好的抗腐蝕能力(包括海水、
王水 及
氯氣 )。由於其穩定的化學性質,良好的耐高溫、耐低溫、抗強酸、抗強鹼,以及高強度、低密度,被美譽為“太空金屬”[2]。鈦於1791年由
格雷戈爾 (William Gregor)於英國
康沃爾郡 發現,並由
克拉普羅特 (Martin Heinrich Klaproth)用希臘神話的
泰坦 為其命名。
鈦被認為是一種稀有金屬,這是由於在自然界中其存在分散並難於提取。但其相對豐度在所有元素中居第十位。[3]鈦的礦石主要有
鈦鐵礦 及
金紅石 ,廣布於地殼及
岩石圈 之中。鈦亦同時存在於幾乎所有生物、岩石、水體及土壤中[4]。從主要礦石中萃取出鈦需要用到克羅爾法[5]或亨特法。鈦最常見的化合物,
二氧化鈦 可用於製造白色顏料[6]。其他化合物還包括
四氯化鈦 (TiCl
4 )(作催化劑及用於製造
煙幕 或空中文字)及
三氯化鈦 (TiCl
3 )(用於催化
聚丙烯 的生產)[4]。
鈦能與
鐵 、
鋁 、
釩 或
鉬 等其他元素熔成合金,造出高強度的輕合金,在各方面有著廣泛的套用,包括航天(
噴氣發動機 、飛彈及
太空飛行器 )、軍事、工業程式(化工與石油製品、
海水淡化 及造紙)、汽車、農產食品、醫學(義肢、骨科移植及牙科器械與填充物)、廚房用具 運動用品、珠寶及手機等等。[4]。
鈦最有用的兩個特性是,抗腐蝕性,及金屬中最高的強度-重量比[7]。在非合金的狀態下,鈦的強度跟某些鋼相若,但卻還要輕45%[8]。有兩種
同素異形體 [9]和五種天然的
同位素 ,分別為:
46 Ti(8.25%)、
47 Ti(7.44%)、
48 Ti(73.72%)
49 Ti(5.41%)
50 Ti(5.18%)。鈦的化學性質及物理性質和
鋯 相似,這是因為兩者的
價電子 數目相同,並於
元素周期表 中同屬一族。
在地殼中,鈦的儲量僅次於鐵、鋁、鎂,居第四位。由於鈦具有熔點高、比重小、比強度高、韌性好、抗疲勞、耐腐蝕、導熱係數低、高低溫度耐受性能好、在急冷急熱條件下應力小等特點,其商業價值在二十世紀五十年代開始被人們認識,被套用於航空、航天等高科技領域。隨著不斷向化工、石油、電力、海水淡化、建築、日常生活用品等行業推廣,鈦金屬日益被人們重視,被譽為“現代金屬”和“戰略金屬”,是提高國防裝備水平不可或缺的重要戰略物資。
衡量一個國家鈦工業規模有兩個重要指標:海綿鈦產量和鈦材產量,其中海綿鈦產量反映原料生產能力,鈦材產量反映的是深加工能力。鈦工業已形成中國、美國、獨立國協、日本和歐洲五大生產和消費主體。
中國鈦工業於1954年起步,經過試驗研究、工業化生產的定點布局、套用推廣和不斷的技術進步逐步發展起來。特別是21世紀以來,在國家需求的拉動下,在改革開放政策的推動下,中國鈦工業更是突飛猛進。
2011年是我國“十二五”規劃的第一年,在這一年裡,我國海綿鈦和鈦加工材的產量繼續慣性增長。根據中國有色金屬工業協會鈦鋯鉿分會統計,國內14家海綿鈦生產企業2011年總產量為64952t,同比增加了12.4%。根據30家企業的統計,2011年中國共生產鈦加工材50962t,同比增長33.0%。
鈦的強度大,純鈦抗拉強度最高可達180kg/mm2。有些鋼的強度高於
鈦合金 ,但鈦合金的比強度(抗拉強度和密度之比)卻超過優質鋼。鈦合金有好的耐熱強度、低溫韌性和斷裂韌性,故多用作飛機發動機零件和火箭、飛彈結構件。鈦合金還可作燃料和氧化劑的儲箱以及高壓容器。已有用鈦合金製造自動步槍,迫擊炮座板及無后座力炮的發射管。在石油工業上主要作各種容器、反應器、熱交換器、
蒸餾塔 、管道、泵和閥等。鈦可用作電極和發電站的
冷凝器 以及環境污染控制裝置。鈦鎳
形狀記憶合金 在儀器儀表上已廣泛套用。在醫療中,鈦可作人造骨頭和各種器具。鈦還是煉鋼的脫氧劑和不鏽鋼以及
合金鋼 的組元。
鈦白粉 是顏料和油漆的良好原料。碳化鈦,氫化鈦是新型硬質合金材料。氮化鈦顏色近於黃金,在裝飾方面套用廣泛。
鈦和鈦的合金大量用於航空工業,有"空間金屬"之稱;另外,在造船工業、化學工業、製造機械部件、電訊器材、硬質合金等方面有著日益廣泛的套用。
此外,由於鈦合金還與人體有很好的相容性,所以鈦合金還可以作人造骨。
鈦的抗腐蝕性
鋯 是一種套用於
原子能 工業和在高溫高壓下用作耐蝕
化工材料 ,但在溶液中其活潑性僅次於鈉。
硝酸鋯與氫氧化鈦 那么,在氫氧化鈦溶液里加入活潑的
硝酸鋯 溶液,會發現鈦把硝酸鋯拒之門外(如圖)。
可以看到,圖中有明顯的分層,上面是硝酸鋯,下面是氫氧化鈦。
我們知道,氫氧化鈦的密度小於硝酸鋯,但依然能保持明顯的分層,並把硝酸鋯停留在上層,這證明了鈦的抗腐蝕性。
根據實驗,鈦放入海底20~50年均不會被腐蝕。
應急處置 皮膚接觸:脫去污染的衣著,用肥皂水和清水徹底沖洗皮膚。
眼睛接觸(粉末):提起眼瞼,用流動清水或生理鹽水沖洗。就醫。
吸入(粉末):迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
食入:飲足量溫水,催吐。就醫。
呼吸系統防護:可能接觸其粉塵時,必須佩戴自吸過濾式防塵口罩。
身體防護:穿透氣型防毒服。
手防護:戴防毒物滲透手套。
其他防護:工作現場禁止吸菸、進食和飲水。工作完畢,淋浴更衣。注意個人清潔衛生。
泄漏應急處理 :隔離泄漏污染區,限制出入。切斷火源。建議應急處理人員戴防塵面具(全面罩),穿防毒服。不要直接接觸泄漏物。小量泄漏:避免揚塵,用潔淨的鏟子收集於乾燥、潔淨、有蓋的容器中。轉移回收。大量泄漏:用塑膠布、帆布覆蓋。使用無火花工具轉移回收。
滅火方法:採用乾粉、乾砂滅火。嚴禁用水、泡沫、二氧化碳撲救。高熱或劇烈燃燒時,用水撲救可能會引起爆炸。
·管理信息庫
操作的管理:密閉操作,局部排風。操作人員必須經過專門培訓,嚴格遵守操作規程。建議操作人員佩戴自吸過濾式防塵口罩,戴安全防護眼鏡,穿透氣型防毒服,戴防毒物滲透手套。遠離火種、熱源,工作場所嚴禁吸菸。使用防爆型的通風系統和設備。避免產生粉塵。避免與氧化劑、酸類、鹵素接觸。在氬氣中操作處置。搬運時要輕裝輕卸,防止包裝及容器損壞。配備相應品種和數量的消防器材及泄漏應急處理設備。倒空的容器可能殘留有害物。
儲存的管理:為安全起見,儲存時常以不少於25%的水潤濕、
鈍化 。儲存於陰涼、通風的庫房。遠離火種、熱源。庫溫不超過30℃,相對濕度不超過80%。保持容器密封,嚴禁與空氣接觸。應與氧化劑、酸類、鹵素等分開存放,切忌混儲。配備相應品種和數量的消防器材。儲區應備有合適的材料收容泄漏物。
運輸的管理:運輸時運輸車輛應配備相應品種和數量的消防器材及泄漏應急處理設備。裝運該品的車輛排氣管須有阻火裝置。運輸過程中要確保容器不泄漏、不倒塌、不墜落、不損壞。嚴禁與氧化劑、酸類、鹵素、食用化學品等混裝混運。運輸途中應防曝曬、雨淋,防高溫。中途停留時應遠離火種、熱源。車輛運輸完畢應進行徹底清掃。鐵路運輸時要禁止溜放。
廢棄的管理:恢復材料的原狀態,以便重新使用。
·毒理學資料庫
急性毒性:金屬鈦、二氧化鈦和碳化鈦屬低毒類。大鼠一次氣管內注入20-50mg二氧化鈦和兔注入400 mg後肺部無特異反應。
亞急性和慢性毒性:大鼠氣管內注入
氫化鈦 後6和12個月,只見肺纖維化效應。大鼠吸入二氧化鈦塵每天4次,每周5 d,歷時13個月,停止吸入後7個月,肺無任何病理反應;但豚鼠反覆吸入二氧化鈦觀察到纖維化效應和嗜酸性自細胞浸潤。氣管內注入金屬鈦無肺纖維化發生。大鼠氣管內一次注入氫化鈦、碳化鈦、硼化鈦和一氮化鈦後觀察到肺部輕度纖維化。大鼠吸入氫化鈦16個月亦見輕度纖維化。
代謝:人體一般飲食中每日約攝入300μg鈦,大部分從糞排出,其中約3%吸收入血液。進入體內的鈦蓄積於脾、腎上腺、橫紋肌、肺、皮膚及肝臟等部位。吸收入體內的鈦主要由尿排出。正常人血漿中鈦濃度約3μg/dl,尿鈦濃度為10μg/L左右。
中毒機理:金屬鈦,氧化鈦,碳化鈦(titanium carbonide)等不溶性鈦毒性低,口服吸收量少,不顯示毒性反應。金屬鈦植入機體未見有病理反應。吸入鈦的不溶性化合物,未見肺部有嚴重損害,其致纖維化作用甚微。用含鈦飲水長期飼養動物未見對生長發育有影響,也未見
腫瘤發生 。
致癌性:大鼠肌肉注射溶於三辛素的鈦金屬粉,引起纖維肉瘤和淋巴肉瘤增加。注射有機鈦,注射部位出現纖維肉瘤,發生肝細胞瘤和脾的惡性淋巴瘤。鈦塊沒有致癌性,給病人安裝鈦制人造關節兩周後,未出現腫瘤細胞。
燃爆危險:該品可燃,具刺激性。
·應急醫療庫
主要用途及接觸機會:鈦用於製造
特種鋼 、合金、鈦陶瓷及
玻璃纖維 。金屬鈦也用於飛機、飛彈製造及原子反應堆。還用於生產耐火材料、焊條、建築材料和塑膠等。上述工業中可接觸金屬鈦,二氧化鈦的粉塵和煙塵。四氯化鈦及其部分水解物,還常夾雜氯及其氧化物。在
機械處理 金屬鈦過程中也接觸鈦氧化物的煙塵。
侵入途徑:吸入、食入。
人體危害:吸入後對上呼吸道有刺激性,引起咳嗽、胸部緊束感或疼痛。長期吸入TiO
2 粉塵的工人,肺部無任何變化。在生產鈦金屬過程,接觸四氯化鈦及其水解產物對眼和上呼吸道黏膜有刺激作用。長期作用可形成
慢性支氣管炎 。TiO2曾用作閃光灼傷的皮膚防護劑,未見產生接觸性皮炎、變態反應和經皮吸收。100℃氯氮化鈦的飛濺和吸入鈦酸及氯氮化鈦煙引起皮膚燒傷並致疤痕形成和咽、聲帶、氣管黏膜充血,由於形成瘢痕引起喉狹窄。眼短期接觸氯氮化鈦引起結膜炎和角膜炎。此外,四氯化鈦吸入可引起彌散性支氣管內息肉。
處理原則:皮膚接觸四氯化鈦後應儘快用軟紙或布擦掉,然後用水沖洗,防止四氯化鈦遇水放出大量熱及鹽酸,加重及擴大灼傷範圍。吸入四氯化鈦應立即霧化吸入5%
碳酸氫鈉 溶液,以中和四氯化鈦水解產生的鹽酸;吸氧、保持呼吸進通暢.安靜休息,減少氧的消耗;早期給予足量糖皮質激素,並給抗生素預防繼發感染及抗支氣管痙攣藥物、祛痰藥對症治療。嚴密觀察,防治肺水腫。
預防措施:接觸四氯化鈦及其水解產物的工種,應注意皮膚、黏膜和呼吸道的防護。產生鈦及其化合物粉塵的工作地點,亦須加強防塵措施。大量微小鈦粉塵可著火爆炸,因此鈦的生產、澆鑄、加工應有良好通風防塵設施,及應有防火防爆設備。四氯化鈦生產過程應儘量密閉,防止其煙氣逸出及“跑、冒、滴、漏”。加強個人防護,四氯化鈦生產設備開蓋、清洗、維修時應截防毒面其、防護眼鏡。穿防酸防護衣帽。定期對接觸四氯化鈦的生產工人進行休檢,有慢性呼吸道疾病患者不能從事接觸四氯化鈦的工作。
超高純鈦 2014年9月,中國第一爐“電子級低氧超高純鈦”已在浙江省餘姚市成功研發投產,一舉打破了國外的壟斷。低氧超高純鈦主要套用在半導體用濺射靶材、航空航天、海洋石油等核心工業領域,戰略意義重大。特別值得一提的是,超高純鈦是中國自主大飛機項目的重要原材料保證。
在此之前,從國外進口的超高純鈦價格為120萬元/噸左右,受到提純工藝技術限制,全世界只有美國和日本的三家公司能夠生產超高純鈦。作為高端戰略性金屬材料,美日政府嚴格限制對中國的出口。中國在超高純鈦領域經常要看美日的“臉色”。
寧波創潤新材料有限公司"年產250噸電子級低氧超高純鈦項目"的投產,填補了中國高端鈦材的技術空白,意味著中國已具備低氧超高純鈦的自主生產能力,實現了這一戰略金屬的獨立自給,徹底擺脫了對國外的依賴。壟斷打破後,直接受益的就是航空航天領域。
中國鈦谷 據芒鈦了解寶雞鈦材加工裝備、技術水平及生產能力均居全國第一,生產能力占全國的60%左右,市場份額占國內鈦加工材市場85%,占世界產量的22%,承擔著中國90%以上高端鈦材產品的生產任務,號稱中國鈦谷。
鈦產能過剩 我國鈦工業在這10多年的高速發展過程中,嚴重失控,許多地方在地方保護主義的“轟轟烈烈”搶灘中發展鈦項目,致使鈦市場嚴重供大於求,儘管鈦及鈦材使用量連年遞增,但也改變不了實際產能遠遠大於需求的現狀。比如,2012年儘管鈦材總量6萬噸以上比上年明顯增長,但鈦錠出口大幅增加,寶鋼、寶鈦等多家鈦材加工企業鈦錠庫存總量累計在5000噸以上,另外國家還收儲了4000噸鈦錠。由此可見,國內鈦材產量大幅增長,需求並沒有同步增長,相反,可以看出國外鈦工業發展是比較理性的,不像國內發展在失控中“高歌猛進”。
2012年,經濟開始出現復甦,我國鈦工業市場依然低迷不振,但我們千萬不要去責怪這是金融危機、歐債危機導致的,而要在自身失控的發展中找原因,不然,各種經濟危機結束了,我國鈦工業各地拚命上項目的發展危機依然存在。縱觀我國10多年鈦工業的發展路線,看到的是這樣一個伴隨陣痛的輪迴:第一次擴產→第一次洗牌→第二次擴產→第二次洗牌……我國鈦工業從上世紀六十年代發展到2004年,不管是鈦及鈦材加工產能都很小,比如2000年末我國的
海綿鈦 產量2000噸,但隨著2004年末期鈦需求量逐步增加,到2005年海綿鈦價格已從5、6萬元1噸漲到20萬~30萬元1噸,開始出現有價無市的暴利現象,鈦領域悄然之中出現第一次大規模擴張,短短几年產能很快翻了60倍以上。擴張,調整,陣痛,整合後的2012年我國海綿鈦實際產量在2000年基礎增加40倍以上。
 格雷戈爾
格雷戈爾 克拉普羅特
克拉普羅特 亨特
亨特
 鈦
鈦 鈦礦石
鈦礦石 銀白色有光澤的金屬鈦
銀白色有光澤的金屬鈦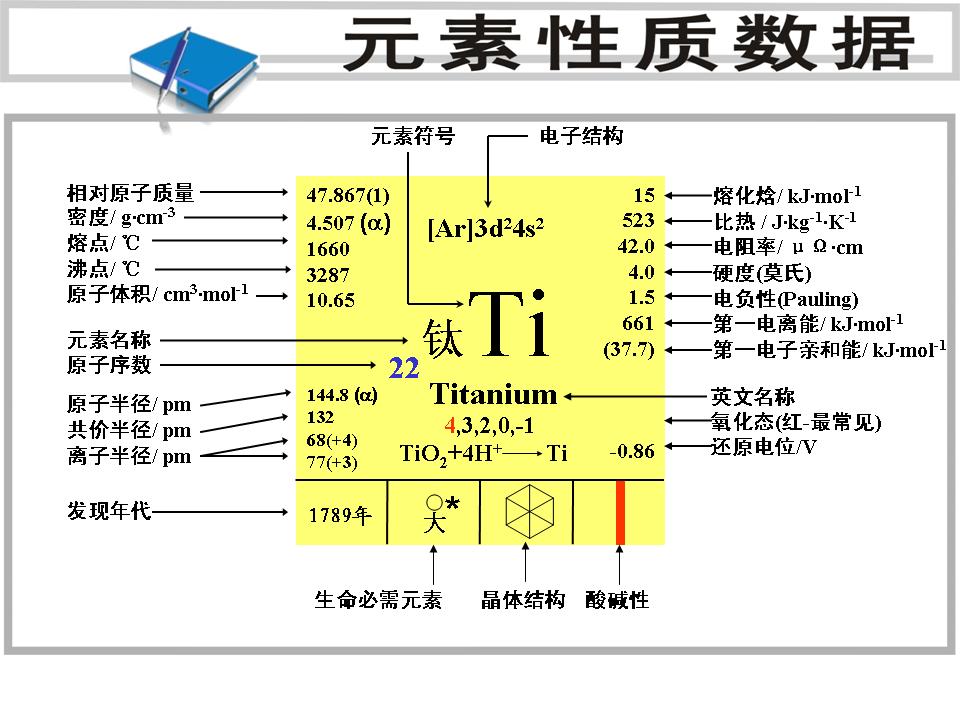




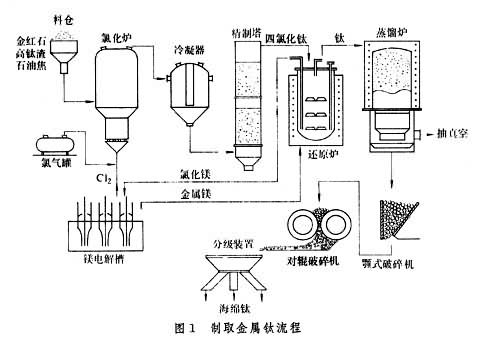 製取鈦流程
製取鈦流程 鈦柱
鈦柱
 硝酸鋯與氫氧化鈦
硝酸鋯與氫氧化鈦