金屬特徵
英文名稱:alkaline-earth metal
鹼土金屬中除鈹外都是典型的
金屬元素,
氧化態為+2,其單質為灰色至銀白色金屬,硬度比
鹼金屬略大,導電、導熱能力好,容易同空氣中的
氧氣、
水蒸氣、二氧化碳作用,在表面形成氧化物和碳酸鹽,失去光澤。鹼土金屬的氧化物熔點較高,氫氧化物顯較強的鹼性(氫氧化鈹顯兩性),其鹽類中除鈹外,皆為離子晶體,但溶解度較小。在自然界中,鹼土金屬都以化合物的形式存在,鈣、鍶、鋇可用
焰色反應鑑別。由於它們的性質很活潑,一般的只能用
電解方法製取。而ⅡA族元素之所以被稱為鹼土金屬,則是因為ⅡA族元素首先同IA族元素都具有較強的活動性,且對應的氫氧化合物的水溶液也呈強鹼性,但是這些氫氧化合物的溶解度一般較小(例:
)或不溶於水(例:
),故稱為鹼土金屬。
元素性質
物理性質
鹼土金屬的
單質為銀白色(鈹為灰色)固體,容易同空氣中的
氧氣作用,在表面形成氧化物,失去光澤而變暗。它們的原子有兩個價電子,形成的
金屬鍵較強,熔、沸點較相應的
鹼金屬要高。單質的
還原性隨著
核電荷數的遞增而增強。
鹼土金屬的硬度大於鹼金屬,鍶、鈣、鋇可用刀子切割,新切出的斷面有銀白色光澤,但在空氣中迅速變暗。其熔點和密度也都大於鹼金屬,但仍屬於
輕金屬。
鹼土金屬的碳酸鹽不溶、硫酸鹽隨著原子序數增加,溶解度逐漸減小。
化學性質
鹼土金屬最外電子層上有兩個
價電子,易失去而呈現+2價,是化學活潑性較強的金屬,能與大多數的
非金屬反應,所生成的鹽多半很穩定,遇熱不易分解,在室溫下也不發生水解反應。它們與其他元素化合時,一般生成離子型的化合物。但Be
2+和Mg
2+離子具有較小的
離子半徑,在一定程度上容易形成
共價鍵的化合物。鈣、鍶、鋇和鐳及其化合物的化學性質,隨著它們原子序數的遞增而有規律地變化。鹼土金屬的離子為無色的,其鹽類大多是白色固體,和
鹼金屬的鹽不同,鹼土金屬的鹽類(如
硫酸鹽、碳酸鹽等)溶解度都比較小。
鹼土金屬(鈹除外)在空氣中加熱時,發生燃燒,產生光耀奪目的火光,形成氧化物(鋇形成過氧化物)。鹼土金屬在高溫火焰中燃燒產生的特徵顏色,可用於這些元素的鑑定。與水作用時(鈹不與水反應),放出氫氣,生成
氫氧化物,鹼性比鹼金屬的氫氧化物弱,但鈣、
鍶、
鋇、
鐳的氫氧化物仍屬
強鹼。鈹表面生成緻密的
氧化膜,在空氣個不易被氧化,跟水也不反應。鎂跟熱水反應,鈣、鍶和鋇易與冷水反應。鈣、鍶和鋇也能與氫氣反應。在空氣中,鎂表面生成一薄層氧化膜,這層氧化物緻密而堅硬,對內部的鎂有保護作用,所以有抗腐蝕性能,可以保存在乾燥的空氣里。鈣、鍶、鋇等更易被氧化,生成的氧化物疏鬆,內部的金屬會繼續被氧化,所以鈣、鍶、鋇等金屬要密封保存。
與
水反應:M(s)+2H
2O(L)——→M(OH)
2(aq)+H
2↑(g)
與酸反應:2H+(aq)+M(s)——→M2+(aq)+H2↑(g)
與不活潑金屬的可溶鹽反應:M(s)+Cu2+(aq)——→M2+(aq)+Cu(s)
元素介紹
鈹
Be原子的
價電子層結構為2s
2,它的原子半徑為89pm,Be
2+離子半徑 為31pm,Be的電負性為1.57。鈹由於原子半徑和離子半徑特別小(不僅小於同族的其它元素,還小於
鹼金屬元素),電負性又相對較高(不僅高於鹼金屬元素,也高於同族其它各元素),所以鈹形成
共價鍵的傾向比較顯著,不像同族其它元素主要形成離子型化合物。因此鈹常表現出不同於同族其它元素的反常性質。
(1)鈹由於表面易形成緻密的保護膜而不與水作用,而同族其它金屬鎂、鈣、鍶、鋇均易與水反應。
(2)氫氧化鈹是兩性的,而同族其它元素的氫氧化物均是中強鹼或強鹼性的。
(3)鈹鹽強烈地
水解生成四面體型的離子[Be(H
2O)
2]
2+,Be-O鍵很強,這就削弱了O-H鍵,因此水合鈹離子有失去
質子的傾向:因此鈹鹽在純水中是酸性的。而同族其它元素(鎂除外)的鹽均沒有
水解作用。
鎂
中文名: 鎂 | 符號: Mg |
序號: 12 | 族: 2族 |
周期: 3 | 元素分區: s |
原子質量: 24.305 | 外觀: 銀白色固體 |
熔點:923 K(650 °C) | 沸點:1363 K(1090 °C) |
鎂是一種輕質有延展性的銀白色金屬。在宇宙中含量第八,在地殼中含量第七。密度1.74克/厘米
3,熔點648.8℃。沸點1107℃。化合價+2,電離能7.646電子伏特,是輕金屬之一,具有展性,能與熱水反應放出氫氣,燃燒時能產生眩目的白光,許多金屬是用熱還原其鹽和氧化物來製備。金屬鎂能與大多數非金屬和差不多所有的酸化合,大多數鹼,以及包括
烴、
醛、
醇、
酚、
胺、
脂、
酯和大多數油類在內的有機化學藥品與鎂僅僅輕微地或者根本不起作用。
鈣
元素
原子量40.08,銀白色的
輕金屬。質軟。密度1.54克/厘米
3。熔點839±2℃。沸點1484℃。化合價+2。
電離能6.113
電子伏特。
化學性質活潑,能與水、酸反應,有氫氣產生。在空氣在其表面會形成一層氧化物和氮化物薄膜,以防止繼續受到腐蝕。加熱時,幾乎能還原所有的
金屬氧化物。
 鈣
鈣鈣元素在自然界分布廣,以化合物的形態存在,如石灰石、
白堊、大理石、石膏、
磷灰石等;也存在於血漿和骨骼中,並參與
凝血和肌肉的收縮過程。金屬鈣可由
電解熔融的氯化鈣而製得;也可用金屬在
真空中還原石灰,再經
蒸餾而獲得。鈣用來作合金的
脫氧劑,以及油類的
脫水劑等。
鍶
元素
原子量87.62,銀白色軟金屬。密度2.6克/厘米
3。熔點769℃。沸點1384℃。化合價+2。第一
電離能5.695
電子伏特。化學性質活潑,於空氣中加熱時能燃燒;易與水和酸作用而放出氫;在到熔點時即燃燒而呈紅色火焰。 1808年,英國的克勞福特和
戴維先後由鉛礦和
鍶礦中發現了鍶。
 鍶
鍶鋇
元素
原子量137.3,銀白色金屬,略具光澤,有延展性。密度3.51克/厘米
3。熔點725℃。沸點1640℃。化合價+2。
電離能5.212
電子伏特。
化學性質相當活潑,能與大多數
非金屬反應,在高溫及氧中燃燒會生成過氧化物BaO
2。易氧化,能與水作用,生成
氫氧化物和氫;溶於酸,生成鹽,鋇鹽除硫酸鋇外都有毒。1808年,英國的戴維,用汞作陰極,
電解由重晶石製得的電解質,蒸去汞,而製得鋇。
 鋇
鋇自然界中有
重晶石和碳酸鋇礦。可由
熔融的
氯化鋇在
氯化銨存在下電解而製得。鋇用於制鋇鹽、合金、焰火等;也是精製煉銅時的優良去氧劑。
鐳
元素
原子量:226,密度6.0克/厘米
3(20℃)。熔點700℃,沸點約1140℃。銀白色有光澤的軟金屬。在空氣中不穩定,易與空氣中氮和氧化合。與水作用放出氫氣,生成
氫氧化鐳Ra(OH)
2。溶於稀酸。化學性質與鋇十分相似;所有鐳鹽與相應的鋇鹽是同晶型的。鐳能生成僅微溶於水的
硫酸鹽、碳酸鹽、
鉻酸鹽、
碘酸鹽;
鐳的氯化物、
溴化物、
氫氧化物溶於水。已知鐳有13種同位素,226Ra半衰期最長,為1622年。
 鐳
鐳1898年,由
瑪麗·居里(Marie Curie)和皮爾·居里(Pierre Curie)發現。1910年,
居里夫人和德
比恩電解純的
氯化鐳溶液,用汞作
陰極,先得鐳汞齊,然後蒸餾去汞,獲得金屬鐳。鐳存在於多種礦石和礦泉中,但含量極稀少,較多的來源於
瀝青鈾礦中。在處理瀝青鈾礦提取鈾時,鐳經常與鋇一起在不溶於酸的殘渣中以硫酸鹽形式回收,提純獲得。鐳能放射出α和γ兩種射線,並生成放射性氣體
氡。鐳放出的射線能破壞、殺死細胞和細菌。因此,常用來治療癌症等。此外,鐳鹽與鈹粉的混合製劑,可作中子放射源,用來探測
石油資源、岩石組成等。
化合物
氧化物
1、氧化物
鹼土金屬在室溫或加熱時與氧化合,主要生成普通氧化物MO(鋇生成過氧化鋇):
2M+O2=2MO
但實際生產中常由它們的碳酸鹽、硝酸鹽或
氫氧化物等加熱分解來製備。例如
MCO3=MO+CO2↑
鹼土金屬的氧化物均是難溶於水的白色粉末。除Be0為
ZnS型晶體外,其餘MO都是
NaCl型晶體。由於陰、陽離子都是帶有兩個單位電荷,而且
M-O核間距又較小,所以鹼土金屬氧化物具有較大的
晶格能,因此它們的熔點都很高、硬度也較大。BeO和
MgO常用來製造耐火材料和金屬陶瓷。特別是BeO,還具有反射
放射性射線的能力,常用作原子反應堆外壁磚塊材料。
生石灰是重要的建築材料,也可由它製得價格便宜的鹼(
熟石灰)。
過氧化物是含有過氧基(-O-O-)的化合物,除鈹外,鹼土金屬在一定條件下都能形成過氧化物。
鈣、鍶、鋇的氧化物與
過氧化氫作用,可得到相應的過氧化物:
MO+H2O2+7H2O=MO2·8H2O
鋇燃燒可生成過氧化物
Ba+O2=點燃=BaO2
氫氧化物
鹼土金屬的氧化物(BeO和MgO除外)與水作用,即可得到相應的
氫氧化物。鹼土金屬的氫氧化物均為白色固體,易
潮解,在空氣中吸收CO
2生成碳酸鹽。
鹼土金屬氫氧化物溶解度依次增大的原因是隨著金屬
離子半徑的遞增,正、負離子之間的作用力逐漸減小,易被水分子所解離的緣故。
在鹼土金屬的
氫氧化物中,Be(OH)
2呈兩性,Mg(OH)
2為
中強鹼,其餘都是強鹼。
鹽類
常見鹼土金屬的鹽類有鹵化物、
硝酸鹽、
硫酸鹽、碳酸鹽、磷酸鹽等,里著重介紹它們的共同特性。
1、晶體類型
絕大多數鹼土金屬鹽類的晶體屬於離子型晶體,它們具有較高的熔點和沸點。
常溫下是固體,熔化時能導電。鹼土金屬氯化物的熔點從Be→Ba依次增高,
BeCl2熔點最低,易於升華,能溶於
有機溶劑中,是共價化合物,MgCl
2也有一定程度的共價性。
鹼土金屬離子(M2+)都是無色的,它們鹽類的顏色一般取決於陰離子的顏色。無色陰離子(X-、NO3-、SO4-、CO32-、ClO-等),與之形成的鹽一般是無色或白色的;有色明離子(MnO4-、CrO42-、Cr2O72-等),與之形成的鹽則具有陰離子的顏色,例如,黃色的BaCrO4等。
鹼土金屬的鹽比相應的
鹼金屬鹽溶解度小,有不少是難溶解的,這是區別鹼金屬的特點之一。鹼土金屬的硝酸鹽、
氯酸鹽、高氯酸鹽和醋酸鹽等
易溶。鹵化物中除氟化物外,也是可溶的。但是碳酸鹽,磷酸鹽和
草酸鹽等都難溶於水。對於
硫酸鹽和鉻酸鹽來說,溶解度差別較大,例如:BeSO
4、MgSO
4、BeCrO
4和MgCrO
4易溶,其餘全難溶(CaSO
4微溶)。尤其BaSO
4和BaCrO
4是溶解度最小的難溶鹽之一。CaC
2O
4(白色)、SrCrO
4(白色)和BaCrO
4(黃色)的溶解度也很小,反應又很靈敏,可用作Ca
2+、Sr
2+或Ba
2+離子的鑑定。鈹鹽有許多是易溶於水的,這與Be
2+的半徑小,電荷較多,水合能大有關。
在自然界中,鹼土金屬的礦石常以
硫酸鹽、碳酸鹽的形式存在,例如
白雲石CaCO
3·MgCO
3,
方解石(大理石)CaCO
3、
天青石SrSO
4、
重晶石BaSO
4等等。
熱穩定性
鹼土金屬鹽的熱穩定性較
鹼金屬的差,但常溫下也都是穩定的(除BeCO
3外)。鹼土金屬的碳酸鹽在強熱的情況下,才能分解成相應的氧化物MO和CO
2,碳酸鹽的熱穩定性依Be→Ba的順序遞增,因為按此順序
離子極化力減弱。
發現過程
人們對石灰的利用雖然很早,但它的組成是什麼卻知道得相當遲。至於苦土(
氧化鎂)、鍶土(
氧化鍶)、重土(
氧化鋇)的組成更不知道了。由於當時沒有辦法使它們分解,證明它們是化合物,這種狀況一直到18世紀,大多數化學家都認為它們都是元素。那時只有化學家
拉瓦錫不以為然,他說:“我們現在所認識的金屬,大概只是自然界中所有金屬的一部分,例如,凡對氧的
親合力較碳更大的金屬,因為都不易還原成金屬狀態,所以我們只能找到它們的氧化物。我們已往所認為是土質的重土,十之八九大概是一種氧化物,它所表現出來的性質與
金屬氧化物十分接近。嚴格說來,我們現在稱為土質的物質,恐怕都是我們現在的方法尚不能還原的金屬氧化物。”
戴維同意拉瓦錫的看法,並提出了獨特的預見:“如果化學結合具有我曾經大膽構想過的那種特性,不管物體中的元素的天然電力(
結合力)有多么強,但總不能沒有限度,且我們人造的儀器的力量似乎是能夠無限地增大,希望新的方法(指
電解)能夠使我們發現物體中真正的元素。”戴維在拉瓦錫的啟發下,決心在製得鈉和鉀的基礎上,採用新的、強有力的電解方法來製取土質中所含的金屬。
1807年,戴維電解KOH得到金屬K(Potassium),用同樣的方法從NaOH中得到金屬Na(Sodium);1808年,戴維把潮濕的石灰和
氧化汞按3:1的比例混合,放在白金皿中進行電解得到了鈣汞齊,並製得了鈣;後來又從菱鍶礦石(SrCO
3)、
重晶石(BaSO
4)和苦土(MgO)中到得了三個新的金屬元素單質——鍶、鋇(Barium)和鎂;鈹(Beryllium)是1845年德國化學家
維勒用他
電解發現鋁的方法製得的。鐳是由
瑪麗·居里(M. Curie)和
皮埃爾·居里(P. Curie)在
瀝青礦中發現的。
製備套用
存在形式
鹼土金屬除鐳外在自然界中分布也很廣泛,鎂除
光鹵石外,還有
白雲石CaCO
3·MgCO
3和
菱鎂礦MgCO
3等;鈹的最重要礦物是
綠柱石3BeO·Al
2O
3·6SiO
2。鈣、鍶、鋇在自然界中存在的主要形式為難溶的碳酸鹽和
硫酸鹽,如
螢石CaF
2、石灰石CaCO
3、
碳酸鍶礦SrCO
3、
碳酸鋇礦、石膏CaSO
4·2H
2O、
天青石SrSO
4和
重晶石BaSO
4等。海水中含有大量鎂的
氯化物和硫酸鹽,1971年世界鎂產量有一半以上是以海水為原料生產的。
 光鹵石
光鹵石製備方法
鈹通常是用金屬鎂在大約1300℃下還原BeF
2來製取的,也可以用
電解熔融BeCl
2(加入
鹼金屬氯化物作
助熔劑)的方法製得。鎂是所有這族金屬中生產規模最大的金屬,世界年產量在幾十萬噸以上。電解法和矽熱還原法是工業上生產鎂的主要方法。電解法是在750℃的溫度下,通過電解熔融的
MgCl2而獲得鎂。矽熱還原法則是在減壓和1150℃的溫度下,用
矽鐵與煅燒過的白雲石進行反應而製得鎂:
2(MgO·CaO)+FeSi==2Mg+Ca2SiO4+Fe
鈣、鍶、鋇都可以用其
氯化物進行
熔鹽電解製得,鍶和鋇還可以用金屬鋁在高溫和真空條件下還原其氧化物製得。
用途作用
鹼土金屬有著廣泛的用途。鈹具有透過
X射線的能力,常用作X光管的透射材料和製造
霓虹燈的元件。鈹也用作原於反應推的減速劉,鈹青銅合合的抗拉強度很大,比鋼大9倍,而彈性似彈簧鋼,被稱為“超硬合金”,其機械性能優良,硬度大,彈性好,抗腐蝕能力強,常用於製造氣閥座、手錶遊絲、高速軸承、耐磨齒輪及精密儀器的零件等。鈹-鎂-鈷合金輕而堅硬,常用於航空航天工業中。鈹及其化合物有毒,能導致嚴重的肺病和皮膚炎。
鎂離子在機體中的生化作用是十分重要的。鎂能激活人體中的不少
生物酶,對蛋白質的合成起重要作用。鎂是構成葉綠素的重要成分。鎂還具有鎮靜作用,在血液中注射鎂鹽可以引起麻醉。在工業中,鎂主要用於制強度高、密度小的合金,廣泛用於汽車、飛機製造業中。
鈣是構成人和動物骨骼的主要成分,在傳遞神經脈衝、觸發肌肉收縮和激素釋放、血液的凝結以及正常心律調節中,Ca
2+都起著重要的作期。鈣鹽是人休必需的無機鹽。人體每天要補充400~1500mg的鈣。如果人體缺鈣就會導致
佝僂病及骨質硫松症。鈣主要來源於牛奶、乾酪及綠葉蔬菜。
檢驗
鹼土金屬離子在高溫火焰中燃燒產生的特徵顏色見表。這種特性可用於這些元素的鑑定
數據取自《無機化學(第五版)》,2008.380
| 鈹 | 鎂 | 鈣 | 鍶 | 鋇 | 鐳 |
顏色 | — | — | 橙紅 | 深紅 | 綠 | — |
波長/nm | — | — | 714.9 | 687.8 | 553.5 | — |

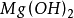
 鍶
鍶 鋇
鋇 鐳
鐳 光鹵石
光鹵石

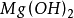
 鍶
鍶 鋇
鋇 鐳
鐳 光鹵石
光鹵石