發現歷史,物理、化學特性,物理性質,化學性質,分類,自然鉑,海綿鉑,高純海綿鉑,超細鉑粉,鉑銥合金,鉑銀合金,鉑鉬合金,鉑錸合金,鉑鈷合金,鉑銅合金,鉑鎳合金,鉑釕合金,鉑鋨合金,製備,用途說明,分布,輔助資料,
發現歷史
18世紀初英國C.伍德在新格拉納達的卡塔赫納採集到嵌有鉑粒的砂石。
1735年西班牙烏略亞-德拉·托雷·希拉爾在平託附近的
金礦發現一塊難以加工的金屬,很像銀,便取名為platinum,該字來自西班牙文platina,含義是銀。
1748年英國沃森確認這是一種新元素。鉑在地殼中的含量為 5×10-7%, 常與其他鉑系元素一起分散在沖積礦床和砂積礦床的多種礦物(如原鉑礦、硫化鎳銅礦、磁鐵礦等)中。獨立礦物有
砷鉑礦、硫鉑礦、銻鉑礦、硫
鉑鈀礦、硫鎳鈀鉑礦等。還有以游離狀態存在的
自然鉑。
100 多年前曾有過一種作為光源的
鉑絲酒精燈,它的原理和用法你可能不知道吧?
那是在1820 年,英國化學家
戴維做了這樣一個實驗:先用酒精把鉑絲潤濕,然後點燃。他發現,這時酒精燃燒得特別劇烈,能使鉑絲溫度達到熾熱程度,發出很亮的光來。於是,戴維做了一種鉑絲酒精燈,用它來照明。這燈在歐洲風行了許多年。
鉑絲之所以熾熱,是因為鉑可以對酒精氧化起催化作用,使它在自己表面燃燒得更激烈。人們利用鉑的這種性質,還製成了一種玩具
打火機:它是在酒精容器的蓋子裡,裝上一支細鉑絲。只要打開瓶蓋並把鉑絲放在瓶口,酒精就在鉑絲表面與
氧氣反應。稍過一會兒,反應所放的熱就把酒精蒸氣點燃了,從而成為一種不點自燃的“自來火”。
於是有人設計了一種金屬做的、扁平圓滑可以揣到懷裡的爐子。這爐子裡既不裝紅煤球也不燒炭,裝的只有酒精和鉑,酒精靠人體的體溫緩緩揮發,酒精蒸氣在通過附有鉑粉的石棉時發生氧化而發熱,使人們達到取暖的目的。人們把它稱為“鉑懷爐”。
現在許多技術發達的國家已把它改制成了“無焰燃燒器”。他們把丙烷(石油液化氣)以0.01―1 大氣壓的壓力通入一個螢光吊燈樣的裝置,在裝置的鉑絲上,丙烷跟空氣相接觸而氧化放熱(沒發生火焰)。由於它能靜悄悄地供暖而不產生煤氣,所以成為雞舍中的理想熱源。
物理、化學特性
物理性質
鉑是銀白色有光澤的金屬,熔點1772℃,沸點 3827 ±100℃,密度21.45克/厘米3( 20℃),較軟,有良好的延展性、導熱性和
導電性。海綿鉑為灰色海綿狀物質,有很大的比表面積,對氣體(特別是氫、氧和一氧化碳)有較強的吸收能力。粉末狀的鉑黑能吸收大量氫氣。鉑的化學性質不活潑,在空氣和潮濕環境中穩定,低於 450℃加熱時,表面形成二
氧化鉑薄膜,高溫下能與硫、磷、鹵素髮生反應。鉑不溶於鹽酸、硫酸、
硝酸和鹼溶液,但可溶於王水和熔融的鹼。鉑的氧化態為+2、+3、+4、+5、+6。容易形成
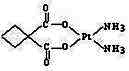
配位化合物,如〔Pt(NH3)2〕Cl2、K〔Pt(NH3)Cl5〕。
 鉑
鉑元素名稱 | 鉑 |
符號 | Pt |
CAS號 | 7440-06-4 |
原子量 | 195.1 |
原子體積 | 9.10(立方厘米/摩爾) |
元素在太陽中的含量(ppm) | 0.009 |
地殼中含量(ppm) | 0.001 |
元素在海水中的含量(ppm) | 太平洋表面 0.00000011 |
| 4--4.5 |
| 2800(m/S) |
氧化態 | Main Pt+4
Other Pt0,Pt+2,Pt+5,Pt+6 |
外圍電子層排布 | 5d9 6s1 |
電子層 | K-L-M-N-O-P |
M - M+ 870
M+ - M2+ 1791
M2+ - M3+ 2800
M3+ - M4+ 3900
M4+ - M5+ 5300
M5+ - M6+ 7200
 鉑
鉑M6+ - M7+ 8900
M7+ - M8+ 10500
M8+ - M9+ 12300
M9+ - M10+ 14100
晶體結構:等軸晶系,
晶胞為面心立方晶胞,每個晶胞含有4個金屬原子。
a | 392.42 pm |
b | 392.42 pm |
c | 392.42 pm |
α | 90° |
β | 90° |
γ | 90° |
鉑是一種
過渡金屬,密度大,可延展,色澤銀白,金屬光澤,硬度4-4.5,相對密度為21.45。熔點高為1773℃。富延展性,可拉成很細的鉑絲,軋成極薄的鉑箔。
化學性質
化學性質極穩定,不溶於強酸強鹼溶液,在空氣中不氧化。第一電離能9.0電子伏特。
化合價為+2、+4和+6。熔點1772℃,沸點3827℃。密度21.46克/立方厘米。銀白色金屬,質柔軟,有
延展性。晶體結構為面心立方體。鉑有很高的
化學穩定性,除溶於
王水和熔融的鹼外,還溶於鹽酸和過氧化氫、鹽酸和高氯酸的混合物中,除此之外,鉑常溫下不與一般強酸、鹼和其他試劑作用。但是鉑在高溫下容易遭受腐蝕,例如:對於多種氧化劑,強鹼、容易還原的重金屬,以及硫、磷、砷等,鉑或則被其破壞,或則與其成合金,正因為如此,所以不得在鉑器皿中加熱或熔融鹼金屬的氧化物,硫代硫酸鈉,含磷和大量硫的物質以及含重金屬的樣品(如鉛、錫、銻、砷、汞、銅等)。高溫下不許使用大量過氧化劑、氫氧化鈉(鉀)作熔劑。鉑器皿中不允許處理鹵素或分解出鹵素的物質。但以下物質能溶解鉑:
雖然王水能溶解鉑,但這與鉑的狀態有關,緻密的鉑在常溫下的王水溶解速度非常慢,直徑1 mm的鉑絲要4-5個小時才能完全溶解。
鉑黑(鉑粉)在加熱時能與濃硫酸反應,生成Pt(SO
4)
2,SO
2和水。氯鉑酸的製法是把鉑金屬溶解在王水中。這個反應的產物是H
2PtCl
6,而非以前認為的含氮鉑化合物。氯鉑酸是一紅棕色固體,可從蒸發其溶液取得。
鹼金屬氰化物也能溶解鉑,高溫下鉑能與鹵素反應,但硒,碲和磷更容易和鉑反應。緻密的金屬鉑在任何溫度下的空氣中都不被氧化。
鹽酸和過氧化氫的混合物
熔融的鹼
鹽酸和高氯酸的混合物
與王水的反應:3Pt+4HNO3+18HCl=3H2[PtCl6]+4NO↑+8H2O
用王水溶解經過處理的鉑
精礦或電解銅、鎳產生的
陽極泥,經一系列
化學處理後,可得氯鉑酸銨,將它在1000℃緩慢灼燒,便分解製得海綿鉑。鉑在氫化、脫氫、異構化、環化、脫水、脫鹵、氧化、裂解等化學反應以及接觸法生產硫酸、氨氧化法製取硝酸、氨和甲烷製取氫氰酸、製備
環己烷、生產維生素時都用作催化劑。用
鉑催化劑重整石腦油,可提高汽油產品的辛烷值。鉑及其合金在高溫下耐氧化和腐蝕,用於製作坩堝、蒸發皿、電極、噴嘴、反應器等。鉑和
鉑銠合金在冶金、玻璃、陶瓷工業中用作
高溫爐的爐絲和熱電偶。鉑還用於製作首飾。
分類
鉑,又稱白金,周期表中第Ⅷ族鉑元素,錫白色金屬,原子序數為78,相對原子質量為195.09,密度為21.45g/cm,熔點為1769℃,沸點為3800℃。純鉑具有良好的高溫抗氧化性和化學穩定性,易加工成形。鉑化合物用做化工、製藥、煉油、汽車尾氣淨化等領域的催化劑。
自然鉑
含有鐵、銥、鈀等雜質的鉑礦物,呈銀白色或暗灰色,屬於等軸晶系,是不規則的粒狀或鱗片狀集合體,密度為13.35~19g/cm,富有延展性。化學組成:Pt晶體屬等軸晶系的一種
自然元素礦物。又名
白金,但中國古籍中所謂的白金,系指銀,並非鉑。除Pt外,自然鉑經常含鐵,達9~11%時稱為粗鉑礦;更高時稱為鐵鉑礦,最高可達28%。還常含
鎳、金、銅、
鈀、銥和
銠等,鈀最高含量可達21.8~30.0%,銥27.79~29.0
海綿鉑
含鉑質量分數≥99.9%的灰色海綿狀金屬,按鉑的含量分為三個牌號:SM-Pt99.99、SM-Pt99.95、和SM-Pt99.9,一般用火法及溫法冶煉製取。
高純海綿鉑
含鉑質量分數≥99.995%的灰色海綿狀金屬,按鉑的含量分為兩個牌號:SM-Pt99.995和SM-Pt99.999,一般從各類含鉑物料中經分離提純後製取,供化學工業、電氣儀表、精密合金及測溫材料等使用。
超細鉑粉
含鉑≥99.95%、平均粒徑7.0m/g,松裝密度為0.4~0.7g/cm,振實密度為0.7~1.1g/cm-3.
鉑銥合金
鉑基含銥的二元合金,高溫下為連續固溶體,緩冷至975~700℃時發生固相分解,但相平衡過程進行得慢。銥易揮發和氧化,能顯著地提高鉑的耐腐蝕性。該合金具有高硬度、高熔點、高耐腐蝕能力和低的接觸電阻等特點。
鉑銀合金
以鉑為基含銀的二元合金,在1185℃和45%Ag處發生包晶反應。該合金強度高、彈性好且彈性後效低、電阻係數小、熱電勢低、耐熱、耐腐蝕、無磁、性能穩定,鉑銀合金熔煉和加工都很困難,一般用高頻感應加熱爐氫氣保護熔煉,鑄錠須經均勻化後,加工成板片和線材等。
鉑鉬合金
以鉑為基含鉬的二元合金,富鉑固溶體為面心立方結構,電阻係數隨鉬含量增加呈直線上升。鉑鉬合金抗拉強度為922N/mm-2,電阻係數為0.64Ω.mm-2/m,電阻溫度係數為2.4X10-4/℃。用高頻感應加熱爐氫氣保護熔煉,冷凝排氣數次,鑄定經熱鍛後冷加工成線材和片材等。鉑鉬合金主要用做熱電偶材料,熱電勢高、穩定性好,能在核場中工作,使用溫度為1500~1600℃。此外,鉑鉬合金還可用作電位器繞組和高溫應變材料。
鉑錸合金
以鉑為基含錸的二元合金,在溫度2450℃時發生簡單包晶反應,用高頻爐氫氣保護熔煉,熱開坯後冷加工成材。鉑錸合金有PtRe8和PtRe14兩種合金,PtRe8是高溫熱電偶材料,與銠配對使用瞬時溫度可達1800℃,與鉑配對為1600℃。PtRe14合金用做電接觸材料。
鉑鈷合金
以鉑為基含鈷的二元合金,在高溫下,鉑與鈷可無限互溶,其固溶體為面心立方晶格,緩冷至833℃,合金內開始出現有序轉變。鉑鈷合金磁性極強,磁穩定性較高,耐化學腐蝕性很好,氫氧化鉀和熱濃硫酸都不能將其腐蝕。該合金主要用於航天、航海、航空儀表,計測儀,電子鐘錶,磁控管等。
鉑銅合金
以鉑為基含銅的二元合金,高溫下為連續固溶體,低溫下,在3%~93%銅成分範圍記憶體在有序轉變,相結構由立方晶格變成菱方晶格,致使合金顯著強化。產品有PtCu2.5、PtCu5、
PtCu8.5、PtCu15和PtCu25等合金,用高頻感應加熱爐或中頻感應加熱爐熔煉,鑄錠須在均勻化後,加工成材,主要用於製造電器接點和電阻材料。
鉑鎳合金
以鉑為基含鎳的二元合金,高溫下為連續固溶體,在約645℃以下生成兩種超結構化合物。鉑鎳合金有PtNi2、PtNi5、PtNi10和PtNi20等合金,在氧化性氣氛中加熱時,鎳發生選擇性氧化,用高頻感應加熱爐氬氣保護熔煉,可加工成線材和片板等。
鉑釕合金
以鉑為基含釕的二元合金,有PtRu4、PtRu5、PtRu10和PtRu14等合金。釕提高抗腐蝕能力,抗變色能力很強,在900℃以上釕選擇性氧化和揮發。用高頻感應加熱爐氬氣保護熔煉。
鉑鋨合金
以鉑為基含鋨的二元合金。鋨具有提高合金硬度及電阻係數作用。鉑鋨合金用高頻爐氬氣保護熔煉,熱軋後冷軋成材。
鉑
0%,銠16.3~20.1%。常以細粒、細片或不規則團塊狀產出。在俄羅斯
烏拉爾曾採得重8~9千克的自然鉑漂礫和 427.5克的原生自然鉑塊。
鑑定特徵:金屬光澤,銀白至鋼灰色,比重大,在空氣中不氧化,除王水之外,在普通酸類中不溶解;以高比重和硬度大區別於
自然銀。
著名產地:世界著名產地有
南非Meresnky Reef、俄羅斯烏拉爾、加拿大薩德伯里、美國等地。中國某些超基性岩中也產有自然鉑。
名稱來源:Platinum 一字,來自西班牙語的Platina,意指銀;
晶體形態:六八面體晶類;呈粒狀或
葡萄狀,偶見立方體晶形;
晶體結構:晶系和空間群:等軸晶系,Fm3m;
晶胞參數:a0=3.924?;
鉑電阻
粉晶數據:2.265(1) 1.962(0.53) 1.1826(0.33)
莫氏硬度:4~4.5
比重:一般在14~19之間,視所含其他元素的種類和含量而定;純鉑的理論比重為 21.45。富含
鐵時具磁性。
熔點:1772℃。
其他性質:
耐腐蝕性極強。抗氧化性強。熱膨脹係數小。熱電穩定性強。延展性良好。催化活性高。
用途:自然鉑幾乎是金屬鉑的唯一來源。鉑除用於珠寶飾物外,大量用於汽車催化轉換器中,以及作為
煉油工業的催化劑,用於製作電子器件、白金
坩堝、牙科材料和人造纖維的噴絲頭等。
鉑合金
鉑合金(platinum alloy)︰指鉑與其他金屬混合而成的合金,如與
鈀、,
銠、
釔、釕、鈷、
鋨、銅等。儘管鉑硬度比金高,但作為鑲崁之用尚嫌不足,必需與其他金屬合金,方能用來製作首飾。首飾業使用鉑、釕合金和鉑、
銥合金較多。在歐洲和香港使用鉑、
鈷合金於澆鑄。在日本用鉑(85%),
鈀合金製造鍊條。國際上
鉑金飾的戳記是Pt、Plat或Platinum的字樣,並以
純度之千分數字代表之,如Pt900表示純度是900%o。在日本鉑金飾品的規格標示有Pt1000、Pt950、Pt900、Pt850。
順鉑
英文名 Cisplatin,癌症治療的常用
化學藥物,具有較高療效。別名:氯氨鉑,順一雙氯雙胺絡珀,二氯二氨鉑,順氯氨鉑。英文名:Cisplatin (CDDP) 作用與用途:該品屬細胞周期非特異性藥物,具有細胞毒性,可抑制癌細胞的DNA複製過程,並損傷其細胞膜上結構,有較強的廣譜抗癌作用。臨床用於卵巢癌、前列腺癌、睪丸癌、肺癌、鼻咽癌、
食道癌、惡性淋巴瘤、乳腺癌、頭頸部鱗癌、甲狀腺癌及成骨肉瘤等多種實體腫瘤均能顯示療效。副作用:1 有骨髓抑制、血小板和
白細胞減少。有胃腸道反應、噁心、嘔吐。腎毒性,多飲水或輸液、強迫利尿可減輕腎毒性。腎功能不全者慎用。西藥劑量:成人常用劑量10mg~20mg/日,溶於200ml~300ml生理鹽水中,靜脈滴注,避光2小時內滴完,每療程為200mg~400mg,在用量達到100mg~200mg後,需間隔1~2周。總用量達200mg時,多數病人呈現主客觀緩解。
氯氨鉑 【別名】 氯氨鉑;順鉑;順-雙氯雙氨絡鉑,雙氯雙氨絡鉑,威力順鉑,順式鉑,氨氯鉑,
錫鉑,順氯氨鉑
【外文名】Cisplatin,Cis-Platium,DDP,PDD,NSC-119875,Randa,Neoplatin,Platinol
【適應症】 抗瘤譜較廣,臨床用於治療睪丸惡腫腫瘤,對胚胎瘤和精原細胞瘤均有較好效果,與常用藥物無交叉耐藥。對卵巢癌、乳腺癌和膀胱癌有較好療效。對頭頸部癌、肺癌、食管癌、
惡性黑色素瘤、惡性淋巴瘤軟組織肉瘤和癌性胸腹水等也有一定療效。與其他抗癌藥聯合套用效果更好。
【用量用法】 1.一般劑量:每平方米體表面積20~30m
注射用順鉑
g溶於等滲鹽水200ml中靜滴,連用3~5日(總量150mg),間隔3周再重複,可重複用藥3~4療程。2.高劑量:每平方米體表面積80~120mg,同時進行水化和利尿,每3周用藥1次,可重複3~4次。3.胸腹腔注射:每次30~60mg,7~10日1次。
【注意事項】 1.消化道反應有食慾減退、噁心、嘔吐、腹瀉等。一般於注射後1~2小時發生,持續4~6小時或更長,停藥2~3日後消失。但也有少數病人可持續1周以上。2.骨髓抑制:主要表現白細胞減少,多發生於劑量超過1日每平方米體積100mg時,血小板減少相對較輕。3.聽神經毒性與總劑量有關,表現為耳鳴、耳聾、頭昏,嚴重者可有不可逆的高頻聽力喪失。4.腎臟毒性表現為
血尿及腎功能損害,血清肌酐升高及清除率降低,與所用總量有關,常發生於治療後7~14日之間。5.尚有人報告少數病人可出現心電圖ST-T改變,肝功能損傷等。6.有以下情況時應停用該品:(1)白細胞低於3500/μl; (2)血小板低於7.5萬/μl; (3)持續性噁心嘔吐; (4)早期腎臟毒性如尿中白細胞10/高倍視野、
紅細胞5/高倍視野或管型5/高倍視野以上者; (5)血清肌酐超過1.5mg/日者; (6)既往患過腎肝疾患、腎功能不好及患過中耳炎的病人。7.為了減輕毒性反應,用藥期間應多飲水或輸液,強迫利尿;藥前先給甲氧氯普胺(胃復安)和氯丙嗪等減輕消化道反應;經常檢查血、尿、肝、腎功能及聽力。8.過敏反應發生快,如有的病人僅在用藥幾分鐘後出現面部水腫、哮鳴、心動過速和低血壓。9.該品具有誘變性、致畸性和可能的致癌性。
【規格】 注射用順鉑:每支10mg、20mg。
製備
用途說明
鉑由於有很高的化學穩定性(除王水外不溶於任何酸,鹼)和催化活性,因此,套用很廣。可與鈷合制強磁體。多用來製造耐腐蝕的化學儀器,如各種反應器皿、
蒸發皿、
坩堝、電極、鉑網等,鉑和鉑
銠合金常用作
熱電偶,來測定1200~1750℃的溫度。還可用於製造首飾。鉑在氫化、脫氫、異構化、環化、脫水、脫鹵、氧化、裂解等化學反應中均可作催化劑。在醫藥中,可做抗癌藥,鉑的化合物如
順鉑(Cisplatin)則用於癌症的
化療之用。
電子材料、表面活性劑。
貯藏運輸
常溫乾燥密封保存。
危險說明
危險代碼 | F |
危險等級 | R11 |
安全等級 | S16 |
聯合國編號 | 3089 |
分布
鉑是地殼中最稀少的元素之一。鉑幾乎都以游離狀態分散於沖積礦床和砂積礦床中,如
磁鐵礦、原鉑礦、
鉻鐵礦、
鈦鐵礦、硫化鎳銅礦、含鉑黃銅礦,含鉑磁黃鐵礦、鎳黃鐵礦等。此外,鉑還與其他鉑系元素形成合金,如自然鉑、鈀鉑礦、鋨銥礦等。主要鉑礦有砷鉑礦、硫鉑礦、銻鉑礦、硫鉑鈀礦、硫鎳鈀鉑礦等,還有銻金鉑礦、錫鉛鉑鈀礦、鉍銻鉑礦、銘鎳鉑礦、碲鉑礦、砷鉑銥礦、砷鍺鉑鈀礦、含鉑金銀礦等。
世界上鉑資源最豐富的國家是
南非,其次是俄羅斯、加拿大和美國。
鉑有6種穩定的同位素:鉑-190、鉑-192、鉑-194、鉑-195、鉑-196、鉑-198。
在自然界中常以自然礦
狀態存在,極為分散。多用原鉑礦富積、萃取而獲得。
上游原料:氨水、二氧化硫、硫酸、氯化銨、氯氣、氯酸鈉
下游產品:硝酸、氯鉑酸、一氧化碳助燃劑
輔助資料
鉑和它的同系金屬——釕、
銠、
鈀、
鋨、銥和金一樣,幾乎完全成
單質狀態存在於自然界中。它們在地殼中的含量也和金相近,且它們的化學惰性和金比較也不相上下,但是人們發現並使用它們卻遠在金後。它們在自然界中的極度分散和它們的高熔點,可能是造成這種狀況的原因。至今發現的最大的天然鉑塊是9.6千克。鉑的熔點1772℃,釕的熔點2310℃,銠的熔點1966℃,鈀的熔點1552℃,鋨的熔點3054℃,銥的熔點2410℃,而金的熔點是1063℃。
 鉑
鉑南美洲古代印第安人卻早已經利用鉑和金的合金製成裝飾品。由於鉑在鉑系礦物中的含量比其他元素的含量大的多,因而它是
鉑系元素中首先被發現的。
在歐洲首先提到鉑的可能是法國礦物學家斯卡里吉在1557年發表的著述中。他講到所有金屬都能熔化,但有一種墨西哥和達里南Darian(今巴拿馬)礦里的一種金屬不能熔化。這可以認為是指鉑。
18世紀中葉,南美洲的鉑礦傳到歐洲一些學者手中,他們對鉑進行了研究。不少學者認為鉑不是一種純金屬,而是金、鐵和汞的合金,還有人認為它是一種
半金屬。1752年
瑞典化學家謝斐爾肯定它是一種獨立的金屬,稱它為aurum album(白金)。
1789年
拉瓦錫發表他制定的元素表,鉑被列入其中。現今鉑的拉丁名稱是platinum,元素符號是Pt。
同位素及放射線:Pt-188[10.2d] Pt-190(放 α[6.0E11y]) Pt-191[2.96d] Pt-192(放 α) Pt-193[60y] Pt-194 *Pt-195 Pt-196 Pt-197[18.3h] Pt-198
電子親合和能:205.3 KJ·mol-1
第一電離能:860 KJ·mol-1 第二電離能:1791 KJ·mol-1 第三電離能:0 KJ·mol-1
單質密度:21.45 g/cm3 單質熔點:1772.0 ℃ 單質沸點:3827.0 ℃
 鉑
鉑常見化合物:H2(PtCl6)
西班牙語:platina(亞銀)。
稀有、柔軟的銀白色金屬,非常沉重。
 鉑
鉑 鉑
鉑 鉑
鉑 鉑
鉑
