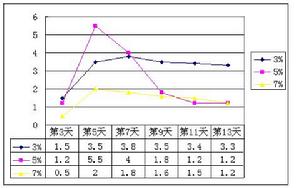
理化性質
物理性質
外觀與性狀:無色液體。
氣味:有刺激性氣味。
密度:未知。
熔沸點:未知。
 亞硝酸
亞硝酸 化學性質
亞硝酸鹽除黃色的AgNO2不溶於水外,大多數亞硝酸鹽是無色的,一般易溶於水。
氧化性
2HNO2+2I-+2H+ ====I2+2NO↑+2H2O
這個反應可用於分析測定。在多數的情況下,亞硝酸可還原成一氧化氮NO,也可還原成
氧化二氮N
2O、氮、羥氨NH
2OH或氨NH
3。它被
氧化時,即成為
硝酸。 將
二氧化氮和
一氧化氮的混合物溶解在接近
零度的水中,即生成亞硝酸的水溶液:
NO2+NO+H2O====2HNO2
在亞硝酸鹽溶液中加入酸,也可得到亞硝酸的溶液:
NaNO2+HCl─→HNO2+NaCl
亞硝酸也可用NO與O2與水反應製得:
4NO+O2+2H2O===4HNO2
此反應可以理解為NO與O2生成N2O3,N2O3再與水反應形成亞硝酸。
分解產物
硝酸鹽分解的產物可以是:
3、金屬單質(銅後金屬硝酸鹽)。
亞硝酸氧化性強於硝酸,這是因為3價氮不穩定,易分解釋放出氧原子的原因。
其它:脂肪
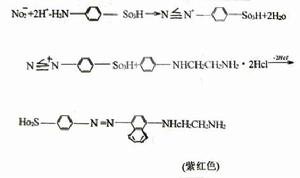
伯胺與亞硝酸反應生成相應的
醇,並放出
氮氣。 芳香伯胺與亞硝酸在低溫和酸性條件下發生
重氮化反應,產物
重氮鹽不穩定,遇熱分解成為
酚與氮氣。 脂肪
仲胺和芳香仲胺與亞硝酸反應生成N-亞硝基胺,其是不溶於水的黃色油狀物或固體。 脂肪叔胺和亞硝酸只形成不穩定的鹽。 芳香叔胺如
N,N-二甲苯胺在酸性條件下可與亞硝酸反應生成4-
亞硝基-N,N-二甲苯胺,其為綠色沉澱。
亞硝酸鹽是一種食品
防腐劑,能防止食品腐敗
變質,具有顯著的
殺菌或抑菌效能,特別是在醃肉工業上得到廣泛套用。
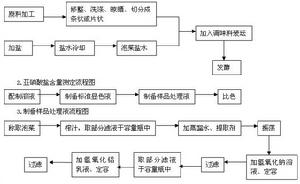
製備方法
製備環節
用
亞硝酸鈉製取。 化學式NaNO
2。亞硝酸僅存在於稀的水溶液中,是一種弱酸,不穩定,易分解成NO
2和NO,也能發生如下
歧化反應:3HNO
2====HNO
3+2NO↑+H
2O
 亞硝酸
亞硝酸在亞硝酸中氮原子的氧化數是+3,是一種中間氧化態,因此,亞硝酸既具有氧化性,又具有還原性,而氧化性比還原性更為突出。例如,它在水溶液中能將I-離子氧化為單質碘:
將二
氧化氮和氧化氮的混合物溶解在接近零度的水中,即生成亞硝酸的水溶液:
NO2+NO+H2O====2HNO2
NaNO
2+HCl====HNO
2+NaCl
 亞硝酸
亞硝酸亞硝酸有順式和反式之分,其中反式亞硝酸比順式亞硝酸更穩定。
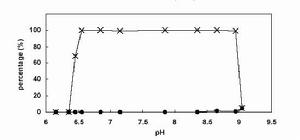
檢驗環節
亞硝酸根離子可在酸性介質中,通過和鐵(II)反應產生棕色環加以定性檢出。參見棕色環實驗。
 亞硝酸
亞硝酸Fe2+ + NO2- + 2H+ = Fe3+ +NO↑ + H2O
Fe2+ +SO42- + NO = [Fe(NO)]SO4
生成棕色的硫酸亞硝醯鐵(I) (當酸為醋酸時會反應)
 亞硝酸
亞硝酸 亞硝酸
亞硝酸 亞硝酸
亞硝酸
 亞硝酸
亞硝酸