歷史發展,含量分布,物化屬性,元素簡介,基本屬性,原子屬性,具體性質,同位素,圖表,氫氣生物學效應,製取方法,工業製法,元素純化,貯存方法,作用用途,工業生產,醫學用途,天然氣,太陽能,氫能,氫能簡介,風力,生物燃油,煤礦,
歷史發展 早在
十六世紀 ,
瑞士 的一名醫生就發現了氫氣。他說:“把
鐵屑 投到
硫酸 里,就會產生氣泡,像旋風一樣騰空而起。”他還發現這種氣體可以燃燒。然而他是一位著名的醫生,病人很多,沒有時間去做進一步的研究。
十七世紀時又有一位醫生髮現了氫氣。但那時人們認為不管什麼氣體都不能單獨存在,既不能收集,也不能進行測量。這位醫生認為氫氣與空氣沒有什麼不同,很快就放棄了研究。
最先把氫氣收集起來並進行認真研究的是在1766年英國的一位化學家
卡文迪什 。
卡文迪什非常喜歡化學實驗,有一次實驗中,他不小心把一個鐵片掉進了
鹽酸 中,他正在為自己的粗心而懊惱時,卻發現鹽酸溶液中有氣泡產生,這個情景一下子吸引了他。他又做了幾次實驗,把一定量的
鋅 和
鐵 投到充足的鹽酸和稀硫酸中(每次用的硫酸和鹽酸的質量是不同的),發現所產生的氣體量是固定不變的。這說明這種新的氣體的產生與所用酸的種類沒有關係,與酸的濃度也沒有關係。
卡文迪什用排水法收集了新氣體,他發現這種氣體不能幫助蠟燭的燃燒,也不能幫助動物的呼吸,如果把它和空氣混合在一起,一遇火星就會爆炸。卡文迪什經過多次實驗終於發現了這種新氣體與普通空氣混合後發生爆炸的極限。他在論文中寫道:如果這種
可燃性氣體 的含量在9
. 5%以下或65%以上,點火時雖然會燃燒,但不會發出震耳的爆炸聲。
氫氣 隨後不久他測出了這種氣體的比重,接著又發現這種氣體燃燒後的產物是水,無疑這種氣體就是氫氣了。卡文迪什的研究已經比較細緻,他只需對外界宣布他發現了一種氫元素並給它起一個名稱就行了。但卡文迪什受了“
燃素說 ”的影響,堅持認為水是一種元素,不承認自己無意中發現了一種新元素。
後來
拉瓦錫 聽說了這件事,他重複了卡文迪什的實驗,認為水不是一種元素而是氫和氧的化合物。在1787年,他正式提出“氫”是一種元素,因為氫燃燒後的產物是水,便用拉丁文把它命名為“水的生成者”。
2016年1月,英國愛丁堡大學科學家利用鑽石對頂砧製造出某種極端高壓狀態,從而生成“第五狀態氫”,即氫的固體金屬狀態。這種狀態的氫通常存在於大型行星或太陽核心之中,分子分離成單原子,電子的行為特徵像金屬電子一樣。
含量分布 在地球上和
地球大氣 中只存在極稀少的游離狀態氫。在地殼裡,如果按質量計算,氫只占總質量的1%,而如果按原子
百分數 計算,則占17%。氫在自然界中分布很廣,水便是氫的“倉庫”——氫在水中的質量分數為11%;泥土中約有1
. 5%的氫;石油、天然氣、動植物體也含氫。在空氣中,氫氣倒不多,約占總體積的一千萬分之五。在整個宇宙中,按原子百分數來說,氫卻是最多的元素。據研究,在太陽的大氣中,按原子百分數計算,氫占81
. 75%。在
宇宙空間 中,氫原子的數目比其他所有元素原子的總和約大100倍。
氫的原子光譜 物化屬性 元素簡介 氫最常見的同位素是
氕 (piē),含1個
質子 ,不含
中子 。在
離子化合物 中,氫原子可以得一個電子成為氫陰離子(以 H
- 表示) 構成氫化物,也可以失去一個電子成為氫陽離子(以 H
+ 表示,簡稱
氫離子 ),但氫離子實際上以更為複雜的形式存在。氫與除
稀有氣體 外的幾乎所有元素都可形成化合物,存在於
水 和幾乎所有的有機物中。它在酸鹼化學中尤為重要,酸鹼反應中常存在氫離子的交換。氫作為最簡單的
原子 ,在原子物理中有特別的理論價值。對
氫原子 的能級、成鍵等的研究在
量子力學 的發展中起了關鍵作用。
氫氣(H
2 )最早於16世紀初被人工合成,當時用的方法是將金屬置於強酸中。1766~81年,亨利·卡文迪許發現氫氣是一種與以往所發現氣體不同的另一種氣體,在燃燒時產生水,這一性質也決定了拉丁語 “hydrogenium” 這個名字(“生成水的物質”之意)。
常溫 常壓下,氫氣是一種極易燃燒,無色透明、無臭無味的氣體。
氫原子則有極強的
還原性 。在高溫下氫非常活潑。除
稀有氣體元素 外,幾乎所有的元素都能與氫生成化合物。
基本屬性 物質狀態
元素在太陽中的含量
75%
地殼中含量
1. 5%
0. 0001 %
1. 673×-27
質子相對質量
1. 00794
所屬周期
1
所屬族數
IA
1g/mol
無
H2 O
最高價氧化物
H2 O
原子屬性 1s1
1
電子層
K
1.00794
原子半徑
(計算值)25(53)pm
37 pm
120 pm
具體性質 顏色
常溫下為無色氣體
14. 025 K (-259. 125 ℃)
20. 268 K (-252. 882 ℃)
13.8033 K (-259 ℃)7.042kPa
32.97 K (-240 ℃) 1.293MPa
22. 4L/mol
0. 44936 kJ/mol
0. 05868 kJ/mol
比熱容量
14000J/(kg·℃)
聲在其中傳播的速度
1270 m/s(293. 15K)
M - M+ 1312
0. 0899 kg/m3 (273K)、NA
W/(m·K)180.5
同位素 氫是唯一的其同位素有不同的名稱的元素。(歷史上每種元素的不同同位素都有不同的名稱,現已不再使用。)D 和 T 也可以用作氘(deuterium)和氚(tritium)的符號,但 P 已作為磷的符號,故不再作為氕(protium)的符號。 按照
IUPAC 的指引,D 或
2 H 和 T 或
3 H 都可以使用,但推薦使用
2 H 和
3 H(同位素相對原子質量不同),生活中通常使用氕。
氫在自然界中存在的同位素有:
氫的同位素氕的電子排布 以人工方法合成的同位素有: 氫4、氫5、氫6、氫7
氕(氫-1)
氕的原子核只有一個質子,豐度達99. 98% ,是構造第二簡單的的原子。
氘(氫-2)
氘為氫的一種穩定形態同位素,也被稱為
重氫 ,元素符號一般為2H或D。它的原子核由一顆質子和一顆中子組成。在大自然的含量約為一般氫的7000分之一。氫(H)的同位素,其
相對原子質量 為普通輕氫的二倍,少量的存在於天然水中,用於核反應,並在化學和生物學的研究工作中作
示蹤原子 (deuterium)——亦稱“重氫”,
元素符號 D。
氚(氫-3)
氚,亦稱超重氫,是氫的同位素之一,元素符號為T或3H。它的原子核由一顆質子和兩顆中子所組成,並帶有放射性,會發生β衰變,其半衰期為12. 43年。自然界中存在極微,從核反應製得。主要用於熱核反應。
氫-4
氫-4是氫的同位素之一,它包含了質子和三個中子。在實驗室里,是用氘的原子核來轟炸氚的原子核,來合成一個氫4的原子核。在這過程中,氚的原子核會從氘的原子核上吸收一個中子。氫4的質量為4
. 0279121U,
半衰期 為9
. 93696×10
-22 秒。
氫-4.1
氫-4.1結構上類似氦,它包含了2個質子和2箇中子,但因其中一個電子是
渺子 ,但由於渺子的軌道特殊,軌道非常接近原子核,而最內側的電子軌道與渺子的軌道相較之下在很外側,因此,該渺子可視為原子核的一部份,所以整個原子可視為:原子核由1個渺子、2個質子和2箇中子組成、外側只有一個電子,因此可以視為一種氫的同位素,也是一種
奇異原子 。一個渺子重約0
. 1U,故名氫- 4
. 1(4
. 1H)。氫-4
. 1原子可以與其他元素反應,和行為更像一個氫原子不是像惰性的
氦 原子。
氫-5
氫-5是氫的
同位素 之一,它的原子核包含了四個中子和一個質子,在實驗室里用一個氚的原子核來轟炸氚,這讓氚吸收兩個
氚 原子核 的質子而形成了氫5。氫5的
半衰期 非常短,只有8
. 01930×10
-22 秒。
氫-6
氫-6是不穩定的氫同位素之一,它包含了一個質子和五個中子,半衰期為3×10-22 秒。
氫-7
氫-7是不穩定的氫同位素之一,它包含了一個質子和六個中子,
圖表 符號 質子數 中子數 原子質量單位 (u)半衰期 原子核 自旋 豐度 豐度的變化率 1 H
1
0
1. 007,825,032,07(10)
穩定 [>2. 8×102 3 年]
1/2+
0. 999885(70)
0. 999816~0. 999974
2 H
1
1
2. 0141017778(4)
穩定
1+
0. 000115(70)
0. 000026~0. 000184
3 H
1
2
3.0160492777(25)
12. 32(2) 年
1/2+
4 H
1
3
4. 02781(11)
1. 39(10)×10-22 s [4. 6(9) MeV]
2-
5 H
1
4
5. 03531(11)
>9. 1×10-22 s
(1/2+)
6 H
1
5
6. 04494(28)
2. 90(70)×10-22 s [1. 6(4) MeV]
2-#
7 H
1
6
7. 05275(108)#
2. 3(6)×10-23 # s [20(5)# MeV]
1/2+#
備註: 畫上#號的數據代表沒有經過實驗的證明,只是理論推測而已,而用括弧括起來的代表數據不確定性。
氫氣生物學效應 早在1975年就有人開展了氫氣治療腫瘤的研究,後來2001年才有法國學者將高壓氫用於治療肝臟寄生蟲感染的研究。早期的研究只能簡單地觀察氫氣被動物呼吸後的反應,顯然觀察結果證明氫氣對動物沒有產生顯著的影響。關於氫氣的生物學效應,最熱鬧地當然屬於潛水醫學,因為氫氣作為人類潛水呼吸的氣體被國際許多重要的潛水醫學研究單位深入研究,作為呼吸氣體的最重要前提是該氣體的安全性,就是不能對人體產生明顯的影響,包括在極端高壓下呼吸這種氣體。許多年的潛水醫學研究證明呼吸氫氣是非常安全的,但也同時給人們一種深刻印象,呼吸氫氣對人體是沒有明顯生物學效應的。2007年日本學者報導,動物呼吸2%的氫可有效清除強毒性自由基,顯著改善腦缺血再灌注損傷,採用化學反應、細胞學手段證明,氫溶解在液體中可選擇性中和羥自由基和亞硝酸陰離子。而後兩者是氧化損傷的最重要介質,體內缺乏他們的清除機制,是多種疾病發生的重要基礎。隨後他們又用肝缺血和心肌缺血動物模型,證明呼吸2%的氫可以治療肝和心肌缺血再灌注損傷。採用飲用飽和氫水可治療應激引起的神經損傷和基因缺陷氧化應激動物的慢性氧化損傷。美國匹茲堡大學器官移植中心學者Nakao等隨後證明,呼吸2%的氫可以治療小腸移植引起的炎症損傷,飲用飽和氫水可治療心臟移植後心肌損傷、腎臟移植後慢性腎病。國內第四軍醫大學謝克亮等的研究證明,呼吸氫氣能治療動物系統炎症、多器官功能衰竭和急性顱腦損傷。孫學軍等的研究也證明,呼吸2%的氫可以治療新生兒腦缺血缺氧損傷。隨後,孫學軍等成功製備了飽和氫注射液,並與國內40多家實驗室開展合作,先後發現該注射液對疼痛、關節炎、急性胰腺炎、老年性痴呆、慢性氧中毒、一氧化碳中毒遲發性腦病、肝硬化、脂肪肝、脊髓創傷、慢性低氧、腹膜炎、結腸炎、新生兒腦缺血缺氧損傷、心肌缺血再灌注損傷、腎缺血再灌注損傷和小腸缺血再灌注損傷等具有良好的治療作用。這些研究說明,氫是一種理想的自由基、特別是毒性自由基的良好清除劑,具有潛在的臨床套用前景。
製取方法 工業製法 水煤氣法:
CO(g)+H2 O(g)=催化劑 =CO2 (g)+H2 (g)
除此之外,還有電解法、烴裂解法、烴蒸氣轉化法等。實驗室製法鋅與
稀硫酸 反應(中學課本標準實驗室製法)
Zn+H2 SO4 =ZnSO4 +H2 ↑
若用
鹽酸 ,製得的氫氣中可能會混有氯化氫氣體(HCl),因為稀鹽酸也有一定的揮發性。
啟普發生器 金屬若用鐵或鎂,反應速率會影響實驗觀察效果。
其他製法
2Al + 3H2 SO4 =Al2 (SO4 )3 + 3H2 ↑
Fe+2HCl=FeCl2 +H2 ↑
Fe+H2 SO4 =FeSO4 +H2 ↑2 +H2 ↑
Mg+H
2 SO
4 =MgSO
4 +H
2 ↑
Zn+2HCl=ZnCl
2 +H
2 ↑
Zn+H
2 SO
4 = ZnSO
4 +H
2 ↑
2Al+6HCl=2AlCl
3 +3H
2 ↑
2Al+2NaOH+2H
2 O=2NaAlO
2 +3H
2 ↑(註:NaAlO
2 為簡化形式,實際存在的是
四羥基合鋁酸鈉 Na[Al(OH)
4 ])
2H
2 O=
通直流電 =2H
2 ↑+O
2 ↑
6CH
3 COOH+2Al=2Al(CH
3 COO)
3 +3H
2 ↑ 鋁與乙酸反應生成氫氣
Fe+2HCl==FeCl2 +H2 ↑
元素純化 隨著半導體工業、精細化工和光電
纖維 工業的發展,產生了對
高純氫 的需求。例如,半導體生產工藝需要使用99
. 999%以上的高純氫。但是工業上各種制氫方法所得到的氫氣純度不高,為滿足工業上對各種高純氫的需求,必須對氫氣進行進一步的純化。氫氣的純化方法大致可分為兩類(物理法和化學法), 氫氣
提純 方法主要有低溫吸附法,低溫液化法,金屬氫化物氫淨化法;此外還有鈀膜擴散法,中空纖維膜擴散法和
變壓吸附法 等六種方法。
方法 基本原理 適用原料氣 製得氫氣濃度(%) 適用規格 高壓催化法
氫與氧發生反應而去除氧
含氧的氫氣,主要是電解法製得的氫氣
99.999
小
金屬氫化物分離法
先使氫與金屬形成金屬氫化物之後,加熱或減壓使其分解
氫含量較低的氣體
>99.9999
中小
高壓吸附法
吸附劑選擇吸附雜質
任何含氫氣體
99.999
大
低溫分離法
低溫下使氣體冷凝
任何含氫氣體
90~98
大
鈀合金薄膜擴散法
鈀合金薄膜對氫有選擇滲透性,其他氣體不能透過
氫含量較低的氣體
>99.9999
中小
聚合物薄膜擴散法
氣體透過薄膜的擴散速率不同
煉油廠廢氣
92~98
小
貯存方法 氫是一種能量密度很高的清潔可再生能源,但其特殊性質導致難以常溫常壓儲存,泄漏後有爆炸危險。若能突破儲存技術便可以廣泛用於各種動力設備。中國利用特殊溶液大量吸收氫氣,一立方米可以吸收超過50公斤,平常可以穩定儲存,加入催化劑便可釋放氫氣,儲氫材料可重複使用2000次。該技術國際領先,或引發氫能利用革命。
保存氫氣方法很多,但是高效的儲氫方法主要有:液化儲氫(成本太高,而且需要很高的能量維持其液化);壓縮儲氫(重量密度和體積密度都很低);金屬氫化物儲氫(體積存儲密度較高,但是重量密度低),還有一個是現在正在研究的碳納米管吸附儲氫(已經證明在室溫和不到1bar(約一個大氣壓)的壓力下,單壁碳管可以吸附5%-10%,多壁碳納米管儲氫可達14%,但是這些報導都受到了質疑,原因是目前尚未建立一個世界上公認的檢測碳納米管儲氫的檢測標準)目前根據理論推算和反覆驗證,大家普遍認為可逆儲/放氫量在5%(質量密度百分比)左右,但是即使是只有5%也是迄今為止最好的儲氫材料。
氫的儲運技術是制約氫能發展的最主要技術瓶頸,目前其研究主要集中在高壓儲氧罐、輕金屬材料、複雜氫化物
材料 、有機液態材料等氫儲運技術。將氫氣經特殊處理溶解在液態材料中,實現氫能的常態化、安全化套用,甚至用普通
礦泉水 瓶也能裝運,這一願景正在逐漸接近現實。業界認為該技術處於國際領先水平,並有可能引發氫能利用革命。
2014年9月9日,中國地質大學(武漢)可持續能源實驗室開發的液態儲氫技術已經完成了實驗室階段的研究,正準備進行大規模中試和工程化試驗。
團隊利用不飽和芳香化合物催化加氫的方法,成功攻克了氫能在常溫常壓下難以貯存和釋放這一技術瓶頸,實現了氫能液態常溫常壓運輸,而且克服了傳統高壓運輸高成本、高風險的弊病,所儲氫在溫和條件下加催化劑釋放後即可使用。儲氫材料的技術性能指標超過了美國能源部頒布的車用儲氫材料標準。
實驗室研究顯示,儲氫分子熔點可低至-20℃,能在150℃左右實現高效催化加氫,並在常溫常壓下進行儲存和運輸;催化脫氫溫度低於200℃,脫氫過程產生氫的純度可高達99.99%,並且不產生CO、NH3等其他氣體;儲氫材料循環壽命高、可逆性強(高於2000次);質量儲氫容量>5.5wt%,體積容量>50kg(H2) ·m-3。程寒松告訴記者,所用催化劑無需再生即可重複使用,5年內無需更新。
作用用途 氫是重要工業原料,如生產
合成氨 和甲醇,也用來提煉
石油 ,氫化有機物質作為收縮氣體,用在氧氫焰熔接器和火箭燃料中。在高溫下用氫將
金屬氧化物 還原以製取金屬較之其他方法,產品的性質更易控制,同時金屬的純度也高。廣泛用於鎢、鉬、鈷、鐵等
金屬粉末 和鍺、矽的生產。由於氫氣很輕,人們利用它來製作
氫氣球 ——
氫氣球 。)氫氣與
氧氣 化合時,放出大量的熱,被利用來進行切割
金屬 。
清潔能源,用於汽車等的燃料。為此,美國於2002年還提出了“國家
氫動力 計畫”。但是由於技術還不成熟,還沒有進行大批的工業化套用。2003年科學家發現,使用氫燃料會使
大氣層 中的氫增加約4~8倍。認為可能會讓
同溫層 的上端更冷、雲層更多,還會加劇
臭氧 洞的擴大。但是一些因素也可抵銷這種影響,如使用氯氟甲烷的減少、土壤的吸收、以及
燃料電池 的新技術的開發等。
在常溫下,氫比較不活潑,但可用合適的催化劑使之活化。在高溫下,氫是高度活潑的。除稀有氣體元素外,幾乎所有的元素都能與氫生成化合物。
非金屬元素 的
氫化物 通常稱為某化氫,如
鹵化氫 、
硫化氫 等;金屬元素的氫化物稱為金屬氫化物,如
氫化鋰 、
氫化鈣 等。
氫是重要的工業原料,又是未來的能源,也是最清潔的燃料。
氫的同位素氘和氚可套用於核聚變,提供能量,因為技術原因,核聚變發電還無法大量套用。
工業生產 不同的氫氣生產方法有不同的固定投資額和邊際成本。制氫的能源和燃料可以來自多種來源例如天然氣、
核能 、太陽能、
風力 、
生物燃料 、
煤礦 、其他化石燃油、地熱。(以下以全美國汽車都改為氫氣的假設為計算單位)
醫學用途 一、氫氣治療疾病的概況
2007年,Ohsawa的關於氫氣選擇性抗氧化和對大鼠腦缺血治療作用的報導是該領域具有開創意義的工作。雖然早在1975年和2001年就有關於氫氣抗氧化的報導,但2001年是研究呼吸800 kpa氫氣14天的效應,而2007年報導是呼吸2kpa氫氣不足1小時的效應,兩者分壓相差400倍,呼吸時間相差600倍,所以這絕對是完全不同性質的工作。該研究將大鼠中動脈臨時阻斷90分鐘(將一根縫合線插到大腦中動脈起始段),然後再灌流,這是經典的腦中風動物模型,類似腦缺血後再恢復血流的情況。在恢復血液供應前5分鐘開始給動物呼吸含氫氣1、2、4%的混合氣體35分鐘,結果發現動物腦組織壞死體積非常顯著地減少。日本學者將這種作用歸因於氫氣可以選擇性中和羥基自由基(羥基自由基是生物體毒性最強的自由基),儘管氫氣也可以中和亞硝酸陰離子,但作用比較弱。該文章發表後,迅速引起國際上的廣泛關注,大批臨床和基礎醫學學者迅速跟進,到現在已經有63個疾病類型被證明可以被氫氣有效治療。每年氫氣生物學文章數量,如2007年3篇、2008年15篇、2009年26篇、2010年50篇、2011年63篇、2012年95篇,呈現爆發式增長。氫氣的分子效應可在多種組織和疾病存在,例如大腦、脊髓、眼、耳、肺、心、肝、腎、胰腺、小腸、血管、肌肉、軟骨、代謝系統、圍產期疾病和炎症等。在上述這些器官、組織和疾病狀態中,氫氣對器官缺血再灌注損傷和炎症相關疾病的治療效果最顯著,有4篇文章涉及到惡性腫瘤。
二、氫氣治療疾病的病理生理學機制
目前關於氫氣治療疾病病理生理學機制主流觀點仍是氫氣的選擇性抗氧化,在選擇性抗氧化基礎上,人們相繼證明氫氣對各類疾病過程中的氧化損傷,炎症反應、細胞凋亡和血管異常增生等具有治療作用。活性氧在各類心腦血管疾病如中風和心肌梗死、代謝性疾病如糖尿病動脈硬化等人類重要急性和慢性疾病的病理生理進程中扮演了重要角色,它是分子氧在還原過程中的中間產物,包括以氧自由基形式存在和非氧自由基形式存在的兩大類物質,其中氧自由基又包括羥自由基、超氧陰離子、一氧化氮、亞硝酸陰離子等物質。生理情況下,活性氧在體內不斷產生,也不斷被清除,處於動態平衡。但在缺血、炎症等病理狀態下,機體將產生大量的活性氧。其中,羥自由基和過氧亞硝基陰離子毒性較強,是細胞氧化損傷的主要介質。而一氧化氮、超氧陰離子和過氧化氫等物質毒性較弱,具有重要的信號轉導作用。既往在抗氧化損傷的治療中,還原性過強的藥物可能導致機體氧化- 還原狀態出現新的失衡。2007 年Ohsawa等人研究證實,氫氣能夠選擇性清除毒性較強的羥自由基和亞硝酸陰離子,而對其它具有重要生物學功能、毒性較低的活性氧影響不大,此即氫氣的選擇性抗氧化作用。該作用為抗氧化治療提供了新的思路。早在2001 年,Gharib等人報導吸入8 個大氣壓的氫氣對肝臟血吸蟲感染引起的炎症反應具有治療作用,他們認為氫氣與羥自由基直接反應是氫氣抗炎作用的基礎。2009 年Kajiya等人報導氫氣能明顯抑制葡聚糖硫酸鈉誘發的結腸炎症反應,減少受損結腸的炎症因子水平,減輕炎症的病理損傷,改善預後。氫氣的抗炎作用與其抑制活性氧產生、中和羥自由基、抑制促炎因子釋放有關。另外,巨噬細胞在炎症反應和免疫調節中起重要作用,氫氣對巨噬細胞的調節為其抗炎作用奠定了基礎。孫學軍等2008 年的研究發現,氫氣能減少大鼠缺血缺氧模型的組織損傷,呼吸低濃度的氫氣可時間依賴性地減少凋亡酶Caspase-3和Caspase-12 的活性,減少凋亡陽性細胞數量,研究提示氫氣的作用與減少Caspase 依賴性凋亡有關。Kubota等報導使用含氫氣的水滴眼具有抗角膜血管增生的作用。
三、氫氣對中樞神經系統疾病的治療作用
氫氣生物學效應發現以來,氫氣對以腦血管疾病為代表和以老年性痴呆為代表的中樞神經系統疾功能紊亂都具有明顯的保護作用。
氫氣對腦血管病的治療作用
Ohsawa等2007年報導的呼吸氫氣對大鼠左大腦中動脈阻斷模型的治療作用後。孫學軍等很快證明呼吸氫氣對新生兒窒息引起的缺血缺氧性腦損傷具有理想的治療作用,發現氫氣對缺血缺氧性腦損傷後神經細胞凋亡酶活性有抑制作用,凋亡酶活性下降導致神經細胞凋亡減少,使神經細胞壞死減少。從而減輕了腦損傷,保護了成年後的腦功能。氫氣對心臟停跳引起的腦損傷具有保護作用,這進一步肯定了氫氣對缺血缺氧性腦損傷的保護作用。衣達拉奉是目前唯一被批准用於中風治療的抗氧化藥物,和單純使用衣達拉奉相比,氫氣聯合使用衣達拉奉上述核磁共振檢測指標均獲得更好的改善。美國Loma Linda神經外科研究所和南京醫科大學、浙江大學附屬醫院神經外科等三家實驗室先後報導氫氣呼吸和注射氫氣生理鹽水對腦出血和珠網膜下腔出血引起的早期腦損傷、神經細胞壞死、腦水腫和血管痙攣等具有理想的保護作用。
氫氣對神經退行性疾病的治療作用
巴金森病是腦幹神經核黑質內多巴胺神經元死亡引起的疾病,經常是許多其他神經退行性疾病如老年性痴呆的繼發表現。孫學軍等在模型製備前1周開始給動物隨意飲用氫氣飽和水,結果發現該治療可完全消除單側巴金森病症狀的發生。非治療組動物注射側多巴胺神經元數量比對照側減少到40.2%,而治療組僅減少到83%。即使在模型製備後3天開始給氫氣水治療,單側巴金森病症狀仍可以被抑制,但治療效果低於預先治療,神經元數量比對照側減少到76.3%。預先治療組動物在模型製備後48小時,紋狀體內代表多巴胺神經元末梢的酪氨酸羥化酶活性在模型對照組和治療組均顯著下降。Fujita等用MPTP誘導的小鼠巴金森病模型證明氫氣具有類似效應。研究結果表明,和其他如銀杏葉比較,氫氣具有更理想的治療效果。
四、氫氣對肝臟病的治療作用
氫氣在肝臟領域的套用研究十分突出,是早在2001年,法國潛水醫學領域就有學者希望證明氫氣的抗氧化作用,在馬賽法國著名飽和潛水設備公司COMEX SA的設備、技術和人員幫助下,他們開展了這一研究。讓感染了肝日本曼氏血吸蟲病的小鼠連續14天呼吸氫氧混合氣(氫氣濃度為87.5%,分壓為0.7 Mpa),觀察對小鼠肝臟功能、肝組織氧化損傷、纖維化和血液炎症反應等方面的影響,研究結果證明,連續呼吸高壓氫氣對肝臟血吸蟲病動物的肝組織損傷、炎症反應和後期的肝纖維化均有非常顯著的保護作用。Fukuda 等在2007 年製作了大鼠肝臟缺血再灌注的模型,通過對組織標本的HE 染色加MDA 加肝功能酶學檢測,發現氫氣療法對肝臟的缺血損傷有非常明顯的治療效果。2009 年時,哈佛大學口腔醫院的學者Kajiya 等在實驗中讓大老鼠喝下能產生氫氣的細菌,發現對伴刀豆球蛋白誘導的肝炎具有預防作用,如果用抗生素殺滅這些細菌,則抗肝炎的作用消失,這顯示了氫氣對肝炎的預防與治療作用。他們還證明,飲用氫氣飽和水對伴刀豆球蛋白誘導的肝炎具有類似的治療效果。同年,Tsai 等發現飲用富氫電解水可以保護小鼠四氯化碳誘導的肝臟損傷。中國學者孫漢勇等採用GalN/LPS,CCl4 和DEN 3 種肝損傷動物模型,通過檢測氫氣、活性氧水平,評價氧化損傷、細胞凋亡和炎性反應程度,發現腹腔注射氫氣生理鹽水對急性肝臟損傷、肝纖維化和肝臟細胞增生均具有顯著的抑制作用,同時細胞碉亡相關分子如JNK和caspase-3 活性下降,研究結果證明氫氣不僅能治療急性肝臟損傷,而且能治療肝硬化。劉渠等研究認為,腹腔注射氫氣生理鹽水通過提高肝臟抗氧化能力,抑制肝臟炎性反應能治療膽管阻塞後黃疸和肝損傷,這對臨床上的指導意義很大。對非酒精性脂肪肝的研究證明,長時間飲用氫氣水可以對抗高脂飲食引起的脂肪肝,不僅對肝臟功能、肝形態學如纖維化,而且對脂肪肝相關細胞內信號通路均有明顯的阻斷效應,該效果可以和傳統的治療脂肪肝的藥物吡格列酮(促進胰島素受體敏感性,降血脂)治療效果相嫣美。長期飲用氫氣水不僅可以對抗脂肪肝,而且可以顯著減少這種脂肪肝晚期轉化成肝癌的比例,也就是說可以減少脂肪肝發生肝癌的可能性。氫氣可以通過促進一種重要的信號分子FGF 21發揮減肥和治療脂肪肝的效果。氫氣在肝臟疾病的臨床研究十分缺乏,最近韓國學者Kang 等對49例接受放射治療的惡性肝癌病人,採用隨機安慰劑對照方法,給病人在放射治療期間飲用一定量的金屬鎂製備的氫氣水,通過對生活質量進行評價,發現該氫氣水可顯著提高肝癌病人放射治療後的生活量,同時可以降低血液中氧化應激指標。氫氣作為一種選擇性抗氧化物質,氫對肝臟缺血、藥物性肝炎、膽管阻塞引起的肝硬化、脂肪肝等多種類型的肝臟疾病具有有效和明顯的治療作用。
五、氫氣的臨床研究進展
到目前為至,先後有7個疾病臨床研究報導,分別是
二型糖尿病 、
代謝綜合症 、
血液透析 、
炎症 /線粒體肌肉病、
腦幹 缺血和放射治療副作用和系統性紅斑狼瘡。從世界衛生組織註冊的信息中可以發現,也有一些沒有發表論文的臨床研究。這些研究報告顯示氫氣在人體脂代謝和糖代謝中的關鍵的調節作用。
天然氣 用氣電共生改良後需要15
. 9百萬立方米的
瓦斯 ,如果每天生產500公斤由改裝的加油站就地生產(例如高科技加氣站),相當於改裝777
, 000座加油站成本$1兆美金;可產每年1億5000萬噸氫氣。先假設不需額外氫氣分配系統的投資成本下;等於每GGE單位$3
. 00美元(Gallons of Gasoline Equivalent 相當一加侖汽油的能量簡稱GGE,方便和油價作比較)
核能 。
用以提供
電解水 的氫氣電能來源。需要240
, 000噸鈾礦—提供2
, 000座600兆瓦發電廠 等於$8400億美金,等於每GGE單位$2
.50 美元。
太陽能 用以提供電解水的氫氣電能來源。需要每平方公尺達2,500千瓦(每小時)效率的太陽能版科技共1億1300萬座40千瓦的機組,成本推估約$22兆 等於每GGE單位$9. 50美元。
氫能 化學元素氫(H——Hydrogen),在元素周期表中位於第一位,它是所有原子中最小的。眾所周知,氫分子與氧
分子化合成水,氫通常的單質形態是氫氣(H2),它是無色無味,極易燃燒的雙原子的氣體,氫氣是密度最小的氣體。在
標準狀況 (0攝氏度和一個
大氣壓 )下,每升氫氣只有0.0899克重——僅相當於同體積空氣品質的二十九分之二。氫是宇宙中最常見的元素,氫及其同位素占到了太陽總質量的84%,宇宙質量的75%都是氫。
氫具有高揮發性、高能量,是能源載體和燃料,同時氫在工業生產中也有廣泛套用。現在工業每年用氫量為5500億立方米,氫氣與其它物質一起用來製造氨水和化肥,同時也套用到汽油精煉工藝、玻璃磨光、黃金焊接、氣象氣球探測及食品工業中。
液態氫 可以作為
火箭燃料 ,因為氫的
液化溫度 在-253℃。
氫能在二十一世紀有可能在世界能源舞台上成為一種舉足輕重的二次能源。它是一種極為優越的新能源,其主要優點有:燃燒熱值高,每千克氫燃燒後的熱量,約為汽油的3倍,酒精的3.9倍,
焦炭 的4.5倍。燃燒的產物是水,是世界上最乾淨的能源。資源豐富,氫氣可以由水製取,而水是地球上最為豐富的資源,演繹了自然物質循環利用、持續發展的經典過程。
氫能簡介 二次能源是聯繫
一次能源 和能源用戶的中間紐帶。二次能源又可分為“過程性能源”和“含能體能源”。當今
電能 就是套用最廣的“過程性能源”;柴油、汽油則是套用最廣的“含能體能源”。由於目前“過程性能源”尚不能大量地直接貯存,因此汽車、輪船、飛機等機動性強的現代交通運輸工具就無法直接使用從
發電廠 輸出來的電能,只能採用像柴油、汽油這一類“含能體能源”。可見,過程性能源和含能體能源是不能互相替代的,各有自己的套用範圍。隨著,人們將目光也投向尋求新的“含能體能源”,作為二次能源的電能,可從各種一次能源中生產出來,例如煤炭、石油、天然氣、太陽能、
風能 、水力、
潮汐能 、
地熱能 、核燃料等均可直接生產電能。而作為二次能源的汽油和柴油等則不然,生產它們幾乎完全依靠化石燃料。隨著
化石燃料 耗量的日益增加,其儲量日益減少,終有一天這些資源將要枯竭,這就迫切需要尋找一種不依賴化石燃料的、儲量豐富的新的含能體能源。氫能正是一種在常規能源危機的出現、在開發新的二次能源的同時人們期待的新的二次能源。
風力 用以提供電解水的氫氣電能來源。 每秒7公尺的平均風速計算,需要1百萬座2百萬瓦風力機組成本約$3兆美金等於每GGE單位$3. 00美元。
生物燃油 氣化廠用氣電共生改良後.。需要15億噸乾燥
生物材料 ,3
, 300座廠房需要113
. 4百萬英畝(460
, 000 平方千米)農場提供生物材料。約$5650億美元 等於每GGE單位$1
. 90美元(假設土地不匱乏且地價最便宜狀態)
煤礦 火力發電 用氣電共生改良後提供電解水的氫氣電能來源。需要10億噸煤將近1
, 000座275兆瓦發電廠成本$5000億美金,等於每GGE單位1美元。
以上看出由煤礦的制氫最便宜,但是除非二氧化碳封存技術普及化及實用化,否則產生的高污染會使氫氣科技的環保性蕩然無存。
 氫氣
氫氣 氫的原子光譜
氫的原子光譜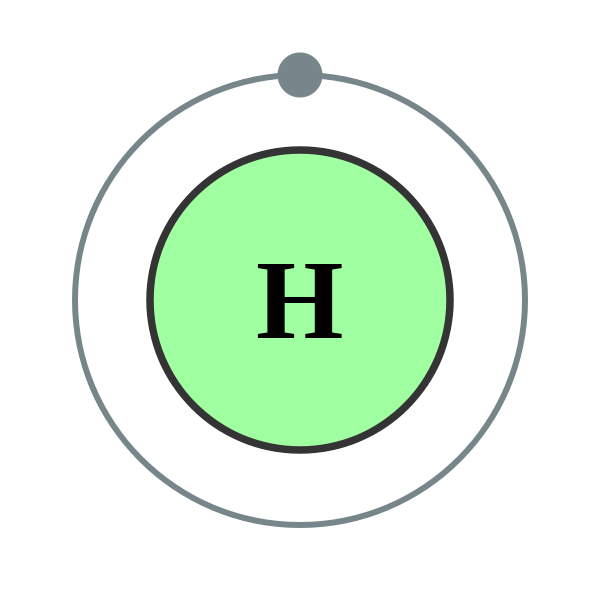 氫的同位素氕的電子排布
氫的同位素氕的電子排布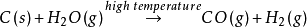
 啟普發生器
啟普發生器

