發現簡史
1772年由瑞典
藥劑師舍勒發現,後由法國科學家
拉瓦錫確定是一種元素。
 氮氣
氮氣1787年由拉瓦錫和其他法國科學家提出,氮的英文名稱nitrogen,是"
硝石組成者“的意思。中國清末化學家啟蒙者
徐壽在第一次把氮譯成中文時曾寫成“淡氣”,意思是說,它“沖淡”了空氣中的氧氣。
元素名來源於希臘文,原意是“硝石”。
含量分布
氮在地殼中的含量很少,自然界中絕大部分的氮是以單質分子氮氣的形式存在於大氣中,氮氣占空氣體積的百分之七十八。氮的最重要的礦物是硝酸鹽。
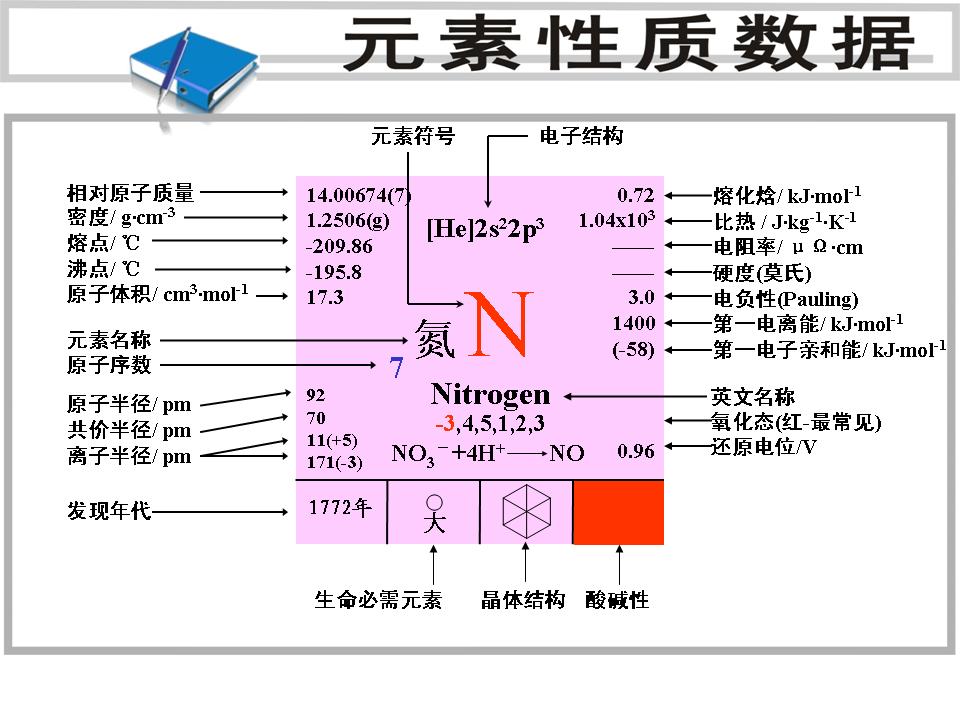 元素性質數據
元素性質數據氮在地殼中的重量百分比含量是0.0046%,總量約達到4×1012噸。動植物體中的蛋白質都含有氮。土壤中有硝酸鹽,例如KNO3。在南美洲智利有硝石礦(NaNO3),這是世界上唯一的這種礦藏,是少見的含氮礦藏。宇宙星際已發現含氮分子,如NH3、HCN等。
氮的豐度1.8×10占16位。自然界的氮有兩種同位素,分別為99.63%、0.365%。
同位素
| Z(p) | N(n) | 質量(u) | 半衰期 | 原子核自旋 | 相對豐度 | 相對豐度的變化量 |
|---|
7 | 3 | 10.04165(43) | 200(140)×10s [2.3(16) MeV] | (2-) | | |
7 | 4 | 11.02609(5) | 590(210)×10s [1.58(+75-52) MeV] | 1/2+ | | |
740(60) keV | 6.90(80)×10s | 1/2- | | |
7 | 5 | 12.0186132(11) | 11.000(16) ms | 1+ | | |
7 | 6 | 13.00573861(29) | 9.965(4) min | 1/2- | | |
7 | 7 | 14.0030740048(6) | 穩定 | 1+ | 0.99636(20) | 0.99579-0.99654 |
7 | 8 | 15.0001088982(7) | 穩定 | 1/2- | 0.00364(20) | 0.00346-0.00421 |
7 | 9 | 16.0061017(28) | 7.13(2) s | 2- | | |
7 | 10 | 17.008450(16) | 4.173(4) s | 1/2- | | |
7 | 11 | 18.014079(20) | 622(9) ms | 1- | | |
7 | 12 | 19.017029(18) | 271(8) ms | (1/2)- | | |
7 | 13 | 20.02337(6) | 130(7) ms | | | |
7 | 14 | 21.02711(10) | 87(6) ms | 1/2-# | | |
7 | 15 | 22.03439(21) | 13.9(14) ms | | | |
7 | 16 | 23.04122(32)# | 14.5(24) ms [14.1(+12-15) ms] | 1/2-# | | |
7 | 17 | 24.05104(43)# | <52 ns | | | |
7 | 18 | 25.06066(54)# | <260 ns | 1/2-# | | |
理化性質
物理性質
在室溫下不與空氣,鹼,水反應,加熱到3273K時,只有0.1%分解,因此,N2是化學特性物質,
氮的最重要的礦物是
硝酸鹽。氮有兩種天然
同位素:氮14和氮15,其中氮14的
豐度為99.625%。
 用途
用途氮氣為無色、無味的氣體。氮通常的單質形態是
氮氣。它無色無味無臭,是很不易有化學反應呈化學惰性的氣體,而且它不支持燃燒。
主要成分:
高純氮≥99.999%; 工業級 一級≥99.5%; 二級≥98.5%。
外觀與性狀:無色無臭氣體。
溶解性:微溶於水、乙醇。
主要用途:用於
合成氨,制
硝酸,用作物質保護劑,冷凍劑。
CAS號 | 7727-37-9。 |
熔點(℃) | -209.8 |
沸點(℃) | -195.6 |
相對密度(水=1) | 0.81(-196℃) |
相對蒸氣密度(空氣=1) | 0.97 |
| 1026.42(-173℃) |
臨界溫度(℃) | -147 |
臨界壓力(MPa) | 3.40 |
| 17.3 |
元素在太陽中的含量(ppm) | 1000 |
太平洋表面 | 0.00008 |
| Main N-3,N-2,N-1,N+1,N+2,N+3,N+4,N+5Other |
相對原子質量 | 14.0067 |
原子核虧損質量 | 0.109383u(u代表原子量) |
所屬周期 | 2 |
所屬族數 | VA |
| L2-K5 |
化學性質
N原子的
價電子層結構為2s
2p
3,即有3個成單電子和一對孤電子對,以此為基礎,在形成化合物時,可生成如下三種鍵型:
N原子有較高的電負性(3.04),它同電負性較低的金屬,如Li(電負性0.98)、Ca(電負性1.00)、Mg(電負性1.31)等形成二元
氮化物時,能夠獲得3個電子而形成N
3-離子。
N2+ 6Li = 2 Li3N
N2+ 3Mg =點燃= Mg3N2
N
3-離子的負電荷較高,半徑較大(171pm),遇到水分子會強烈
水解,因此的離子型化合物只能存在於乾態,不會有N
3-的
水合離子。
形成共價鍵
N原子同電負性較高的
非金屬形成化合物時,形成如下幾種共價鍵:
⑴N原子採取sp3雜化態,形成三個共價鍵,保留一對孤電子對,分子構型為三角錐型,例如NH3、NF3、NCl3等。
若形成四個共價單鍵,則分子構型為正四面體型,例如NH4+離子。
⑵N原子採取sp2雜化態,形成2個共價雙鍵和1個單鍵,並保留有一對孤電子對,分子構型為角形,例如Cl—N=O。(N原子與Cl 原子形成一個σ 鍵和一個π鍵,N原子上的一對孤電子對使分子成為角形。)
若沒有孤電子對時,則分子構型為三角形,例如HNO
3分子或NO
3-離子。硝酸分子中N原子分別與三個O原子形成三個
σ鍵,它的π軌道上的一對電子和兩個O原子的成單
π電子形成一個三中心四電子的不定域
π鍵。在硝酸根離子中,三個O原子和中心N原子之間形成一個四中心六電子的不定域
大π鍵。
這種結構使硝酸中N原子的表觀氧化數為+5,由於存在大π鍵,
硝酸鹽在常況下是足夠穩定的。
⑶N原子採取sp 雜化,形成一個共價叄鍵,並保留有一對孤電子對,分子構型為直線形,例如N2分子和CN-中N原子的結構。
形成配位鍵
N原子在形成單質或化合物時,常保留有孤電子對,因此這樣的單質或化合物便可作為電子對給予體,向金屬離子配位。例如[Cu(NH3)4]2+。
氮共有九種氧化物:一氧化二氮(N
2O)、
一氧化氮(NO)、一氧化氮二聚體(N
2O
2)、
二氧化氮(NO
2)、三氧化二氮(N
2O
3)、四氧化二氮(N
2O
4)、五氧化二氮(N
2O
5)、疊氮化亞硝醯(N
4O),第九種氮的氧化物三氧化氮(NO
3)作為不穩定的中間體存在於多種反應之中。
製備方法
氮在自然界主要以雙原子分子的形式存在於大氣中,因而工業上由液態空氣分餾來獲得氮氣。產品通常儲存在鋼瓶中出售。從空氣分餾得到的氮氣純度約為99%,其中含少量的氧氣、氬氣及水等雜質。
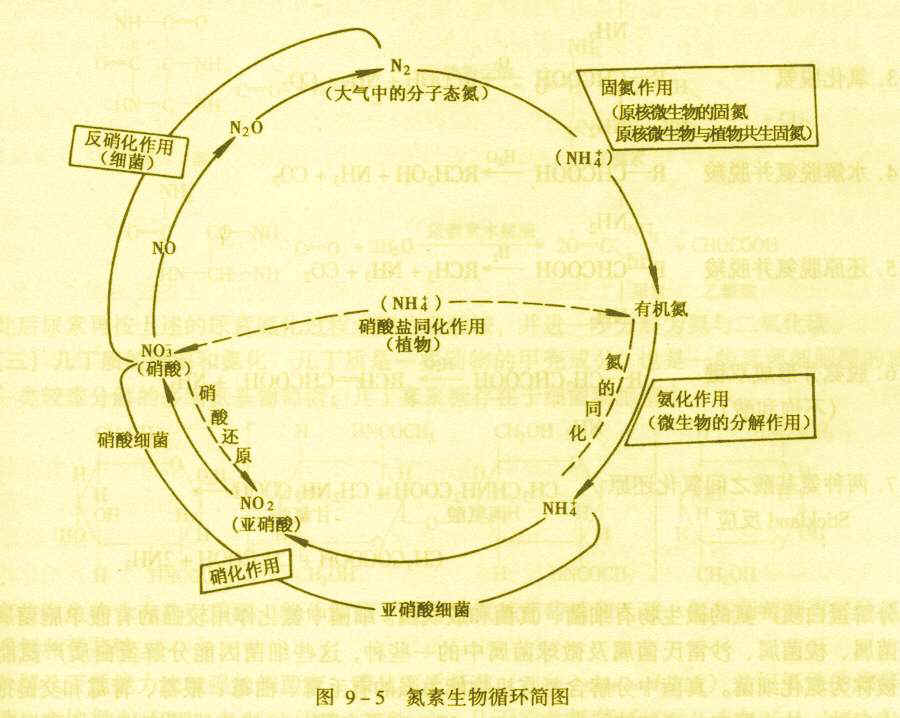 氮素生物循環圖
氮素生物循環圖藉由分餾液態空氣可獲得氮氣。
工業上用分餾液態空氣(沸點N2=62.93K,O2=90K,Ar=83K),可得純度為99%的“普氮”(其餘1%為O2及稀有氣體)。普氮純化得電子度為99.9%的高純氮。
實驗室製備少量氮氣的方法很多。例如,可由固體亞硝酸銨的熱分解來產生氮氣。
此反應劇烈,不易控制。故常採取在飽和亞硝酸鈉溶液中,滴加熱的飽和氯化鈉溶液,或直接溫熱飽和亞硝酸銨溶液的辦法來得到氮氣。這樣製得的氮氣含少量氨、一氧化氮、氧氣及水等雜質。
上述反應是爆發式的,但若加入硫酸鹽則可控制。
將氨氣通入溴水也能製備氮氣。經淨化除去少量氨、溴及水等雜質後,可得較純的氮氣。
氯氣也可氧化氨氣生成氮氣。
(過量氨氣繼續與氯化氫反應)
光譜純的氮氣則可由小心地加熱非常乾燥的疊氮化鋇或疊氮化鈉而製得。(反應劇烈,要注意控制溫度,加入緩釋劑)
套用領域
工業套用
氮的惰性廣泛用於電子、鋼鐵、玻璃工業者 性 蓋介質,還用於燈泡和膨脹橡膠的填充物,工業上用於保護油類、糧食、精密實驗中用作保護氣體。
氮在室溫時,能與許多直接化合,如、Li、Mg、Cia、Al、B等,反應生成氮化:
N2(g)+3Mg(s)→Mg3N(s)。
N2與O2在高溫(~2273K)或放電條件下直接化合N2+O2→2NO,這是固定氮的一種方法,估計地球上每年由“雷電合成”氮化合物達4~5億噸,而人工合成氮化合物1億噸左右。
生理作用
氮是植物生長的必需養分之一,它是每個活細胞的組成部分。植物需要大量氮。
 植物缺氮狀態
植物缺氮狀態氮素是葉綠素的組成成分,
葉綠素a和葉綠素ß都是含氮化合物。
綠色植物進行光合作用,使光能轉變為化學能,把
無機物(二氧化碳和水)轉變為有機物(葡萄糖)是藉助於葉綠素的作用。葡萄糖是植物體內合成各種有機物的原料,而葉綠素則是植物葉子製造“糧食”的工廠。氮也是植物體內維生素和能量系統的組成部分。
氮素對植物生長發育的影響是十分明顯的。當氮素充足時,植物可合成較多的蛋白質,促進細胞的分裂和增長,因此植物葉面積增長炔,能有更多的葉面積用來進行光合作用。
此外,氮素的豐缺與葉子中葉綠素含量有密切的關係。能從葉面積的大小和葉色深淺上來判斷氮素營養的供應狀況。在苗期,一般植物缺氮往往表現為生長緩慢,植株矮小,葉片薄而小,葉色缺綠髮黃。禾本科作物則表現為分孽少。生長後期嚴重缺氮時,則表現為穗短小,籽粒不飽滿。在增施氮肥以後,對促進植物生長健壯有明顯的作用。往往施用後,葉色很快轉綠,
生長量增加。但是氮肥用量不宜過多,過量施用氮素時,葉綠素數量增多,能使葉子更長久地保持綠色,以致有延長生育期、貪青晚熟的趨勢。對一些塊根、塊莖作物,如糖用
甜菜,氮素過多時,有時表現為葉子的生長量顯著增加,但具有經濟價值的塊根產量卻少得使人失望。
元素固定
由於氮是一種重要肥料,所以把氮氣轉化為氮的化合物的方法叫做
氮的固定。主要用於農業上。又分生物、自然、人工固氮3種。
一種固氮的方式是利用植物的根瘤菌根瘤菌是一種細菌,能使豆科植物的根部形成根瘤在自然條件下,它能把空氣中的氮氣轉化為含氮的化合物供植物利用。“種豆子不上肥,連種幾年地更肥”就是講的這個道理。
對植物影響
氮是構成蛋白質的主要成分,對莖葉的生長和果實的發育有重要作用,是與產量最密切的
營養元素。在第一穗果迅速膨大前,植株對
氮素的吸收量逐漸增加。
 氮肥
氮肥以後在整個生育期中,特別是結果盛期,吸收量達到最高峰。土壤缺氮時,植株矮小,葉片黃化,花芽分化延遲,花芽數減少,果實小,坐果少或不結果,產量低,品質差。氮素過多時,植株徒長,枝繁葉茂,容易造成大量落花,果實發育停滯,含糖量降低,植株抗病力減弱。番茄對氮肥的需要,苗期不可缺少,適當控制,防止徒長;結果期應勤施多施,確保果實發育的需要。
氮素是合成綠葉素的組成部分,葉綠素a和葉綠素b中都有含氮化合物。葉綠素是植物製造碳水化合物的工廠。氮素能合成蛋白質,促進細胞分裂和增長。
營養平衡
蛋白質在消化道內被分解為胺基酸和小分子
短肽,並被吸收,大部分用於合成組織蛋白,以供運動後被損肌肉組織的修復和生長,部分用於合成各種功能蛋白和蛋白質以外的含氮化合物,如
嘌呤,肌酸。部分胺基酸吸收後,在體內分解供能。
機體在完全不攝入蛋白質的情況下,體內的蛋白質仍然在分解與合成,一個60公斤體重的成年男子每日仍然會從尿,糞,皮膚及分泌物等途徑排出3.2克氮,相當於20克蛋白質。這種完全不攝入蛋白質時,機體不可避免的消耗氮量稱為“必要的氮損失”。這就是說一個60公斤體重的成年男子,每日至少要攝入20克優質蛋白質。才可以維持肌體內正常的
蛋白質代謝。
在一定的時間內,攝入的氮量和排出的氮量之間的關係,就稱之為“氮平衡”用以衡量人體蛋白質的需要量和評價人體肌肉蛋白質的狀況。
氮平衡有三種情況:
1.氮平衡:在一定的時間內,攝入的氮量與排出的氮量相等。則表示人體內蛋白質的合成與分解處在
平衡狀態,人體的肌肉圍度處於原來的圍度與水平。
2.正氮平衡:攝入氮量大於排出氮量,蛋白質的合成大於分解量,運動後被破壞的肌肉纖維就會迅速修復、增長。
3.負氮平衡:攝入的氮量小於排除的氮量,蛋白質的合成小於分解,此時人體的肌肉蛋白為保證機體活動進行分解供能,肌肉處於消減狀態。
注意事項
安全防護:氮元素以單質(氮氣)形式存在時無毒,以化合物形式存在時常常有毒,典型的比如說
氨、
亞硝酸根等。
接觸氮氣時無需特別防護,接觸液氮時需注意防止凍傷。
 元素性質數據
元素性質數據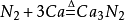
 氮素生物循環圖
氮素生物循環圖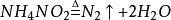
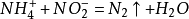
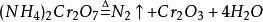

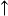
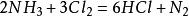
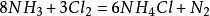

 植物缺氮狀態
植物缺氮狀態
 氮氣
氮氣 用途
用途 氮肥
氮肥