基本介紹
- 中文名:胺
- 英文名:Amines
- 化學式:RNH2;RNHR';RN(R')R''
- 原理:氨分子中的氫被烴基取代而生成
- 合成:鹵化物氨解
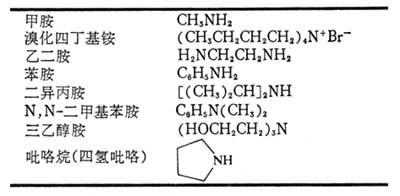
胺的分類
 胺
胺物化性質
胺的合成
胺的製法
 胺
胺胺的套用
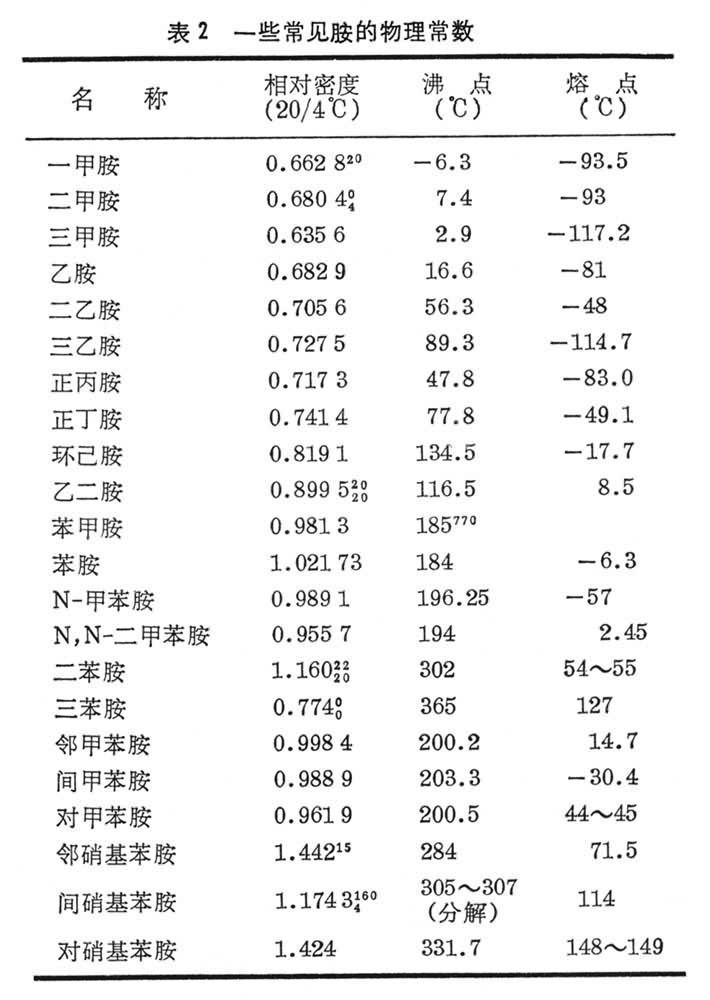 胺
胺命名
胺的結構
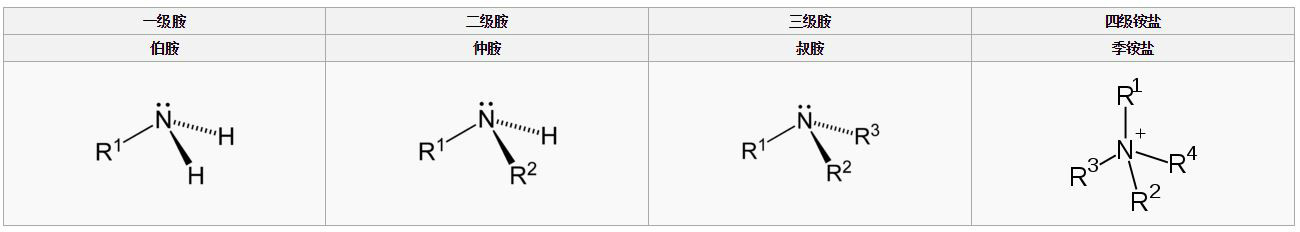 胺的結構
胺的結構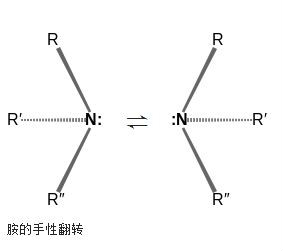 胺的手性翻轉
胺的手性翻轉
 胺
胺 胺
胺 胺
胺 胺的結構
胺的結構 胺的手性翻轉
胺的手性翻轉胺的釋義:氨分子中的一個或多個氫原子被烴基取代後的產物,稱為胺,根據胺分子中氫原子被取代的數目,可將胺分成伯胺、仲胺、叔胺;氨分子中的氫被烴基取代而...
N,N-二乙基乙胺 三乙基胺 Et3N 化學式 C6H15N 分子量 101.19 CAS登錄號 121-44-8 EINECS登錄號 204-469-4 熔點 -114.8℃ 沸點 89.5℃ 水...
組織胺(Histamine)是一種活性胺化合物。作為身體內的一種化學傳導物質,可以影響許多細胞的反應,包括過敏,發炎反應,胃酸分泌等,也可以影響腦部神經傳導,會造成人體想...
乙醇胺是一種有機化合物,又稱2-氨基乙醇、2-羥基乙胺或一乙醇胺,英文縮寫ETA或MEA,化學式C2H7NO,是一種伯胺有機化合物。具有吸濕性、毒性、可燃性和腐蝕性...
二乙醇胺,化學藥劑,中文名稱 2,2'-二羥基二乙胺,二乙醇胺;雙羥乙基胺;2,2`-亞氨基雙乙醇:英文縮寫DEA。 無色粘性液體或結晶。有鹼性,能吸收空氣中的...
口服無效。靜脈滴注時在肝、腎及血漿中單胺氧化化酶和兒茶酚氧位甲基轉移酶迅速降解為無活性化合物,作用時間短暫。約25%劑量可在腎上腺素神經末梢代謝為去甲...
有機胺一般是指有機類物質與氨發生化學反應生成的有機類物質。分為七大類,脂肪胺類、醇胺類、醯胺類、脂環胺類、芳香胺類、萘系胺類、其它胺類等。...
苯胺是生產農藥的重要原料,由苯胺可衍生N-烷基苯胺、烷基苯胺、鄰硝基苯胺、環己胺等,可作為殺菌劑敵銹鈉、拌種靈、殺蟲劑三唑磷、噠嗪硫磷、喹硫磷,除草劑甲...
多胺是一類含有兩個或更多氨基的化合物,其合成的原料主要為鳥氨酸和精氨酸,關鍵酶是鳥氨酸脫羧酶和精氨酸脫羧酶。最普遍也是有重要生理功能的多胺是腐胺,屍胺,...
環己胺是一種有機化合物,屬於脂肪族胺。純的環己胺是無色液體,但胺類物質通常因混有雜質而帶有顏色,環己胺也不例外。它帶有魚腥味,混溶於水,水溶液呈弱鹼性,...
無色液體。有魚腥胺氣味。相對密度0.8647(25/25℃)。沸點134.5℃。凝固點-17.7℃。折射率1.4565(25℃)。能與水和一般有機溶劑混溶。能隨水蒸氣揮發,並...
三亞乙基四胺的CAS號是112-24-3,分子式是C6H18N4,其具有強鹼性和中等粘性的淺黃色液體。三亞乙基四胺除作溶劑外,還用於製造環氧樹脂固化劑、金屬螯合劑以及合成...
生物胺(biogenic amine,BA)是一類具有生物活性含氮的低分子量有機化合物的總稱。可看作是氨分子中1-3個氫原子被烷基或芳基取代後而生成的物質,是脂肪族,酯環...
胺液是一類有機鹼溶液的統稱,通常指的是在脫硫脫碳化工過程中用於吸收硫化氫或二氧化碳的弱鹼性有機胺溶劑,以醇胺類較多,常見的包括有一乙醇胺(MEA),二乙醇胺(...
胺化是指向有機物分子中引入氨基(-NH2)生成胺的反應過程,有時也稱氨解。最常用的胺化劑是氨水、氨氣和液氨,有時也用碳酸氫銨、尿素、伯胺和仲胺等。...
即三(2-羥乙基)胺,可以看做是三乙胺的三羥基取代物。與其他胺類化合物相似,由於氮原子上存在孤對電子,三乙醇胺具弱鹼性,能夠與無機酸或有機酸反應生成鹽。2017...
果糖胺是血漿中的蛋白質在葡萄糖非酶糖化過程中形成的一種物質,由於血漿蛋白的半衰期為17天,故果糖胺反映的是2-3周內的血糖水平。...
二甲胺在室溫下是氣體。高濃度有類似氨的氣味,低濃度的有爛魚味。相對密度0.680(0℃)。熔點-92.2℃。沸點7℃。易溶於水,溶於乙醇和乙醚。易燃燒。有弱...
叔胺是指在分子中有與三個烴基連線的三價基的胺。叔胺用途非常廣泛,可作為配製產品的組分,又可作為各種專用化學衍生物的中間產品,是生產季銨鹽的重要原料。...
1-十二胺,1-Dodecylamine,分子式:C12H27N,分子量:185.35,CAS號:124-22-1,本品有毒,能刺激皮膚,會引起亞急性皮炎,對中樞神經有一定的刺激作用。生產設備應...
二乙基胺是危險化學品。主要用於有機合成和環氧樹脂固化劑。本品具有強烈刺激性和腐蝕性。吸入本品蒸氣或霧,可引起喉頭水腫、支氣管炎、化學性肺炎、肺水腫;高...
長春胺是從夾竹桃植物長春花(Vincami-norL)中提取的一種生物鹼,目前已可半合成,為一腦血管擴張劑。可用於治療腦動脈硬化、腦梗死等。...
精胺是含有兩個氨基和兩個亞氨基的多胺類物質,在生物體內由腐胺(丁二胺)和S-腺苷蛋氨酸經多種酶催化後生成。它與亞精胺都存在於細菌和大多數動物細胞中,是...
吲達帕胺藥典標準品名中文名稱:吲達帕胺 英文名稱:Yindapa'anIndapamide分子式與分子量C16H16ClN3O3S 365.83來源(名稱)、含量(效價)本品為N-(2-甲基-...
聚醚胺(PEA):是一類主鏈為聚醚結構,末端活性官能團為胺基的聚合物。端氨基聚醚具有以下結構:x, y = 0 - n。聚醚胺是通過聚乙二醇、聚丙二醇或者乙二醇/丙二醇...
畢卡魯胺(Bicalutamide)是一個非激素類雄激素受體拮抗劑和純抗雄激素。...... 畢卡魯胺(Bicalutamide)是一個非激素類雄激素受體拮抗劑和純抗雄激素。...
作為胍鹽、三聚氰二胺類的原料用雙氰胺與酸反應,可製造各種胍鹽。雙氰胺和苯基腈反應得到的苯代三聚氰二胺是塗料,層壓板、成型粉的中間體。...
白色吸濕性結晶粉末或無色有光澤的菱形結晶體,可燃。熔點263℃,如超過此熔點即升華並分解,但不熔融。有害物成分六亞甲基四胺 CAS No. 100-97-0。...
