基本介紹
- 中文名:離子半徑
- 外文名:ionic radius
- 拼音:li zi ban jing
簡介
概述
離子半徑大小的判斷方法
離子半徑的測定
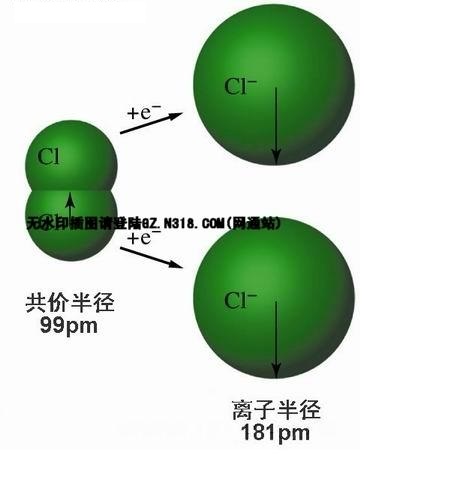
離子半徑是描述離子大小的參數。取決於離子所帶電荷、電子分布和晶體結構型式。設r陽為陽離子半徑,r陰為陰離子半徑。r陽+r陰=鍵長。r陽/r陰與晶體類型有關。...
原子半徑(Atomic Radius)是描述原子大小的參數之一。根據不同的標度和測量方法,原子半徑的定義不同,常見的有軌道半徑,范德華半徑(也稱範式半徑),共價半徑,金屬...
鈉離子是由鈉原子失去最外層的一個電子得到的,顯正1價,書寫為Na+。鈉是一種質地軟、輕、蠟狀而極有伸展性的銀白色的IA族的鹼金屬元素。...
“有效離子拉莫爾半徑”是天文學專有名詞,effective ion Larmor radius為其外文名。...
離子極化理論是離子鍵理論的重要補充。離子極化理論認為:離子化合物中除了起主要作用的靜電引力之外,誘導力起著很重要的作用。離子本身帶電荷,陰、陽離子接近時,在...
鎂離子是由鎂原子失去最外層的兩個電子得到的,書寫為Mg²+。...... 鎂離子是由鎂原子失去最外層的兩個電子得到...原子半徑:1.72 埃 離子半徑:0.66(+2) ...
離子對是指帶相反電荷的離子由於庫侖力的作用而短暫鬆弛結合的締合體。當兩個帶不同電荷的離子彼此接近到一定距離時,它們之間的靜電引力大於熱運動力,形成一種締...
離子晶格(ionic crystal lattice)是晶體結構中質點間的結合以離子鍵占主導地位的晶格。組成離子晶格的質點是離子(包括絡離子),陽離子大多具有中等數值(6左右)的配...
離子電位(ionic potential)表示離子吸引或排斥對方電荷的能力,是衡量離子電場強度的一個參數。...
分子中兩個相鄰但不成鍵的原子靠近至一定距離時,可構想原子本身的推斥力範圍為一剛性球體,這一球體的半徑稱為范德瓦耳斯半徑。...
多數鹽類鹼類和金屬氧化物的晶體結構都是離子晶體結構。典型的離子晶體是元素周期表中I A族的鹼金屬元素Li,Na,K,Rb,Cs和VI A的鹵族元素F,CI,Br,I之間形成的...
離子液體(或稱離子性液體)是指全部由離子組成的液體,如高溫下的KCI, KOH呈液體狀態,此時它們就是離子液體。在室溫或室溫附近溫度下呈液態的由離子構成的物質,稱...
在絡合單元中,金屬離子位於絡離子的幾何中心,稱中心離子(有的絡合單元中也可以是金屬原子)。如[Cu(NH3)4]2+絡離子中的Cu2+離子,[Fe(CN)6]3-絡離子中的...
究其原因,鋰-鎂對角線規則可以用周期表中離子半徑的變化來說明,同一周期從左到右,離子半徑因有效電荷的增加而減少,同族元素自上而下離子半徑因電子層數的增加而...
晶格能是指在標準狀況下,使離子晶體變成氣態正離子和氣態負離子時所吸收的能量,它是度量晶格穩定性的參數。影響晶格能大小的因素有離子半徑、離子電荷以及離子的電子...
電荷高的晶格能大,電荷一樣時看離子半徑和,離子半徑之和小的晶格能大。晶格晶格取代 編輯 在粘土礦物晶體中,一部分陽離子被另外陽離子所置換,而晶體結構不變,...
