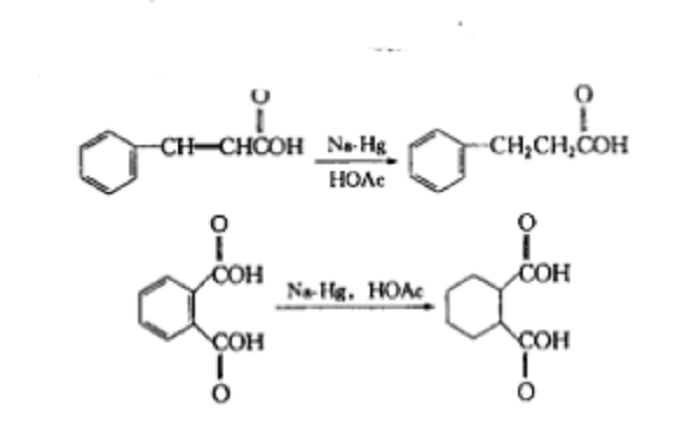
簡介
溶解金屬的還原是活潑金屬和羥基溶劑釋放出的“新生態氫”與被還原分子進行還原反應。事實上,還原時產生氫氣是一個不利的、不希望發生的副反應。溶解金屬還原本質是“內部的”電解還原。在這一過程中,一個電子從金屬表面(或從溶液的金屬)轉換到待還原的有機分子上,或者這個電子也可能從某些金屬較低價態的離子轉移出來到被還原的有機分子中,使其成為“負離子自由基”,這時如遇到供質子劑即取得質子而成為自由基,自由基再從金屬表面取得一個電子,則形成負離子,負離子再從供質子劑取得質子而完成還原反應。
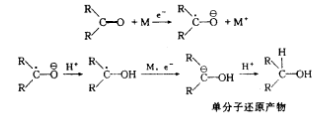
若負離子
自由基形成後,不遇到供質子劑,則可以二聚成為雙負離子,此時再與供質子劑相遇,就形成“雙分子還原”的產物。因此這類還原的本質是金屬提供電子,形成負離子自由基,還原反應必須有供質子試劑存在。如酮的還原,其過程可表示如下,反應中金屬的電子遷移到羰基上,分兩步進行:
 反應方程式
反應方程式一般來說,反應主要生成立體異構體中最穩定的一種醇。
一般的溶解金屬還原
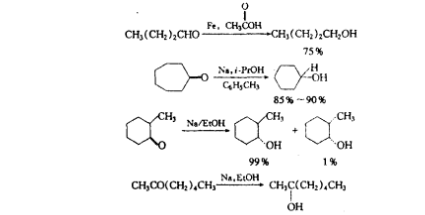
溶解金屬還原可還原許多官能團。用得最多的是羰基、酯基、硝基及芳核化合物的還原。醛酮的羰基可通過與各種金屬在質子溶液中反應被還原,醛被還原為伯醇,酮被還原為仲醇。還原酮的較方便的方法之一是使用鈉和異丙醇在甲苯中回流。用金屬進行酮的還原反應具有立體化學上的優點,即較穩定的醇經常是(但並不總是)主要產物。
 反應方程式
反應方程式酯基一般被還原為醇。在LiAlH4出現前,用金屬鈉一醇將酯還原為一級醇是最常用的方法,非共軛的碳碳雙鍵一般對這些還原條件是惰性的。用金屬還原的優點之一是它能選擇性地還原二酸的單酯的酯基部分。羧酸鹽一般不能被鹼金屬的液氨溶液還原。然而鋰在較高沸點的溶劑—甲胺或乙胺所形成的溶液中也可將羧酸鹽還原為醛的衍生物。
但這些反應常常由於發生競爭的Dieckmann關環反應,或在水解之前存在烯二醇雙負離子的不穩定性而複雜化。這個問題可用下述方法得到部分解決:使二元酸酯在三甲基氯矽烷存在的情況下進行羥酮縮合反應,生成比較穩定的烯二醇,雙-矽烷醚,後者經分離和隨後用酸性水解仰得到羥基酮。三甲基氯矽烷也能迅速地與羥酮縮合中生成的金屬烷氧基化合物作用而除去這些破,這些鹼正是競爭的Dieckmann關環反應的
催化劑。
鹼金屬在液氨或胺中的還原
鹼金屬的液氨溶液用來還原共軛雙烯、α,β-不飽和酮、苯乙烯類化合物及苯環這樣一些具有共軛體系的化合物。還可以作為氫解試劑對芳醚、硫醚等化合物進行氫解。對於具有雙取代的塊鍵,也可立體選擇性地將叄鍵部分還原為相應的反式烯烴,成為炔鍵催化氫化的補充方法。催化氫化主要生成順式的烯烴。
Birch還原的主要用途是將芳香族化合物還原成脂肪族化合物,而且不同於催化氫化,還原產物不是飽和的脂肪族化合物,而是1,4-二氫術生物,這種六元脂環衡生物是合成很多天然產物的原料,已廣泛用於萜類、甾體、生物鹼和某些昆蟲激索的合成。鹼金屬如鋰、鈉、鉀等可以在液氨中溶解,形成金屬離子和“溶劑化的電子”。這種溶劑化的電子具有很強的還原能力。除液氨外,有機胺如甲胺、乙胺、二甲胺等對有機物有較大的溶解能力和較高沸點,因此也可作為效果更好的溶劑,有利於反應開始階段的進行。在鹼金屬中鋰在液氨中的溶解度最大,鉀次之,鈉的溶解度最小。反應中必須加供質子劑如醇、水等。
鋅汞齊鹽酸還原
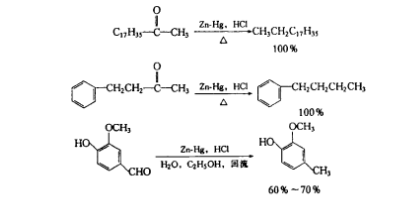
鋅汞齊-鹽酸可將羰基還原為亞甲基,是專用還原劑,這就是著名的Clemmensen還原反應。一般使用濃鹽酸做溶劑,一些對酸敏感的化合物,不宜用此法還原。由於羰基化合物在濃鹽酸中溶解度不好,所以常加共落劑如乙酸、乙醇、二氧六環或其他惰性溶劑,在反應中,其羰基被鋅汞齊和鹽酸還原為亞甲基。
酮類Clemmensen還原的主要對象,產率往往比較多。例如:
 反應方程式
反應方程式 反應方程式
反應方程式 反應方程式
反應方程式 反應方程式
反應方程式