基本介紹
- 中文名:相對原子質量
- 外文名:Relative atomic mass
- 別稱:相對原子量
- 提出者:道爾頓
- 套用學科:化學
定義
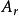
發展
特點
國際規定
計算方法
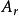
質量概念
| 原子序數 | 元素名稱 | 化學符號 | 相對原子質量 | 註腳腳註 |
|---|---|---|---|---|
1 | hydrogen 氫 | [1.007 84; 1.008 11] | m | |
2 | helium 氦 | 4.002 602(2) | g r | |
3 | lithium 鋰 | [6.938; 6.997] | m | |
4 | beryllium 鈹 | 9.012 182(3) | ||
5 | boron 硼 | [10.806; 10.821] | m | |
6 | carbon 碳 | [12.0096; 12.0116] | ||
7 | nitrogen氮 | [14.006 43; 14.007 28] | ||
8 | oxygen 氧 | O | [15.999 03; 15.999 77] | |
9 | fluorine 氟 | 18.998 4032(5) | ||
10 | neon 氖 | 20.1797(6) | g m | |
11 | sodium 鈉 | 22.989 769 28 (2) | ||
12 | magnesium鎂 | 24.3050(6) | ||
13 | aluminium (aluminum) 鋁 | 26.981 538 6 (8) | ||
14 | silicon矽 | [28.084; 28.086] | ||
15 | phosphorus 磷 | P | 30.973 762(2) | |
16 | sulfur 硫 | [32.059; 32.076] | ||
17 | chlorine 氯 | [35.446; 35.457] | m | |
18 | argon 氬 | Ar | 39.948(1) | g r |
19 | potassium 鉀 | K | 39.0983(1) | |
20 | calcium 鈣 | Ca | 40.078(4) | g |
21 | scandium 鈧 | Sc | 44.955 912(6) | |
22 | titanium 鈦 | Ti | 47.867(1) | |
23 | vanadium 釩 | V | 50.9415(1) | |
24 | chromium 鉻 | Cr | 51.9961(6) | |
25 | manganese 錳 | Mn | 54.938 045(5) | |
26 | iron 鐵 | Fe | 55.845(2) | |
27 | cobalt 鈷 | Co | 58.933 195(5) | |
28 | nickel 鎳 | Ni | 58.6934(4) | r |
29 | copper 銅 | Cu | 63.546(3) | r |
30 | zinc 鋅 | Zn | 65.38(2) | r |
31 | gallium 鎵 | Ga | 69.723(1) | |
32 | germanium 鍺 | Ge | 72.63(1) | |
33 | arsenic 砷 | As | 74.921 60(2) | |
34 | selenium 硒 | Se | 78.96(3) | r |
35 | bromine 溴 | Br | 79.904(1) | |
36 | krypton 氪 | Kr | 83.798(2) | g m |
37 | rubidium 銣 | Rb | 85.4678(3) | g |
38 | strontium 鍶 | Sr | 87.62(1) | g r |
39 | yttrium 釔 | Y | 88.905 85(2) | |
40 | zirconium 鋯 | Zr | 91.224(2) | g |
41 | niobium 鈮 | Nb | 92.906 38(2) | |
42 | molybdenum 鉬 | Mo | 95.96(2) | g |
43 | technetium* 鎝 | Tc | ||
44 | ruthenium 釕 | Ru | 101.07(2) | g |
45 | rhodium 銠 | Rh | 102.905 50(2) | |
46 | palladium 鈀 | Pd | 106.42(1) | g |
47 | silver 銀 | Ag | 107.8682(2) | g |
48 | cadmium 鎘 | Cd | 112.411(8) | g |
49 | indium 銦 | In | 114.818(3) | |
50 | tin 錫 | Sn | 118.710(7) | g |
51 | antimony 銻 | Sb | 121.760(1) | g |
52 | tellurium 碲 | Te | 127.60(3) | g |
53 | iodine 碘 | I | 126.904 47(3) | |
54 | xenon 氙 | Xe | 131.293(6) | g m |
55 | caesium (Cesium) 銫 | Cs | 132.905 451 9 (2) | |
56 | barium 鋇 | Ba | 137.327(7) | |
57 | lanthanum 鑭 | La | 138.905 47(7) | g |
58 | cerium 鈰 | Ce | 140.116(1) | g |
59 | praseodymium 鐠 | Pr | 140.907 65(2) | |
60 | neodymium 釹 | Nd | 144.242(3) | g |
61 | promethium* 鉕 | Pm | ||
62 | samarium 釤 | Sm | 150.36(2) | g |
63 | europium 銪 | Eu | 151.964(1) | g |
64 | gadolinium 釓 | Gd | 157.25(3) | g |
65 | terbium 鋱 | Tb | 158.925 35(2) | |
66 | dysprosium 鏑 | Dy | 162.500(1) | g |
67 | holmium 鈥 | Ho | 164.930 32(2) | |
68 | erbium 鉺 | Er | 167.259(3) | g |
69 | thulium 銩 | Tm | 168.934 21(2) | |
70 | ytterbium 鐿 | Yb | 173.054(5) | g |
71 | lutetium 鑥 | Lu | 174.9668(1) | g |
72 | hafnium 鉿 | Hf | 178.49(2) | |
73 | tantalum 鉭 | Ta | 180.947 88(2) | |
74 | tungsten 鎢 | W | 183.84(1) | |
75 | rhenium 錸 | Re | 186.207(1) | |
76 | osmium 鋨 | Os | 190.23(3) | g |
77 | iridium 銥 | Ir | 192.217(3) | |
78 | platinum 鉑 | Pt | 195.084(9) | |
79 | gold 金 | Au | 196.966 569(4) | |
80 | mercury 汞 | Hg | 200.59(2) | |
81 | thallium 鉈 | Tl | [204.382; 204.385] | |
82 | lead 鉛 | Pb | 207.2(1) | g r |
83 | bismuth 鉍 | Bi | 208.980 40(1) | |
84 | polonium* 釙 | Po | ||
85 | astatine* 砹 | At | ||
86 | radon* 氡 | Rn | ||
87 | francium* 鍅 | Fr | ||
88 | radium* 鐳 | Ra | ||
89 | actinium* 錒 | Ac | ||
90 | thorium* 釷 | Th | 232.038 06(2) | g |
91 | protactinium* 鏷 | Pa | 231.035 88(2) | |
92 | uranium* 鈾 | U | 238.028 91(3) | g m |
93 | neptunium* 鎿 | Np | ||
94 | plutonium* 鈽 | Pu | ||
95 | americium* 鎇 | Am | ||
96 | curium* 鋦 | Cm | ||
97 | berkelium* 錇 | Bk | ||
98 | californium* 鐦 | Cf | ||
99 | einsteinium* 鑀 | Es | ||
100 | fermium* 鐨 | Fm | ||
101 | mendelevium* 鍆 | Md | 202 | |
102 | nobelium* 鍩 | No | ||
103 | lawrencium* 鐒 | Lr | ||
104 | rutherfordium*鑪 | Rf | ||
105 | dubnium*釒杜 | Db | ||
106 | seaborgium*釒喜 | Sg | ||
107 | bohrium*釒波 | Bh | ||
108 | hassium*釒黑 | Hs | ||
109 | meitnerium*釒麥 | Mt | ||
110 | darmstadtium*鐽 | Ds | ||
111 | roentgenium*錀 | Rg | ||
112 | copernicium*鎶 | Cn | ||
113 | ununtrium* | Uut | ||
114 | Flerovium*鈇 | Fl | ||
115 | ununpentium* | Uup | ||
116 | Livermorium*鉝 | Lv | ||
118 | ununoctium* | Uuo |
常用原子量
| 核電荷數 | 元素名稱 | 元素符號 | 相對原子質量 |
|---|---|---|---|
1 | 氫 | H | 1 |
2 | 氦 | He | 4 |
6 | 碳 | C | 12 |
7 | 氮 | N | 14 |
8 | 氧 | O | 16 |
9 | 氟 | F | 19 |
10 | 氖 | Ne | 20 |
11 | 鈉 | Na | 23 |
12 | 鎂 | Mg | 24 |
13 | 鋁 | Al | 27 |
14 | 矽 | Si | 28 |
15 | 磷 | P | 31 |
16 | 硫 | S | 32 |
17 | 氯 | Cl | 35.5(只能寫成35.5) |
18 | 氬 | Ar | 40 |
19 | 鉀 | K | 39 |
20 | 鈣 | Ca | 40 |
25 | 錳 | Mn | 55 |
26 | 鐵 | Fe | 56 |
29 | 銅 | Cu | 63.5(可寫64或63.5) |
30 | 鋅 | Zn | 65 |
47 | 銀 | Ag | 108 |
53 | 碘 | I | 127 |
56 | 鋇 | Ba | 137 |
78 | 鉑 | Pt | 195 |
79 | 金 | Au | 197 |
80 | 汞 | Hg | 201 |

