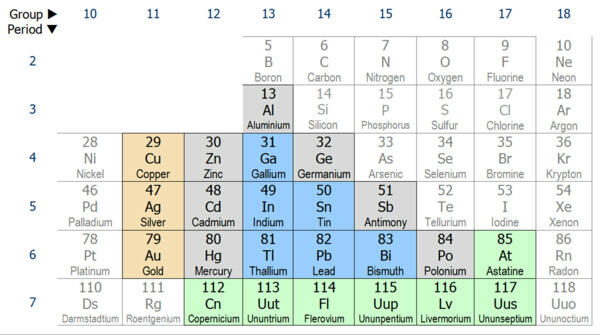
適用元素
通常包括在這一類別中的有第13-15族的金屬:鎵、銦、鉈、錫、鉛和鉍。有時包括其它元素,比如銅,銀和金(通常被認為是過渡金屬);鋅,鎘和汞(其否則認為是過渡金屬);和鋁,鍺,砷和銻(後者其中三個通常被認為是準金屬)。砹,通常分類為非金屬或準金屬,已預測到具有金屬的晶體結構。如果是這樣,這將是一個後過渡金屬。元件113-117可以是後過渡金屬;量它們的不足已被合成,以允許它們的實際的物理和化學性質的研究。
哪些元素開始被算作後過渡金屬取決於,在元素周期表上,在那裡過渡金屬結束拍攝。在20世紀50年代,大多數無機化學教科書定義的過渡元素在完成10組(
鎳,
鈀和
鉑),因此不包括組11(
銅,
銀和
金),和第12族(
鋅,
鎘和
汞)。化學書於2003年的一項調查表明,過渡金屬,在任何一組11或組12結束了大致相等的頻率。當後過渡金屬最終取決於所在的類金屬或非金屬啟動。硼,矽,鍺,砷,銻和碲被公認是準金屬;其他作者治療某些上述元素為非金屬的部分或全部。
理由
後過渡金屬的削弱金屬性質,主要是由於增加的核電荷橫跨周期表去,從左至右。在核電荷的增加受到越來越多的電子的,但由於這些是部分地抵消在空間分布的每一個額外的電子沒有充分篩選在核電荷每個連續增加,後者因此支配。對於某些不規則性,原子半徑契約,電離能量增加,電子的較 少數目變得可用於金屬接合,和“離子[變得]更小,更偏振,更容易產生共價。”這種現象在周期4-6後過渡金屬更加明顯,由於其核電荷通過其C低效篩選和(在周期6族金屬的情況中)的F電子構型;電子的篩選功率在序列s> P> D> F越小。的減少原子尺寸由於d-和F塊的感嘆詞被稱為,分別'scandide'或'd區收縮',和“
鑭系收縮“。相對論效應也是“增加的結合能”,因此電離能,電子在“6s能殼牌在黃金和水銀,以及6P外殼期六的後續元素”
起源
術語的由來
後過渡金屬是不清楚。早期使用記錄戴明,在1940年,在他的著 名的本書
基礎化學。他對待過渡金屬截至整理組10(
鎳,
鈀和
鉑)。他提到了隨後的元素在周期4〜6周期表(銅鍺;銀銻;金釙)它們的底層的D -in視圖電子構型,如後過渡金屬。
描述化學
11族
該組11的金屬典型地分類為給定它們可以形成離子與不完全的d殼過渡金屬。物理上,它們具有相對低的熔點,並與後過渡金屬相關的高電負性值。“填充的ð子外殼和自由s的Cu,Ag和Au的電子有助於其高的電和熱傳導性。過渡金屬對之間組11經歷相互作用左側s電子和部分地填充ð子外殼較低的電子遷移率“。在化學上,該集團11金屬在他們的+1價態顯示相似的其他後過渡金屬;他們偶爾會歸為此類。
銅是一種軟金屬(MH 2.5-3.0)具有低的機械強度。它有一個密堆積面心立方結構(BCN 12)。常常以+2價形成穩定的化合物,而銅處於+1其較少優選的氧化狀態(Cu2O,CuCl,CuBr,CuI和CuCN來製備)有顯著的共價性質。的氧化物(氧化銅)是兩性的,帶為主的基本性能;它可以融合與鹼金屬氧化物(M2O; M =鈉,鉀)得到陰離子(M2CuO2。)銅形式Zintl階段,如Li7CuSI2和M3Cu3SB4(M = Y,鑭,鈰,鐠,釹,釤,釓,鋱,鏑,鈥,鉺或)。
銀是一種軟金屬(MH 2.5-3)具有低的機械強度。它有一個密堆積面心立方結構(BCN 12)。的銀的化學由其+為主1價態,其中它顯示了大致相似的物理和化學性質來鉈,主族金屬,在相同的氧化態的化合物。它往往在它的大部分化合物共價鍵合。的氧化物(銀2O)是兩性的,與基本屬性為主。銀形成了一系列oxoargentates(M的3的AgO2,M =鈉,鉀,銣)。這是Zintl階段,如李的組成2AGM (M =鋁,鎵,銦,鉈,矽,鍺,錫或鉛)和Yb3銀2。
金是一種軟金屬(MH 2.5-3),容易變形。它有一個密堆積面心立方結構(BCN 12)。金的化學由其+為主3價態;金特性的共價鍵的所有這些化合物中,。如做其穩定1化合物金氧化物(金2ö3)是兩性的,用酸性質為主;它形成陰離子hydroxoaurates M [金(OH)4],其中M =鈉,鉀,/2巴,鉈;和aurates如NaAuO2。黃金是Zintl階段,如M的組成2AUBI(M =鋰或Na);李2管理資產額(M =中,鉈,鍺,鉛,錫)和Ca5金4。
12族
在組12的過渡金屬(鋅,鎘和汞),史密斯觀察到,“教科書作家一直覺得難以處理這些元素”。有物理金屬性的突然和顯著減少從組11組12。他們的化學反應是主族元素。化學書2003年的調查表明,他們被視為要么過渡金屬或主上大約50/50基礎組元素。的IUPAC紅皮書注意到,儘管該組3-12的元件通常被稱為過渡元素,該組12個元素不總是包括在內。該組12個元素不滿足IUPAC金皮書的過渡金屬的定義(比的情況下,其他的汞在4K)。
鋅是一種軟金屬(MH 2.5)具有差的機械性能。它具有晶體結構(BCN 6 + 6),其稍微從理想失真。許多鋅化合物顯著共價的性質。鋅的氧化物的+2,即氧化鋅和Zn(OH)其首選的氧化態2,是兩性;它形成的強鹼性陰離子的解決方案鋅酸鹽。鋅形成Zintl階段,如LiZn,NaZn13和BaZn13。高度純化的鋅,在室溫下,是延性。它反應與潮濕空氣,以形成一薄層碳酸鹽,防止進一步的腐蝕。
鎘是一種軟的,可延展的金屬(MH 2.0),該發生顯著的變形,在負荷下,在室溫下,一樣的鋅,其具有的晶體結構(BCN 6 + 6),其稍微從理想失真。鎘的鹵化物,除氟化物,顯示出一個大致共價性質鎘的氧化物中的2,即氧化鎘和CdOH其優選氧化狀態2,是弱兩性;它形成在強鹼性溶液cadmates。鎘形式Zintl階段,如LiCd,RBCD13和CSCD13。當在空氣中加熱到幾百度,鎘表示毒性危險,由於鎘蒸氣的釋放;加熱時在空氣中它的沸點(僅高於1000K時,725℃; 1340 F; CF鋼〜2700 K,2425℃; 4400 F),鎘蒸汽氧化,'以紅黃色火焰,分散作為潛在的致命的CdO顆粒的氣溶膠。“鎘是在空氣中和在水中穩定,否則,在環境條件下,由一層氧化鎘的保護。
汞是一種液體,在室溫下進行。它具有所有的最弱的金屬接合,其結合能(61千焦/摩爾)和熔點所示(-39℃),一起,是最低的所有金屬元素。固體汞(MH 1.5)具有一個扭曲的晶體結構,具有混合金屬共價鍵合,和一個6 BCN“所有的[組12]的金屬,但特別是汞,趨向於形式的共價,而不是離子化合物“。中的汞及其優選氧化態的氧化物(氧化汞; 2)是弱兩性的,為的是同類硫化物硫化汞。它形成陰離子thiomercurates(如Na2硫化汞2和BaHgS3)在強鹼性溶液。它形成或是Zintl相如NaHg和K的一部分8在10汞柱。汞是一種相對惰性的金屬,幾乎沒有形成氧化物在室溫下.
13族
鋁,有時並不算作一個後過渡金屬。它具有很好的保護[氖]惰性氣體的核心,而不是不那么禁止[氬] 3D,[KR】4D或[氙] 4F5D核心的後過渡金屬。鋁離子結合其高電荷的小半徑使它強偏振物種,容易發生共價。
鋁以純的形式是一種軟金屬(MH 3.0)具有低的機械強度。它有一個緊密堆積結構(BCN 12)示出的部分定向粘接一些證據。它具有低的熔點(剛剛超過一半的鋼)和高的熱導率。其強度被減半,在200℃,而對於它的許多合金的是最小的,在300℃。的鋁限制它的使用,以在不要求防火保護的情況下,後三種性質或必須提供增加防火保護。它鍵共價在它的大部分化合物;具有兩性氧化物;並能形成陰離子鋁酸鹽。鋁形成Zintl階段,如LIAL,鈣
3的Al
2銻
6,和的SrAl
2。氧化物的薄保護層賦予耐蝕性的合理程度。這是易感於低pH值的攻擊(<4)和高(> 8.5)的pH條件下,一種現象,即通常是在商業純鋁和鋁合金的情況下更為顯著。鑒於許多這些屬性和其鄰近的金屬和非金屬之間的分界線。,鋁是偶爾分類為非金屬儘管它的缺點,它具有良好的強度-重量比和優異的延展性;其機械強度可顯著與使用合金化添加劑得到改善;其非常高的熱導率可放於良好的使用
散熱器和
熱交換器;,它具有高的導電性。在較低溫度下,鋁增加其變形強度(如大多數材料),同時保持延展性(如做面心立方金屬一般)。在化學上,體鋁是強正電性的金屬,具有高的負電極電位。
鎵是一種軟的,脆性金屬(MH 1.5)熔化在僅幾度高於室溫。它有一個不尋常的晶體結構具有混合金屬共價鍵合和低對稱性(BCN 7即1 + 2 + 2 + 2)這鍵共價在它的大部分化合物中,具有兩性氧化物;,並能形成陰離子的鎵酸鹽。鎵形成Zintl相如Li2嘎7,K3Ga的13和YbGa2。這是緩慢氧化在潮濕空氣中,在環境條件;氧化物構成的保護膜可以防止進一步的腐蝕。
銦是一種柔軟的,高韌性的金屬(MH 1.0)具有低的拉伸強度。,具有與不完全電離原子關聯的局部畸變的結晶結構(BCN 4 + 8)。銦的傾向'...,以形成共價化合物是影響其電化學行為的更重要特性之一'。將在3其優選氧化態銦的氧化物,即在2ö3和In(OH)3是弱兩性;它形成陰離子indates在強鹼性溶液。銦形成Zintl階段,如LiIn,鈉2在和Rb2在3。銦不會在空氣中在環境條件下的氧化。
鉈是一種軟的,反應性金屬(MH 1.0),以至於它沒有結構的用途。它具有緊密堆積的晶體結構(BCN 6 + 6),但已被歸因於一個異常大的原子間距離鉈原子部分電離。儘管在1(主要是離子)氧化態化合物是越來越多,鉈具有在3(主要是共價)氧化態的明顯的化學,如在其硫屬化物和三鹵化看出。這是第13族元素的在室溫下用空氣進行反應,慢慢形成兩性氧化物鉈唯一一個2ö3。它形成陰離子thallates如鉈3TLO3,Na3Tl(OH)6,NaTlO2和KTlO2,並且是存在於所用鉈。在該化合物CSTL thallide陰離子鉈形式Zintl階段,如Na2Tl,Na2K21Tl19,CsTl和Sr5Tl3H·
14族
鍺是一種硬(MH 6),非常脆半金屬元素。它最初被認為是一個導電金屬很差,但具有的電子能帶結構的半導體。鍺通常被認為是一個
準金屬而不是金屬。如同碳(金剛石)和矽,它具有一個共價四面體晶體結構(BCN 4)。化合物在+4其優選氧化態是共價的。鍺形成的兩性氧化物,的GeO
2和陰離子鍺,諸如Mg
2的GeO
4。它形成Zintl階段,如LIGE,K
8戈
44和La
4戈
3。
錫是軟的,格外弱金屬(MH 1.5);。1厘米厚的棒將溫和手指壓力下容易彎曲,它的不規則配位結晶結構(BCN 4 + 2)的與不完全電離原子有關。的所有的14族元素的組成,其中它們在4,主要是共價化合物,氧化態;即使在2氧化態錫通常形成共價鍵。錫中的2,即的SnO和Sn(OH)其優選的氧化狀態的氧化物2,是兩性;它形成於強鹼性stannites的解決方案。以下13℃(55.4°F)的錫改變其結構,並成為“灰色錫',其具有相同的結構的金剛石,矽和鍺(BCN 4)。這種轉變將導致普通錫崩潰和瓦解以來,以及作為脆,灰白錫占地量,由於具有較低高效晶體堆積結構。田形成Zintl階段如Na4錫,BaSn,K8錫25和Ca31錫20。它在空氣良好的耐蝕性上考慮形成一層薄薄的保護氧化層。純錫有沒有結構的用途。這是用在無鉛焊料,以及作為固化劑的其它金屬,如銅,鉛,鈦和鋅的合金。
鉛是一種軟金屬(MH 1.5),在許多情況下,是不能支持其自身的重量。它有一個緊密堆積結構(BCN 12),但是,其具有異常大的原子間距離。被歸因於鉛原子的部分電離它形成了一個半共價氧化鈦的PbO2;一個共價鍵合硫醚PBS;共價鍵合的鹵化物;和一系列共價鍵合的有機鉛化合物,例如鉛(II)的硫醇的Pb(SC2ħ5)2,鉛四乙酸鉛(CH3CO2)4,並且一旦普遍,抗爆添加劑,四乙基鉛(CH3CH2)4鉛。中的鉛其優選氧化態的氧化物(PbO的; 2)是兩性;其形成在強鹼性溶液陰離子鉛酸鹽。鉛形式Zintl階段,如國家郵政局,鍶31鉛20,香格里拉5鉛3N和鐿3鉛20。它有合理的耐腐蝕性能好;在潮濕空氣中它形成的氧化物,碳酸鹽,硫酸鹽,阻礙進一步氧化的混合灰色塗層。
15族
砷是中等硬(MH 3.5)和脆性半 金屬元素。它通常被認為是一個準金屬,或通過一些其他作者,可以是金屬或非金屬。它具有導電性差哪像金屬,降低溫度。它具有一個相對開放的和部分共價晶體結構(BCN 3 + 3)。砷形成共價鍵與大多數其他元素。在其優選的氧化態的氧化物(如As2O3,3)是兩性的,為的是在水溶液中(H3ASO3)和同源物的硫化物(如As2S3)。砷形成了一系列陰離子砷酸鹽如Na的3麻生太郎3和PbHAsO4,和Zintl階段如Na3作為,鈣2As和SrAs3。
銻是一種軟(MH 3.0)和脆性半 金屬元素。它通常被認為是一個準金屬,或通過一些其他作者,可以是金屬或非金屬。它具有導電性差哪像金屬,降低溫度。它具有一個相對開放的和部分共價晶體結構(BCN 3 + 3)。銻形成共價鍵與大多數其他元素。在其優選的氧化態的氧化物(Sb的2ö3,3)是兩性的。銻形成一系列陰離子antimonites和銻酸鹽如NaSbO的2和AlSbO4,並且如K Zintl階段5的Sb4,SR2的Sb3和戰鬥雪地摩托部隊3。
鉍是略微放射性,軟金屬(MH 2.5),該太脆為任何結構的使用。它的開放式包裝的晶體結構(BCN 3 + 3)配有粘接是金屬和共價之間的中間。對於金屬,它具有非常低的電導率和熱導率。大多數鉍是共價性質的普通化合物。的氧化物,鉍2ö3是主要是基本的,但將作為在弱酸溫暖,很濃縮的KOH。也可與在空氣中的氫氧化鉀熔融,導致鉀鉍褐色物質。鉍的溶液化學的特徵在於含氧陰離子的形成;其形成陰離子bismuthates在強鹼性溶液。鉍形成Zintl階段,如NABI,的Rb7在4畢6和Ba11鎘8畢14。拜勒等人。指鉍作為是,鑒於其脆性質(和可能)'在其物理性質的至少“金屬”金屬“”所有金屬的最低導電性。“
16族
釙是一种放射性金屬,具有類似鉛的硬度。具有其特徵在於一個簡單閃石晶體結構(如通過電子密度計算確定)由部分定向接合,和6.這樣的結構的BCN通常會導致非常低的延展性和抗斷裂性然而釙已經預測為一個韌性金屬。它形成一個共價氫化物;。其鹵化物是共價的,揮發性化合物,類似那些碲釙在其優選的氧化狀態(PoO2; +4價)是主要是基本的,但兩性如果溶解在濃鹼性水溶液,或稠合在空氣氫氧化鉀。將黃色polonate(Ⅳ)離子PoO32-是已知的,低的Cl水溶液濃度和高pH。釙化物如Na2Po,BePo,ZnPo,CdPo和HgPo設有釙陰離子;除了HgPo這些是一些的釙化合物更穩定。
17族
砹是從來沒有見過一個放射性元素;一個可見的量會立即被由於其強烈的放射性汽化。有猜測,但是,這樣的現象可以是能夠以足夠的冷卻被防止。砹通常視為非金屬,不太常用的準金屬和偶爾作為金屬。不像它打火機同類碘,證據為雙原子砹是稀疏和不確定的。在2013年,相對論建模的基礎上,砹被預測為一單原子金屬,具有面心立方晶體結構。作為這樣,砹可以預期到具有金屬外觀;顯示金屬導電性;並具有優異的延展性,即使在低溫溫度。它也可以預期顯示顯著非金屬字元,因為是通常用於,或以,在p塊附近的金屬的情況。砹含氧陰離子ATO,ATO-2,ATO-3和ATO-4是已知的,。含氧陰離子的形成是非金屬的傾向。砹的氫氧化物在(OH)被推定為兩性砹形成共價化合物與非金屬,包括砹化氫的帽子和碳tetraastaide貓4。在。陰離子已經報導以形成astatides用銀,鉈,鈀和鉛Pruszyński等。注意,astatide離子應該形成具有強絡合物軟金屬陽離子,如汞,鈀,銀和Tl;他們列出以Hg(OH)在形成汞astatide。
B亞金屬
表面上看,在B亞組的金屬是在IB族周期表的VIB族的 金屬,利用當前的IUPAC nonmenclature對應到群組11至16。實際上,組11的金屬(銅,銀和金)通常會被視為過渡金屬(或有時為造幣金屬或貴金屬),而組12的金屬(鋅,鎘和汞)可以或可以不被視為乙子群的金屬取決於如果在組11或組12的“B”命名法來結束過渡金屬取(如在IB族,IIB族,等等)被取代於1988年,但仍偶爾在最近遇到的上文學作品。
的B亞組金屬顯示非金屬特性;這是在從組12移動到組16尤為明顯。雖然組11金屬具有正常緊密堆積的金屬結構它們顯示出在化學特性的重疊。在他們的+1化合物(穩定狀態的銀;少讓銅)他們是典型的B-亞金屬。在其2和3闡明它們的化學性質是典型的過渡金屬化合物。
邊緣金屬
教區寫道:“如預期”,組13的邊緣的金屬和14具有非標準的結構。鎵,銦,鉈,鍺,錫和在這方面特別提及。該組12金屬也注意到作為具有輕微扭曲的結構;這被解釋為弱方向性的證據(即共價鍵)鍵。
化學弱金屬
雷納-Canham和奧弗頓使用術語化學鍵弱的金屬是指接近金屬非金屬邊緣的金屬。這些金屬表現化學更像準金屬,特別是相對於陰離子物質形成。確定了它們的九個化學弱的金屬是berylllium,鋁,鋅,鎵,錫,鉛,銻,鉍,釙,
重金屬
范沃特分組元素周期表金屬成。輕金屬;B。重脆性金屬高熔點,C的含量。高熔點的重韌性金屬;ð。低熔點的重金屬(鋅,鎘,汞,鎵,銦,鉈,鍺,錫,砷,銻,鉍,以及釙),以及e。強大的,正電的金屬。布里頓,阿巴蒂耶洛和羅賓斯的'軟,熔點低講,在列中的重金屬LIB,ILIA,ⅣA,和周期表中,分別為鋅,鎘,汞的VA;鋁,鎵,銦,鉈;[思],鍺,錫,鉛;和Bi。薩金特-韋爾奇元素的圖組金屬為:輕金屬,鑭系;錒系列;重金屬(脆);重金屬(韌性);和重金屬(低熔點):鋅,鎘,汞,[CN];鋁,鎵,銦,鉈;鍺,錫,鉛,[FL]銻,鉍;和寶。
不典型金屬
Habashi基團的元素分為八個主要類別:[1]典型金屬(鹼金屬,鹼土金屬和鋁);[2]鑭系元素(鈰至鑥);[3]錒系元素(釷至鐒);[4]過渡金屬(鈧,釔,鑭,錒,4-10的族元素);[5]以下典型的金屬(11-12族,鎵,銦,鉈,錫和鉛);[6]類金屬(硼,矽,鍺,砷,硒,銻,碲,鉍和釙);[7]共價非金屬(H,C,N,O,P,S和鹵素);和[8]單原子非金屬(即惰性氣體)。
Metametals
所述metametals是鋅,鎘,汞,銦,鉈,錫和鉛。它們是延展性的元素,但是,相對於它們的金屬周期表的鄰居到左側,具有較低的熔點,較低的電和熱傳導性,以及從密堆積形式顯示的扭曲。有時,鈹和鎵被包括作為metametals儘管具有低延展性。
普通金屬
阿布里科索夫區分
普通金屬和
過渡金屬其中內殼未填寫。普通金屬具有較低的熔點和內聚能比過渡金屬的。格雷確定為普通金屬:鋁,鎵,銦,鉈,鉨,錫,鉛,鈇,鉍,鏌,和[鉝]。他補充說,“在現實中大部分的金屬,人們覺得作為普通的其實都是過渡金屬......”。
其他金屬
正如所指出的,金屬的過渡金屬和準金屬之間的周期表落下有時稱為其它金屬(也可參見,例如,Taylor等人)中。“其他”在這個意義上具有的相關的含義,現有之外,或者不同於,已經提到的“(即,鹼金屬和鹼土金屬,鑭系元素和錒系元素,和過渡金屬);'輔助';“輔助,次要”。據格雷應該有這些元素比“其它金屬”一個更好的名字。
P塊金屬
所述P塊的金屬是周期表中的組13-15(或16)的金屬。通常,這包括鋁,鎵,銦和鉈;錫和鉛;和鉍。鍺,銻和釙有時也包括在內,雖然前兩個是公認是準金屬。該p塊金屬趨向於具有該顯示低配位數和定向接合結構。共價明顯發現自己的化合物;其大部分氧化物是兩性的。
獨特的金屬
斯萊特把金屬“相當肯定,雖然不是完美的大幅'到普通金屬和特殊金屬後者邊緣上的非金屬。特有的金屬發生朝周期表中的行的端部,並且包括'約為:'鎵,銦和鉈;碳,矽'(兩者都具有某些金屬特性,儘管我們先前已經治療他們作為非金屬),'鍺和錫;砷,銻和鉍;和硒'(這部分是金屬的)'和碲。普通金屬有炫酷對稱的晶體結構而奇特的金屬都有涉及定向粘合結構。最近,約書亞觀察到特殊的金屬具有混合金屬共價鍵合。
可憐的金屬
法雷爾和Van Sicien使用術語窮金屬,為簡單起見,“來表示一用一顯著共價的,或定向性質。希爾和霍爾曼觀察到,“一詞窮金屬沒有被廣泛使用,但它是幾個金屬包括錫,鉛和鉍的有用描述。這些金屬倒在周期表的一個三角形塊體與過渡金屬的右側。它們通常是低活性的(電化學)系列,他們有一些相似之處非金屬“。Reid等。寫'窮金屬“是”,[A] n的舊術語為周期表中的組13-15是更柔軟,具有比傳統上用於工具的金屬更低的熔點的金屬元素。 “
半金屬
在現代的使用中,術語“半金屬”有時是指,鬆散或明確地,對金屬不完全金屬字在晶體結構中,導電性或電子結構。舉出
鎵,
鐿,
鉍,
汞和
鎿。類金屬,這是在兩者之間既不是金屬也不非金屬元素,也有時代替稱為半金屬。公認是準金屬元素是硼,矽,鍺,砷,銻和碲。在舊的化學,該出版物在1789年之前拉瓦澤的“革命”
基本上化學傷寒,一個半金屬是具有“非常不完善的延展性和可塑性'的金屬元素如鋅,汞或鉍。
過渡金屬
在歷史上,該過渡金屬系列“包括元素周期表其中'縮小差距”的非常陽電鹼和allkaline土金屬和電負性的非金屬的基團之間的那些元件:氮-磷,氧,硫,和鹵素“Cheronis,帕森斯和RONNEBERG寫道,“低熔點的過渡金屬形成的周期表塊:那些組II'B'[鋅,鎘,汞],III'B的'[鋁,鎵,銦,鉈]和鍺,錫和鉛中的IV族。這些金屬都具有低於425℃的熔點。“