基本信息
鋅(中文讀音:xīn),它的名稱“
zinc”來源於
拉丁文Zincum,意思是“白色薄層”或“白色沉積物”。
化學符號是Zn,它的
原子序數是30,
相對原子質量為65。鋅是一種銀白色略帶淡藍色
金屬,
密度為7.14克/立方厘米,熔點為419.5℃。在
室溫下,性較脆;100~150℃時,變軟;超過200℃後,又變乾。鋅的
化學性質活潑,在
常溫下的
空氣中,表面生成一層薄而緻密的
鹼式碳酸鋅膜,可
阻止進一步
氧化。當溫度達到225℃後,鋅
劇烈氧化。
 圖1 鋅
圖1 鋅理化性質
理化常數
相對原子量 圖5 鋅粒
圖5 鋅粒 鋅的性質
鋅是一種藍白色金屬。當溫度達到225℃後,鋅氧化激烈。鋅易溶於酸,也易從溶液中置換金、銀、銅等。鋅在
自然界中,多以
硫化物狀態存在。主要含鋅礦物是
閃鋅礦。也有少量氧化礦,如
菱鋅礦,如菱鋅礦和
異極礦。
原子半徑
原子半徑(計算值) 135(142)pm
共價半徑 131 pm
 圖6 鹼性鋅錳電池
圖6 鹼性鋅錳電池范德華半徑 139 pm
含量(ppm)
元素在太陽中的含量:2
晶體結構:密排六方體
原子核外電子排布:2,8,18,2
核電荷數:30
 圖7 安瓿中的鋅
圖7 安瓿中的鋅氧化態
主氧化態:+2
其它:+1
電離能(單位:kj/mol)
M - M+ 906.4
M+ - M2+ 1733.3
M2+ - M3+ 3832.6
M3+ - M4+ 5730
M4+ - M5+ 7970
M5+ - M6+ 10400
M6+ - M7+ 12900
M7+ - M8+ 16800
M8+ - M9+ 19600
M9+ - M10+ 23000
晶胞參數
a = 266.49 pm
b = 266.49 pm
c = 494.68 pm
α = 90°
β = 90°
| 豐度
| 半衰期
| 衰變模式
| 衰變能量MeV
| 衰變產物
|
64Zn
| 48.6%
| | 穩定
| | |
65Zn
| 人造
| 244.26天
| 電子捕獲
| 1.352
| 65Cu
|
66Zn
| 27.9%
| | 穩定
| | |
67Zn
| 4.1%
| | 穩定
| | |
68Zn
| 18.8%
| | 穩定
| | |
72Zn
| 人造
| 46.5小時
| β衰變
| 0.458
| 72Ga
|
其它屬性
常見的含有鋅的
合金:馬口鐵
---鍍錫薄鋼板;黃銅-
---鋅和銅的合金,早被古人利用。
黃銅的生產可能是
冶金學上最早的偶然發現之一。
體積 9.16×10^(-6) m3 /mol
聲速 3700 m/s(293.15K)
比熱容 390 J/(kg·K)
電導率 16.6×106/(m·Ω)
熱導率 116 W/(m·K)
莫氏硬度:2.5
熔化熱 7.322 kJ/mol
蒸氣壓 192.2 Pa(692.73K)
化學性質
鋅的化學性質與鋁相似,所以,通常可以由鋁的性質,推斷鋅的化學性質(兩性)。
單質鋅
2Zn+O2=====2ZnO (1273K)
Zn + 2NaOH==Na2ZnO2+H2↑
Zn+X2===ZnX2 (X=F、Cl、Br、I)(加熱條件下)
3Zn+2P====Zn3P2 (873K)
Zn+S===ZnS(加熱條件下)
Zn+4NH3+2H2O=====[Zn(NH3)4 ](OH)2+H2↑
Zn+2HCl===ZnCl2+H2↑
Zn+2H2SO4(濃)===ZnSO4+SO2↑+2H2O
Zn+H2SO4(稀)===ZnSO4+H2↑
氫氧化鋅
Zn(OH)2 + 2H+ == Zn2+ + 2H2O
Zn(OH)2 + 2OH- ==[ Zn(OH)4]2-
Zn(OH)2+4NH3H2O=(Zn(NH3)4)2+ +2OH- +4H2O
Zn(OH)2==ZnO+H2O
[Zn(NH3)4]2+ +2OH-== Zn(OH)2 + 4NH3↑
氯化鋅
ZnO+2HCl==ZnCl2+H2O
ZnCl2+2H2O===Zn(OH)Cl+2HCl (加熱條件下)
ZnCl2+2H2O=H2[ZnCl2(OH)2]
FeO+ H2[ZnCl2(OH)2]==Fe[ZnCl2(OH)]2+H2O
Zn+CuCl2=ZnCl2+Cu
硫化鋅
2ZnO+2S==2ZnS+O2↑
Zn2+ + (NH4)S ==ZnS + 2NH4+
ZnSO4+BaS==ZnS+BaSO4
Zn2+ + H2S ==ZnS + 2H+
硝酸鋅
1)Zn+4HNO3(濃)==Zn(NO3)2+NO2↑+2H2O
2)3Zn+8HNO3(較濃)==3Zn(NO3)2+2NO↑+4H2O
3)4Zn+10HNO3(稀)==4Zn(NO3)2+N2O↑+5H2O
4) 4Zn + 10HNO3(極稀) ==4Zn(NO3)2 + NH4NO3 + 3H2O
鋅的配合物
(a)[Zn(NH3)4]2+
(b) [Zn(CN)4]2-
製備方法
將鋅礦或閃鋅礦在空氣中煅燒成氧化鋅,然後用炭還原即得(純度較低);
或將氧化鋅和焦炭混合,在鼓風爐中加熱致1373K~1573K,使鋅蒸餾出來(純度約98%);
或用
硫酸浸出成
硫酸鋅後,通過控制PH,使鋅溶解為硫酸鋅而鐵砷銻等雜質水解轉化為沉澱進入浸出渣中,加入鋅粉除去濾液里的銅鎘等雜質,再用電解法將鋅沉積出來,後者所製取的鋅純度較高(約99.99%)。
發現歷史
鋅被
羅馬人所知,但很少使用。它第一次以其金屬自身被認可是在印度,在
拉賈斯坦邦的Zawar有一個鋅熔爐有大量的鋅,證明了大規模的精煉在1100年到1500年。
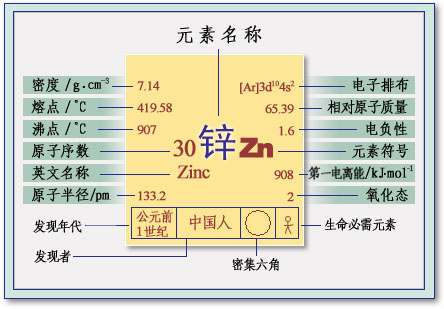 圖2 元素周期表中的鋅
圖2 元素周期表中的鋅鋅的大規模精煉在中國進行,於16世紀。東印度公司的船在瑞典的海岸沉沒,於1745年,其運載的貨物是中國的鋅,分析了回收的鑄錠證明了它們是幾乎純淨的金屬。
在1668年,佛蘭德的冶金家P. Moras de Respour,從氧化鋅中提取了金屬鋅,但歐洲認為鋅是由德國化學家Andreas Marggraf在1746年發現的,而且的確是他第一個確認了其是一種新的金屬。
歷史記載
鋅也是人類自遠古時就知道其
化合物的
元素之一。鋅礦石和銅熔化製得合金——
銅,早為古代人們所利用。但金屬狀鋅的獲得比銅、鐵、錫、鉛要晚得多,一般認為這是由於碳和鋅礦共熱時,溫度很快高達1000 ℃以上,而金屬鋅的沸點是906℃,故鋅即成為蒸氣狀態,隨煙散失,不易為古代人們所察覺,只有當人們掌握了冷凝氣體的方法後,
單質鋅才有可能被取得。
 圖4 鋅製品
圖4 鋅製品世界上最早發現並使用鋅的是中國,在10~11世紀中國是首先大規模生產鋅的國家。
明朝末年
宋應星所著的《
天工開物》一書中有世界上最早的關於煉鋅技術的記載。1750~1850年人們已開始用氧化鋅和硫化鋅來治病。
1869年Raulin發現鋅存在於生活機體中,並為生活機體所必需。1963年報告了人體的
鋅缺乏病,於是鋅開始列為人體必需營養素。鋅的生產過程非常簡單,將爐甘石(即菱鋅礦石)裝滿在陶罐內密封,堆成錐形,罐與罐之間的空隙用木炭填充,將罐打破,就可以得到提取出來的金屬鋅錠。
另外,我國化學史和
分析化學研究的開拓者王鏈(1888—1966)在1956年分析了唐、隋、明、清等古錢後,發現宋朝的紹聖錢中含鋅量高,提出中國用鋅開始於明朝嘉靖年間的正確的科學結論。鋅的實際套用可能比《
天工開物》成書年代還早。
資源分布
鋅的單一鋅礦較少,鋅礦資源主要是
鉛鋅礦。中國銅鋅礦資源比較豐富,全國除
上海、
天津、
香港外,均有鉛鋅礦產出。產地有700多處,保有鉛總儲量3572萬噸,居世界第4位;鋅儲量9384萬噸,居世界第4位。從省際比較來看,
雲南鉛儲量占全國總儲量17%,位居全國榜首。廣東、
內蒙古、甘肅、江西、湖南、四川次之,
探明儲量均在200萬噸以上。全國鋅儲量以雲南為最,占全國21.8%;內蒙古次之,占13.5%;其他如甘肅、廣東、廣西、湖南等省(區)的鋅礦資源也較豐富,均在600萬噸以上。鉛鋅礦主要分布在滇西
蘭坪地區、滇川地區、南嶺地區、秦嶺-
祁連山地區以及內蒙古
狼山-渣爾泰地區。從
礦床類型來看,有與花崗岩有關的花崗岩型(廣東
連平)、
夕卡岩型(湖南
水口山)、斑岩型(雲南
姚安)礦床,有與
海相火山有關的礦床(青海錫鐵山),有產於
陸相火山岩中的礦床(江西冷水坑和浙江五部鉛鋅礦),有產于海相
碳酸鹽(廣東
凡口)、
泥岩-碎屑岩系中的鉛鋅礦(甘肅西成鉛鋅礦),有產于海相或陸相砂岩和礫岩中的鉛鋅礦(雲南金頂)等。鉛鋅礦成礦時代從太古宙到新生代皆有,以古生代鉛鋅礦資源力量豐富。
市場狀況
金融危機之後各國紛紛推出救市計畫,各大央行也陸續釋放流動性,美國持續量寬、中國推出四萬億以促使經濟復甦,充裕的流動性使得金融屬性占據主要地位推升2010年鋅價不斷走高。《2013-2017年中國鋅行業競爭態勢及投資發展預測報告》,全球經濟趨於穩定,美國緩慢復甦,市場上關於QE3退出的預期逐漸增強,倘若美國經濟政策發生改變,美元將會走強,鋅價受其影響較大。但同時值得注意的是,經濟復甦也在一定程度上帶來需求恢復,兩種屬性的博弈將共同決定鋅價未來走勢。
美國金融危機後通過持續寬鬆的貨幣政策促進經濟和就業增長,儘管貨幣寬鬆政策的邊際效用遞減,但可以看到的是,美國GDP增速的低速增長和就業市場的緩慢好轉表明,美國經濟正在弱勢復甦。美國經濟復甦以及房地產市場的回暖帶動對鋅的需求上升,但這種弱勢復甦態勢仍比較脆弱,對鋅需求帶動也有限。
質量指標
等 級
| Zn(%)
| Cu(%)
| Pb(%)
| Fe(%)
|
1
| ≧55
| ≦0.8
| ≦1.0
| ≦6.0
|
2
| ≧53
| ≦0.8
| ≦1.0
| ≦6.0
|
3
| ≧50
| ≦1.0
| ≦1.5
| ≦8.0
|
4
| ≧48
| ≦1.0
| ≦1.5
| ≦12.0
|
5
| ≧45
| ≦1.5
| ≦2.0
| ≦12.0
|
6
| ≧43
| ≦1.5
| ≦2.0
| ≦12.0
|
7
| ≧40
| ≦2.0
| ≦2.5
| ≦14.0
|
8
| ≧40
| ≦2.0
| ≦2.8
| ≦18.0
|
產品用途
世界上鋅的全部消費中大約有一半用於
鍍鋅,約10%用於黃銅和青銅,不到10%用於
鋅基合金,約7.5%用於化學製品,約13%用於製造乾電池,以鋅餅、鋅板形式出現。國際鉛鋅研究組預測,2004年全球鋅消費量會比2003年的985萬t增長4.8%,2005年將再增長4.3%,預計2005年中國將占世界鋅消費總量的四分之一,它的消費增長的部分原因是鍍鋅鋼用量的增長。相比之下,美國可能只占全球鋅需求的十分之一。
(1)
鍍鋅有優良的抗大氣腐蝕性能,在常溫下表面易生成一層保護膜,因此鋅最大的用途是用於
鍍鋅工業。被主要用於鋼材和鋼結構件的表面鍍層(如鍍鋅板),廣泛用於汽車、建築、船舶、輕工等行業。21世紀後西方國家開始嘗試直接用鋅合金板做屋頂覆蓋材料,其使用年限可長達120-140年,而且可回收再用,而用鍍鋅鐵板作屋頂材料的使用壽命一般為5-10年。21世紀後,鋼帶熱浸鍍鋅量有顯著增長。
電鍍鋅也有使用,但該法一般用於較薄的鍍層和不同的
表面光潔度。使用含鋅粉的塗料是塗層的另一種方法;對於與水連續接觸的物體,如用於船舶、橋樑和近海油氣井架的大的鋼構件,只須和大的鋅塊連線,便可得到保護,不過鋅塊要定期更換。
(2)
鋅合金用於汽車製造和機械行業。鋅具有適用的機械性能。鋅本身的強度和硬度不高,但加入鋁、銅等合金元素後,其強度和硬度均大為提高,猶其是鋅銅鈦合金的出現,其綜合機械性能已接近或達到
鋁合金、黃銅、灰鑄鐵的水平,其抗蠕變性能也大幅度被提高。因此,鋅銅鈦合金已被廣泛套用於小五金生產中。主要為壓鑄件,用於汽車、建築、部分電氣設備、家用電器、玩具等的零部件生產。許多鋅合金的加工性能都比較優良,
道次加工率可達60%-80%。中壓性能優越,可進行深拉延,並具有自潤滑性,延長了模具壽命,可用釺焊或電阻焊或電弧焊(需在
氦氣中)進行焊接,表面可進行電鍍、塗漆處理,切削加工性能良好。在一定條件下具有優越性。
一般用於機械製造業。含少量鉛鎘等元素的鋅板可製成
鋅錳乾電池負極、印花鋅板、有粉腐蝕照相制板和膠印印刷板等。
鋅錳電池:鋅作為負極活性物質,兼作電池的容器和負極引電體,是決定電池貯存性能的主要材料。在鋅片中含有少量的鎘和鉛。鎘能增強鋅的強度,鉛能改進鋅的延展加工性能。鎘與鉛均能提高氫在鋅電極上的過電位,減少鋅電極的自放電,減緩鋅片的腐蝕和氫氣的釋放。鋅片中若含有Cu、Fe、Ni等,將降低H2在鋅電極上析出的過電位,加速電池在貯存過程中的自放電,因此這些有害雜質必須嚴格控制。
鋅空氣蓄電池:鋅空氣電池又稱鋅氧電池,是金屬空氣電池的一種。鋅空氣電池比能理論值是1350W·h/kg,最新的電池比能量已達到了230Wh/kg,幾乎是鉛酸電池的8倍。可見鋅空氣電池的發展空間非常大。鋅空氣電池一般採取抽換鋅電極的辦法進行“機械式充電”。更換電極的時間在幾分鐘即可完成。換上新的鋅電極,“充電”時間極短,非常方便。如此種電池得到發展,省去了充電站等社會保障設施的興建。鋅電極可在超市、電池經營點、汽配商店等購買,對普及此電池電動車十分有利。這種電池具有體積小,電荷容量大,質量小,能在寬廣的溫度範圍內正常工作,且無腐蝕,工作安全可靠。只是鋅電極在電解還原過程中,比較耗能,每噸氧化鋅還原成鋅需要消耗2500度電,所以用在電動汽車上,成本較高。試驗電池的電荷容量僅是鉛酸電池的5倍,不甚理想。但5倍於鉛酸電池的電荷量已引起了世人的關注,美國、墨西哥,新加坡及一些歐洲國家都已在郵政車、公共汽車、機車上進行試用,也是一極有前途的電動車用電池。
此外,鋅具有良好的抗電磁場性能。鋅的導電率是標準電工銅的29%,鋅板是一種非常有效的禁止材料,同時由於鋅是非磁性的,適合做儀器儀表零件的材料及儀表殼體及錢幣,同時,鋅自身及與其他金屬碰撞不會發生火花,適合作井下防爆器材。廣泛用於橡膠 、塗料、搪瓷、醫藥、印刷、纖維等工業。鋅具有適宜的化學性能。鋅可與NH
4CI發生作用,放出H
+正
離子。鋅-
二氧化錳電池正是利用鋅的這個特點,用
鋅合金做電池的外殼,既是電池
電解質的容器,又參加電池反應構成電池的陽極。它的這一性能也被廣泛地套用於醫藥行業。
鋅與酸或強鹼都能發生反應,放出
氫氣。
鋅肥(
硫酸鋅、
氯化鋅)有促進植物細胞呼吸、碳水化合物的代謝等作用。
鋅粉、
鋅鋇白、
鋅鉻黃可作顏料。
氧化鋅還可用於醫藥、橡膠、油漆等工業。
國內生產基地
中國鉛鋅業生產布局,依據鉛鋅
礦產地的分布和建設條件,經 40多年來的發展、建設,現已形成東北、湖南、兩廣、滇川、西北等五大鉛鋅採選冶和加工配套的生產基地,其鉛產量占全國總產量的85%以上,鋅產量占全國總產量的95%。
1.東北鉛鋅生產基地。東北地區是我國開發較早的鉛鋅生產基地之一。早在 50年代初期,其鉛產量占全國鉛產量的80%以上,在中國鉛鋅生產居於重要地位。東北基地以七礦兩廠為主,即
青城子鉛鋅礦、八家子鉛鋅礦、柴河鉛鋅礦(現已閉坑)、桓仁銅鋅礦、紅透山銅鋅礦、西林鉛鋅礦、天寶山鉛鋅礦和瀋陽冶煉廠、
葫蘆島鋅廠。七礦兩廠不僅是東北鉛鋅生產基地的支柱廠礦,也是培養造就科技人才的基地。六七十年代曾向全國新建的鉛鋅企業輸送大批具有實踐經驗的科技和管理人才以及生產技術工人,為中國鉛鋅業的發展做出了積極貢獻。
2.湖南鉛鋅生產基地。湖南鉛鋅礦產資源豐富,而且富礦多,大部分礦產地可開發利用。該基地鉛鋅廠礦是五六十年代建成的,由
水口山礦務局、桃林鉛鋅礦、
黃沙坪鉛鋅礦、東坡鉛鋅礦和
株洲冶煉廠等組成的湖南鉛鋅生產基地,是全國自產原料的全國最大的鉛鋅生產基地,在全國產量占有重要地位。
3.兩廣鉛鋅生產基地。廣東、廣西兩省區的鉛鋅資源豐富,兩省區是 70年代形成的我國大型鉛鋅生產基地之一。廣東以凡口鉛鋅礦和
韶關冶煉廠為主,其次是丙村鉛鋅礦、昌化鉛鋅礦、大尖山鉛鋅礦。廣西有泗頂鉛鋅礦、
大新鉛鋅礦、河三鉛鋅礦、柳州鋅品廠和大廠礦務局等。
4.滇川鉛鋅生產基地。雲南鉛鋅礦產資源十分豐富,鉛鋅
保有儲量均居全國之首。該基地鉛鋅企業也是五六十年代建成的,主要是會澤鉛鋅礦、瀾滄老廠鉛鋅礦和昆明冶煉廠、
箇舊雞街冶煉廠。雲南鉛鋅礦產資源具有廣闊的開發前景, 90年代開始興建超大型鉛鋅
礦床金頂礦山。四川有會東鉛鋅礦、會理鉛鋅礦兩個主要礦山以及一批中小型礦山,21世紀以來鉛鋅精礦產量猛增。
5.西北鉛鋅生產基地。西北地區鉛鋅礦產資源也很豐富,主要分布在甘
陝青三省,而且西成礦帶經勘查儲量又有大幅度的增長,資源前景十分可觀。該基地鉛鋅生產以
白銀有色金屬公司為主,有白銀廠小鐵山鉛鋅礦、第三冶煉廠和西北鉛鋅冶煉廠,陝西有鉛硐山鉛鋅礦、二里河鉛鋅礦、銀洞梁鉛鋅礦等和
青海錫鐵山礦務局。西北鉛鋅產量較少,但開發前景可觀。一是有豐富的鉛鋅礦產資源,位於甘陝交界的西成 -鳳太礦帶,經近20餘年勘查出10多個大中型鉛鋅銀
金礦床,其中廠壩-李家溝鉛鋅達到超大型規模,銀達到大型。二是廠壩正在抓緊建設一座大型礦山,將成為西北冶煉廠主要礦物原料供給基地,是全國大型鉛鋅礦山之一。
除上述五大鉛鋅生產基地外,內蒙古、江西、貴州等省區也建設了一批中小型礦山。其中內蒙古梧桐花鉛鋅礦、白音諾鉛鋅礦、
翁牛特旗硐子鉛鋅礦等礦山。內蒙古是全國生產鉛鋅
精礦主要省區之一,開發前景巨大。江西有
銀山鉛鋅礦等。貴州有赫章鉛鋅礦、杉樹林鉛鋅礦等。
產品危害
侵入途徑:吸入、食入。
吸入會引起口渴、乾咳、頭痛、頭暈、高熱、寒戰等。粉塵對眼有刺激性。口服刺激胃
腸道。長期反覆接觸對皮膚有刺激性。
安全措施
1.貯於陰涼乾燥處,遠離火種、熱源。
鋅與健康
鋅的生理功能
維持人體正常食慾
缺鋅會導致味覺下降,出現厭食、偏食甚至異食。
增強人體免疫力
鋅元素是免疫器官胸腺發育的營養素,只有鋅量充足才能有效保證胸腺發育,正常分化T淋巴細胞,促進細胞免疫功能。
鋅有幫助生長發育、智力發育、提高免疫力的作用,缺乏鋅會對我們的身體,特別是生長發育造成嚴重影響,所以,補充足夠的鋅是生長發育,智力發育必須的。平時除了飲食要均衡外,別忘了適當補充營養。
缺鋅症狀表現
兒童
味覺障礙:厭食、偏食或異食;
皮膚疾患:易患口腔潰瘍,受損傷口不易癒合,青春期痤瘡等;
生長發育不良:身材矮小、瘦弱;
免疫力下降,經常感冒、發燒;
孕婦
妊娠反應加重:嗜酸,嘔吐加重
宮內胎兒發育遲緩:導致早產兒、低體重兒
分娩合併症增多:產程延長、流產
推薦攝入量
年齡(歲) | RNI(mg) | UL(mg) |
0~ | 1.5 | |
0.5~ | 8.0 | 13 |
1~ | 9.0 | 23 |
4~ | 12.0 | 23 |
7~ | 13.5 | 28 |
| 男 女 | 男 女 |
11~ | 18.0 15.0 | 37 34 |
14~ | 19.0 15.5 | 42 35 |
18~ | 15.0 11.5 | 45 37 |
50 | 11.5 11.5 | 37 37 |
孕婦 | | 35 |
早期 | 11.5 | |
中期 | 16.5 | |
晚期 | 16.5 | |
乳母 | 21.5 | 35 |
 圖1 鋅
圖1 鋅 圖5 鋅粒
圖5 鋅粒 圖6 鹼性鋅錳電池
圖6 鹼性鋅錳電池 圖7 安瓿中的鋅
圖7 安瓿中的鋅 圖4 鋅製品
圖4 鋅製品
 圖2 元素周期表中的鋅
圖2 元素周期表中的鋅