基本介紹
- 中文名:氯化反應
- 外文名:chlorination;chloration
氯化一般指本詞條
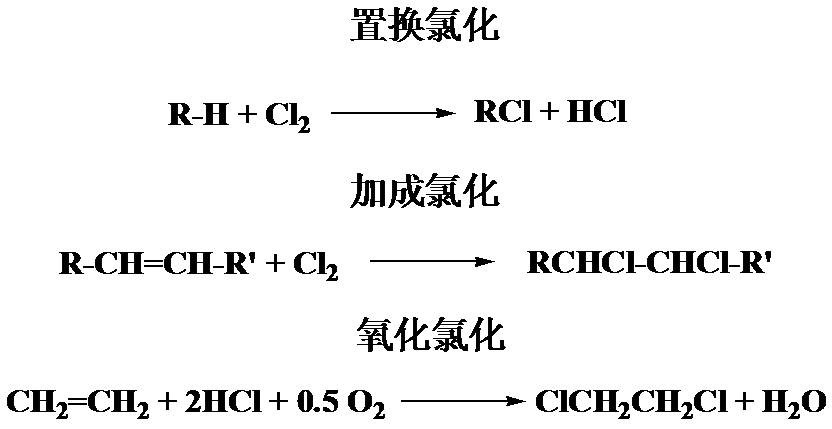
氯化反應一般指將氯元素引入化合物中的反應。在有機化學反應中,氯化反應一般包括置換氯化、加成氯化和氧化氯化;在冶金工業中,利用氯氣或氯化物提煉某些金屬也稱氯化;...
後氯化(post- chlorination)是指在沉澱過濾以後進行加氯的反應。氯是一種黃綠色氣體,當冷卻至-34.05℃或在15℃時加以0.6MPa(6個大氣壓)則形成琥珀色液體。在...
藥品別名克菌定含片;清利含片;利林喉片 ,氯化克菌定適應症預防和治療咽炎,喉炎,口炎,舌炎,牙齦炎,扁挑體炎及拔牙創面等口腔創傷的感染,還可以改善抽菸引起的咽部...
氯化劑是能促進有機物通過氯化反應增加氯原子的試劑。在有機化學反應中,氯化反應一般包括置換氯化、加成氯化和氧化氯化三個方面。在冶金工業中,氯化也指利用氯氣或...
氯化鋁(aluminium chloride)化學式為AlCl3,是氯和鋁的化合物。氯化鋁熔點、沸點都很低,且會升華,為共價化合物。熔化的氯化鋁不易導電,和大多數含鹵素離子的鹽類...
氯化聚乙烯,為飽和高分子材料,外觀為白色粉末,無毒無味,具有優良的耐候性、耐臭氧、耐化學藥品及耐老化性能,具有良好的耐油性、阻燃性及著色性能。韌性良好(在-30...
氯化鈷(cobaltous chloride),化學式CoCl2。為粉紅色至紅色結晶,無水物為藍色。微有潮解性,易溶於水、乙醇、乙醚、丙酮和甘油。用於分析試劑,濕度和水分的指示劑...
氯化碘(Iodine monochloride),也稱為一氯化碘。分子式為ICl,分子量為162.30。紅棕色液體或黑色結晶,結晶有兩種變體。不吸潮,但接觸空氣時能形成五氧化二碘。不...
氯化氫(HCl),一個氯化氫分子是由一個氯原子和一個氫原子構成的,是無色有刺激性氣味的氣體。其水溶液俗稱鹽酸,學名氫氯酸。相對分子質量為36.46。氯化氫極易...
氯化橡膠是指天然橡膠經氯化的產物。含氯量在65%的三氯化物和四氯化物的混合物。氯化橡膠與具有類似線性低極性的醇酸樹脂混容性好,一般含54%以上脂肪酸的醇酸...
氯化銨,簡稱氯銨。是指鹽酸的銨鹽,多為制鹼工業的副產品。含氮24%〜26%,呈白色或略帶黃色的方形或八面體小結晶,有粉狀和粒狀兩種劑型,粒狀氯化銨不易吸濕,...
氯化萘又稱多氯萘,多氯化萘(polychlorinated naphthalene,PCNs),是一類基於萘環上的氫原子被氯原子所取代的化合物的總稱,共有75種同類物。通式C10H8-nCln(n=1-...
2. 氯化亞碸——MSDS 3. 性質及用途——化工詞典 4. 氯化亞碸主要用途 .化化網[引用日期2014-04-05]詞條標籤: 科學百科其他分類 , 科學, 學科 圖集...
氯化鈉 (Sodium chloride),是一種離子化合物,化學式NaCl,無色立方結晶或細小結晶粉末,味鹹。外觀是白色晶體狀,其來源主要是海水,是食鹽的主要成分。易溶於水、...
氯化EVA又寫作CEVA,是EVA經氯氣氯化後的產物,EVA樹脂是乙烯和醋酸乙烯共聚物,具有良好的柔軟性和彈性,與其它材料的粘合性較好。...
主要用途及接觸機會:用氯化氰製備丙烯腈及甲基丙烯酸甲酯(丙酮氰醇法),其對氯化氰的使用量約占氯化氰總消耗量的2/3左右,故對這些行業尤應給予特別關注。除化工...
氯化石蠟是石蠟烴的氯化衍生物,具有低揮發性、阻燃、電絕緣性良好、價廉等優點,可用作阻燃劑和聚氯乙烯輔助增塑劑。廣泛用於生產電纜料、地板料、軟管、人造革、橡膠...
氯化作用chlorination '}l}i氯氣入水I}S,一般是用於水的消毒,有時也用於完成其它的生物學或化學作用。 ...
作為飼料添加劑,氯化膽鹼具有以下生理作用:可預防肝臟、腎臟中的脂肪積累及其組織變性;可促進胺基酸的再組合;可提高胺基酸,尤其是必需的胺基酸蛋氨酸在體內的利用率。...
氯化苄有很強的毒性, 無色透明液體,可燃,具有強烈刺激性氣味。有催淚性。與空氣形成爆炸性混合物,爆炸極限1.1%~14%(體積)。溶於乙醚、酒精,氯仿等有機溶劑,...
四氯化鉑是一種有吸濕性、能溶於水和丙酮、乙醇,微溶於氨水的化學物質。370°C可分解為二氯化鉑與氯氣。溶於鹽酸可生成六氯合鉑酸。五水合物為紅色晶體,比重...
氯化聚丙烯,英文名Chlorinated polypropylene,簡稱CPP或PP-C,是由聚丙烯氯化改性製得的熱塑性樹脂,在塗料和粘結劑行業有著廣泛套用。...
