定義
化合物為由二種或二種以上不同元素所組成的純淨物。組成此化合物的不同
原子間必以一定比例存在,換言之,化合物不論來源如何,其均有一定組成。在日常生活里,氯化鈉、及
蒸餾水(水),均為常見的化合物。由這些化合物中,人們發現它們的性質彼此各不相同,食鹽為鈉原子和氯原子所組成;糖為碳、
氫及氧等原子所組成;氫氣在氧中燃燒則反應生成水。這些事實,表示二種或多種物質可以反應生成一種新物質,這新物質就是化合物。新物質的性質和原物質的性質完全不同。通常化學上藉此方式來決定一質之該性是否為化合物。又假如一純質可以分解為二種或二種以上之質,則原來之質必為化合物。例如熔融食鹽,通以電流,可完全分解為鈉及氯原子,故食鹽為一種化合物。
 化合物
化合物化合物成分子狀態者稱為分子化合物,如水、糖等。化合物由離子結合者稱為
離子化合物,如食鹽、
芒硝等。化合物可用
化學式來表示,化學式是由化合物中所含各元素之符號所組成。例如由兩種元素構成的二元化合物,在書寫其化學式時,如同命其英文名稱,金屬元素寫在前,而較少金屬性者其次。如食鹽(氯化鈉)的化學式為NaCl。當化合物中不同元素間原子數目不等時,其比率可寫在符號下以數字表示之。如蔗糖的化學式為
,表示糖由十二個碳原子、二十二個氫原子,和十一個氧原子所組成。
分類
對化合物的分類,是研究化學物質分類的一個主要內容。時下通行的化合物分類方法是按化合物分子的不同來分類。
 雜化化合物
雜化化合物按組成分類
可以把化合物分為有機化合物和無機化合物。
有機化合物:
有機化合物含碳的化合物(但含碳的化合物不一定是有機物)。僅含碳、氫兩種元素的化合物叫做
烴。如甲烷(CH
4)是烷烴、乙烯(C2H4)是烯烴、乙炔(C2H2)是炔烴,苯(C6H6)是芳香烴。有機物是含碳元素的化合物(除CO
2、CO、H
2CO
3以及碳酸鹽外)如CH
4、C
2H
5OH、CH
3COOH都含有碳(C)元素。
無機化合物:無機化合物為不含碳氫化合物,如H
2O、KClO
3、MnO
2、KMnO
4、NaOH等等,都是無機物。無機物可以具體分為以下幾類:
酸:由氫和酸根離子構成的物質是酸。如HCl、HNO3、H2SO4。需要注意的是,氨基磺酸、乙酸等是有機物,分別屬於磺酸和羧酸類,它們也被當作是廣義的酸,而不再區分是否是無機物。
鹼:由陽離子和氫氧根離子構成的物質是鹼。如LiOH、NaOH、Ca(OH)2、NH3·H2O、NH2OH等。
鹽:由陽離子和酸根離子構成的物質是鹽,如K2SO4、HgCl2、Ba(NO3)2等。它們分別有K+、Hg2+、Ba2+離子和相應的酸根離子SO42-、Cl-和NO3-。Cu(CH3COO)2是
乙酸銅,雖然含有乙酸(有機酸)的酸根,但仍然被認為是無機物。(對於有碳-金屬共價鍵的才認為是金屬有機化合物)
氧化物:由兩種元素組成且其中一種是負價氧的化合物為氧化物,如CeO2、MnO2、K2O、N2O、XeO4等。對於H2O2、Na2O2一類的
過氧化物,在中學階段仍認為是氧化物。實際上,H2O2是一種弱酸,O22-為其酸根離子,因此Na2O2是鹽。
碳化物:由兩種元素組成且其中一種是負價碳的化合物為碳化物,如WC、CaC2、Fe3C等。CO2雖然由兩種元素組成,但其中碳是正價,因此不是碳化物,而是氧化物。
氮化物:由兩種元素組成且其中一種是負價氮的化合物為氮化物,如BN、Si3N4、Mg3N2等。需要注意的是,
疊氮化物不屬於氮化物,它屬於鹽,因為疊氮根是
疊氮化氫(一種酸)的酸根離子。
按化學鍵分類
離子化合物:鈉是
金屬元素,氯是
非金屬元素。鈉和氯的單質都很容易跟別的物質發生化學反應。它們互相起化學反應時,生成化合物
氯化鈉。
從鈉和氯的原子結構看,納原子的最外電子層有1個電子,容易失去,氯原子的最外電子層有7個電子,容易得到1個電子,從而使最外層都達到8個電子的穩定結構。所以當鈉跟氯反應時,氣態鈉原子的最外電子層的1個電子轉移到氣態氯原子最外電子層上去,這樣,兩個原子的最外電子層都成了8個電子的穩定結構。
 化合物分子式
化合物分子式在這個過程中,鈉原子因失去1個電子而帶上了1個單位的正電荷;氯原子因得到1個電子而帶上了1個單位的負電荷。這種帶電的原子叫做離子。帶正電的離子叫做陽離子,如
鈉離子(Na
+);帶負電的離子叫做陰離子,如氯離子(Clˉ)。這兩種帶有相反電荷的離子之間相互作用,就形成化合物氯化鈉。它呈電中性。
在通常情況下,氯化鈉是固體。像氯化鈉這種由陰、陽離子相互作用而構成的化合物,就是離子化合物。如氯化鉀(KCl),氯化鎂(MgCl
2),氯化鈣(CaCl
2),氟化鈣(CaF
2)等都是
離子化合物。帶電的原子團也叫離子,如硫酸根離子,氫氧根離子(OHˉ)等。硫酸鋅(ZnSO
4),碳酸鈉(Na
2CO
3)、氫氧化鈉(NaOH)等也是離子化合物。
共價化合物:鹽酸是
氯化氫氣體的水溶液。氫氣跟氯氣化合可以生成氯化氫氣體。
氯和氫都是非金屬元素,不僅氯原子很容易獲得1個電子形成最外層8個電子的穩定結構,而且氫原子也容易獲得1個電子形成最外層2個電子的穩定結構。這兩種元素的原子獲得電子難易的程度相差不大,所以都未能把對方的電子奪取過來。兩種元素的原子相互作用的結果是雙方各以最外層1個電子組成一個電子對,這個電子對為兩個原子所共用,在兩個原子核外的空間運動,從而使雙方最外層都達到穩定結構。這種電子對,叫共用電子對。共用電子對受兩個核的共同吸引,使兩個原子形成化合物的分子。在氯化氫分子裡,由於氯原子對於電子對的吸引力比氫原子的稍強一些,所以電子對偏向氯原子一方,因此氯原子一方略顯負電性,氫原子一方略顯正電性,但作為分子整體仍呈電中性。
像氯化氫這樣以共用電子對形成分子的化合物,叫共價化合物。如水、二氧化碳等都是共價化合物。
配位化合物:由中心原子(或離子 ))和幾個配體分子(或離子)以配位鍵相結合而形成的複雜分子或離子,通常稱為配位單元。凡是含有配位單元的化合物都稱做配位化合物,簡稱配合物,也叫
絡合物。配位化合物是共價化合物的一種。
Ni(CO)4 都是配位單元, 分別稱作配陽離子、配陰離子、配分子。
[ Co(NH3)6]Cl3 , K3[Cr(CN)6], Ni(CO)4 都是配位化合物。[Co(NH3)6] [Cr(CN)6] 也是配位化合物。判斷的關鍵在於是否含有配位單元。
特點
化合物具有一定的特性,通常還具有一定的組成。
例:水是化合物,常溫下是液體,沸點100℃,冰點0℃,由氫、氧兩種元素組成。1個水分子H2O由2個氫原子和1個氧原子組成。
例:
氯化鈉(sodium chloride, NaCl)是一種通過鹽酸(hydrochloric acid, HCl)和氫氧化鈉(sodium hydroxide, NaOH)的化學作用(中和反應)而成的化合物。HCl(aq) + NaOH(aq) → NaCl(aq) + H
2O(l)
與混合物區別:
(1)化合物組成元素不再保持單質狀態時的性質;混合物沒有固定的性質,各物質保持其原有性質(如沒有固定的熔、沸點)。
 化合物
化合物(2)化合物組成元素必須用化學方法才可分離;
(3)化合物組成通常恆定。混合物由不同種物質混合而成,沒有一定的組成,不能用一種
化學式表示。
元素、單質、化合物的主要區別:
要明確單質和化合物是從元素角度引出的兩個概念,即由同種元素組成的純淨物叫做單質,由不同種元素組成的純淨物叫做化合物。無論是在單質還是化合物中,只要是具有相同核電荷數的一類原子,都可以稱為某元素。
三者的主要區別是:元素是組成物質的成分,而單質和化合物是指元素的兩種存在形式,是具體的物質。元素可以組成單質和化合物,而單質不能組成化合物。
化合物與固溶體的區別
相同:均為單相材料。
不同:A和B形成
固溶體後,其結構與主晶體一致,A與B間無確定的摩爾比,可以在一定範圍內波動,如紅寶石,A與B形成化合物AmBn後,生成物結構即不同於A也不同於B,是一種新結構,A與B存在一定摩爾比。
非等比化合物
在通常人們的印象當中,化合物都是由幾種固定的按簡單數學配比的元素所組成,然而更多的化合物卻是
非等比化合物,尤其是
無機化合物。所謂非等比化合物,就是組成是非計量比或非整比的化合物,即這些化合物的組成原子間不為小整數比,且組成可在一定範圍內變化,不符合
定組成定律。
最新的研究表明,該類化合物大致包括以下幾類:
(1)由兩種或多種金屬共熔形成的合金體系。由於各類合金可能存在多種相平衡點,因而形 成了多種組成可變的合金化合物。如鋼由Fe與C組成的二元體系中,由於組成的不同可形成
奧氏體、萊氏體、馬氏體和珠光體等不同的相。
(2)在
岩鹽體系中,晶格中由於生成極小部分的缺陷而呈現特殊顏色的化合物,如下鈉蒸氣中加熱氯化鈉形成Na+δCl(δ<<1),是一種淺綠色化合物。
化合物種類繁多,達一千多萬種,有的化合物由陰陽離子構成,如氯化鈉NaCl、硫酸銨(NH4)
2SO
4等;有的化合物由分子構成,如
氨氣NH
3、甲烷CH
4、
五氧化二磷P
2O
5、
二硫化碳CS
2等;有的化合物由原子構成,如
二氧化矽SiO
2、碳化矽SiC等。化合物可以分為無機化合物(不含碳的化合物)和有機化合物(含碳的化合物,除CO、CO
2、H
2CO
3和碳酸鹽等)兩大類。按化學性質的不同,可以把化合物分為氧化物、酸類、鹼類和鹽類。
數量
物質世界是多姿多彩的,從古代最原始的分類(金、木、水、火、土)到現代(截至2013年12月12日)有確定組成的幾十萬種化合物,每年還有大量新的化合物被發現。
已知的化合物的數量,各方面的統計不太一致。比較公認的是美國《
化學文摘》編輯部的統計:已發現天然存在的化合物和人工合成的化合物,大約有三百多萬種。這些化合物有的是由兩種元素組成的,有的是由三種、四種以至更多的化學元素組成的。 每年依然有新合成的化合物數量達30餘萬,其中90%以上是有機化合物。
鑑定
化合物純度的鑑定方法,從快速、便宜、簡便的要求出發,主要來之於以下幾點:
TLC純度的鑑定:
1 展開溶劑的選擇,不只是至少需要3種不同
極性展開系統展開,是首先要選擇三種
分子間作用力不同的溶劑系統,如氯仿\甲醇,環己烷\
乙酸乙酯,正丁醇\醋酸\水,分別展開來確定
組分是否為單一斑點。這樣做的好處是很明顯的,通過
組份間的各種差別將組分分開,有可能幾個相似組份在一種溶劑系統中是單一斑點,因為該溶劑系統與這幾個組分的
分子間力作用無顯著的差別,不足以在TLC區分。而換了分子間作用力不同的另一溶劑系統,就有可能分開。這是用3種不同極性展開系統展開所不能達到的。
2 對於一種溶劑系統正如wxw0825所言,至少需要3種不同極性展開系統展開,其一種極性的展開系統將目標組分的Rf推至0.5,另兩極性的展開系統將目標組分的Rf推至0.8,0.2。作用是檢查有沒有極性比目標組分更大或更小的雜質。
3 顯色方法,光展開是不夠的,還要用各種顯色方法。一般一定要使用通用型
顯色劑,如10%硫酸,碘,因為每種顯色劑(不論是通用型顯色劑,還是專屬顯色劑在工作中都遇到他們都有一化合物不顯色的時候),再根據組分可能含有混雜組份的情況,選用專屬顯色劑。只有在多個顯色劑下均為單一斑點,這時才能下結論樣品為薄層純
熔程判斷純度:
原理很簡單,純化合物,
熔程很短,1,2度。混合物熔點下降,熔程變長。
HPLC的純度鑑定:
對於HPLC因為常用的系統較少,加之其分離效果好,一般不要求選擇三種分子間作用力不同的溶劑系統,只要求選這三種不同極性的溶劑系統,使目標峰在不同的保留時間出峰。
軟電離質譜的純度鑑定:
如ESI-MS,APCI-MS。大極性化合物選用ESI-MS,極性很小的化合物選用APCI-MS,這些
軟電離質譜的特點是只給出化合物的準
分子離子峰,通過正
負離子的相互溝通來確定
分子量。如果樣品不純,就會檢出多對準
分子離子峰,不但確定了純度,還能明確混雜物的分子量。
核磁共振的純度鑑定:
從氫譜中如果發現有很多積分不到一的小峰,就有可能是樣品是樣品中的雜質。利用門控去偶的技術通過對碳譜的定量也能實現純度鑑定。
每種方法多有各自的局限性,如基於氫譜的純度鑑定,如果發現有很多積分不到一的小峰,還有可能使樣品中的活潑
質子,基於
軟電離質譜的純度鑑定,如果混雜物的分子量與目標物一樣就無法檢出。
對化合物純度,世界上不存在100%純的化合物。希望要多高的純度應該與目的有關,例如,想測核磁共振鑑定結構,一般要求95%的純度,如果想測EI-MS,純度越高越好。99%以上。
 化合物
化合物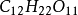
 雜化化合物
雜化化合物 化合物分子式
化合物分子式 化合物
化合物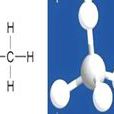
 化合物
化合物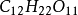
 雜化化合物
雜化化合物 化合物分子式
化合物分子式 化合物
化合物