名稱由來,歷史沿革,結構組成,原子雜化狀態,發現研究,物理性質,化學性質,周環反應,加氫還原,羥基反應,開孔反應,氧化還原,加成反應,金屬反應,顏色反應,毒性分析,主要功能,增強金屬,作催化劑,氣體貯存,光學材料,高分子材料,醫學套用,其他用途,流行文化,
名稱由來 C
60 結構,又稱為
巴基球 又被稱為
足球烯 ,原因是其外形與英國式足球相似。它是一個由60個碳原子結合形成的穩定分子,英國化學家哈羅德·沃特爾·克羅托勾畫出的C
60 的分子結構,富勒的啟示起了關鍵性作用,因此他們一致建議,用布克米
尼斯 特·富勒(Buckminster Fuller)的姓名加上一個詞尾-ene來命名C
60 及其一系列碳原子簇,稱為Buckminsterfullerene,簡稱Fullerene,中譯名為
富勒烯 。
C60 在Fuller的後面加上一個詞尾-ene,是考慮到C60 分子和苯及其衍生物一樣,都具有芳香族的結構,具有不飽和性,在英文中對具有不飽和性的化合物的命名常常帶有詞尾-ene,於是便產生了Fullerene這個名稱,中譯名里對帶詞尾-ene的化合物常被譯成烯,因此Fullerene的中譯名就是富勒烯。
對於將C
60 及其一系列碳原子簇稱為烯,根據有機化學系統命名原則,烯表示含雙鍵的烴,而C
60 及其一系列碳原子簇是完全由碳原子組成的單質,並不是一種化合物,也不是
烯烴 。因此,有些化學家不同意使用富勒烯這個名稱。命名因為需要尊重約定俗成的習慣,書籍和文獻中仍都採用Fullerene這個名稱。
由於C60 分子的形狀和結構酷似英國式足球(soccer),所以又被形象地稱為Soccerene(同樣帶有詞尾-ene),中譯名為“足球烯”。還有人用富勒的名字(Buckminster)的詞頭Buck來命名,稱為Buckyball,中譯名為“巴基球”。
有人建議稱C
60 及其一系列碳原子簇為“
球碳 ”,理由是它們是由碳元素組成的球形分子;有人建議稱為“籠碳”,理由是它們是一種中空的籠形分子;還有人建議把“球碳”、“籠碳”和“富勒”綜合起來,稱為“富勒球碳”、“富勒籠碳”。在C
60 及其一系列碳原子簇的命名上,還沒有一種令大家都滿意的名稱。
歷史沿革 1971年,大澤映二發表《
芳香性 》一書,其中描述了C
60 分子的構想。
1980年,
飯島澄男 在分析碳膜的
透射電子顯微鏡 圖時發現同心圓結構,就像切開的洋蔥,這是C60的第一個電子顯微鏡圖。 1983年,克羅托蒸發石墨棒產生的碳灰的紫外可見光譜中發現215nm和265nm的吸收峰,他們稱之為“駝峰”,他們推斷出這是富勒烯產生的。
1984年,富勒烯的第一個光譜證據是在1984年由美國新澤西州的艾克森實驗室的羅芬等人發現的,但是他們不認為這是C60 等團簇產生的。
1985年,英國化學家哈羅德·沃特爾·克羅托博士和美國科學家理察·斯莫利等人在氦氣流中以雷射汽化蒸發石墨實驗中首次製得由60個碳組成的碳原子簇結構分子C60 ,並推測這個團簇是球狀結構。
1990年,克利斯莫(Kriischmer)等人第一次報導了大量合成C60 的方法,才使得C60 的研究得以大量展開。
1991年,
加州大學洛杉磯分校 的霍金斯(Joel Hawkins)得到了富勒烯衍生物的第一個晶體結構,標誌著富勒烯結構被準確測定。
1992年美國科學家P. R. Buseck在用高分辨
透射電鏡 研究俄羅斯數億年前的地下的一種名為Shungites的礦石時,發現了C
60 和C
70 的存在,飛行時間質譜也證明了他們的結論,產生原因未知。
1995年,伍德(Fred Wudl)製備出開孔富勒烯;而
PCBM 也被他首次製備。
1996年,羅伯特·科爾(美)哈羅德·沃特爾·克羅托(英)理察·斯莫利(美)因富勒烯的發現獲諾貝爾獎。
2014年8月25日,科學家曾一直構想用其他元素構造具有相同結構的巴基球,而這一構想變成現實,研究人員完成了第一個用硼原子組成的巴基球。由於硼具有電子缺失的性質,所以該巴基球可以用來儲存氫氣,進一步發展成新型納米材料。據了解,巴基球C60是單純由碳原子結合形成的穩定分子,它具有60個頂點和32個面,其中12個為正五邊形,20個為正六邊形。其相對分子質量約為720。
結構組成 球棍模型 C60是一種碳
原子簇 ,由
14 C標記。它由60個
碳原子 構成像足球一樣的32面體,包括20個六邊形,12個五邊形。這60個C原子在空間進行排列時,形成一個化學鍵最穩定的空間排列位置,恰好與足球表面格的排列一致。由於這個結構的提出是受到建築學家
富勒 (Buckminster Fuller)的啟發。富勒曾設計一種用六邊形和五邊形構成的球形薄殼建築結構。因此科學家把C60叫做足球烯,也叫做
富勒烯 (Fullerence)。
在數學上,富勒烯的結構都是以五邊形和六邊形面組成的
凸多面體 。最小的富勒烯是C
20 ,有
正十二面體 的構造。沒有22個頂點的富勒烯。之後都存在C
2n 的富勒烯,
n = 12,13,14 ...。在之些小的富勒烯中,都存在著五邊形相鄰結構。C
60 是第一個沒有相鄰的五邊形的富勒烯,下一個是C
70 。在更高的富勒烯中,普遍滿足孤立五邊形規則(Isolated pentagon rule,IPR),即在
n> 12時,不存在相鄰的五邊形結構。
原子雜化狀態 處於頂點的碳原子與相鄰頂點的碳原子各用近似於sp
2 雜化軌道重疊形成
σ鍵 ,每個碳原子的三個σ鍵分別為一個五邊形的邊和兩個六邊形的邊。碳原子
雜化軌道理論 計算值為sp
2.28 ,每個碳原子的三個σ鍵不是共平面的,
鍵角 約為108°或120°,因此整個分子為球狀。每個碳原子用剩下的一個p軌道互相重疊形成一個含60個π電子的閉殼層電子結構,因此在近似球形的籠內和籠外都圍繞著π電子云。
比例模型 下面給出其雜化軌道的理論計算過程:
根據雜化軌道的正交、歸一條件,兩個等性 雜化軌道的的最大值之間的夾角θ 滿足:
式中
α ,
β ,
γ 分別為雜化軌道中s,p,d 軌道所占的百分數(注意,此式適用於沒有f 軌道參加雜化的情況,另外因角度的特殊性,此式不適用於dsp
2 雜化軌道)。
C60 的三個雜化軌道中均只有一個電子,為等性雜化軌道。由於無d 軌道參與雜化,故可以列式:
由於有1個s 軌道參與雜化,故設有
x 個p 軌道參與雜化,則:
故碳原子採用的雜化方式理論計算值是sp2.28 。
因為C
60 是石墨、金剛石的
同素異形體 ,因此有科學家聯想到用廉價的石墨作原料合成C
60 ,也有人想到它含有
苯 環單元的結構,或許可以選用苯作原料合成C
60 。這些構想最後都實現了。1000g苯可以製得3gC
70 和C
60 的混合物(它們的比率為0.26~5.7)。
發現研究 C60的發現最初始於天文學領域的研究,科學家們研究星體之間廣泛分布的碳塵,發現星際間碳塵的黑色雲狀物中包含著由短鏈結構的原子構成的分子,也有一部分學者認為該雲狀物是從碳族星體紅色巨星中產生的,理論天文學家推測,這些塵埃土中包含著呈現黑色的碳元素粒子。
C540 後來英國的克羅脫為了探明紅色巨星產生的碳分子結構,對星際塵埃中含有碳元素的幾種分子進行了確認。美國的霍夫曼和德國的克拉其莫也製造出了宇宙中類似的塵埃。他們將其與煤炭燃燒後遺留的黑色物質進行比較,發現了氣化物質在紫外線吸收實驗中留下了清晰的痕跡,並稱之為“駝峰光譜”。後來由美國的柯爾、史沫萊和英國的克羅脫解釋出該現象的理由,並為此獲得了
諾貝爾化學獎 。
C60是美國
休斯頓 賴斯大學 的史沫萊(R.E.Smalley)等人和英國的克羅脫(H.W.Kroto)於1985年提出煙火法而正式製得的。他們用大功率
雷射束 轟擊石墨使其氣化,用1MPa壓強的
氦氣 產生超音波,使被雷射束氣化的碳原子通過一個小噴嘴進入真空膨脹,並迅速冷卻形成新的碳分子,從而得到了C60。C60的組成及結構已經被質譜儀、X射線分析等實驗所證明。此外,還有C70等許多類似C60的分子也已被相繼發現。
除C60 外,具有封閉籠狀結構的還可能有C28 、C32 、C50 、C70 、C84 ……C240 、C540 等,統稱為富勒烯(Fullerene)。自從1985發現富勒烯之後,不斷有新結構的富勒烯被預言或發現,並超越了單個團簇本身。
聚合物 :
在高溫高壓下形成的 鏈狀、二維或三維聚合物。
納米“洋蔥” :
多壁碳層包裹在巴基球外部形成球狀顆粒,可能用於潤滑劑;
球棒相連二聚體 :
兩個巴基球被碳鏈相連;
碳納米管 :
碳納米管 是非常小的中空管,有單壁和多壁之分;在電子工業有潛在的套用;納米管是中空富勒烯管。這些碳管通常只有幾個納米寬,但是他們的長度可以達到1微米甚至1毫米。碳納米管通常是終端封閉的,也有終端開口的,還有一些是終端沒有完全封口的。碳納米管的獨特的分子結構導致它有奇特的巨觀性質,如高抗拉強度、高導電性、高延展性、高導熱性和化學惰性(因為它是圓筒狀或“平面狀”,沒有裸露原子被輕易取代)。一個潛在套用是做
紙電池 ,這是2007
倫斯勒理工學院 的一個新發現。 另外一個可能套用是用做
太空電梯 的高強度碳纜。通過共價鍵將富勒烯吸附在碳納米管外形成的納米“芽”結構稱作納米芽。
巨碳管 :
比納米管大,管壁可製備成不同厚度,在運送大小不同的分子方面有潛在價值;
富勒體 (Fullerites ):
是富勒烯及其衍生物的固態形態的稱呼,中文一般不特別稱呼這個形態。超硬富勒體這個詞一般被用來表述使用高壓高溫得到的富勒體,這種條件下普通的富勒烯固體會形成鑽石形式的納米晶體,它有相當高的機械強度和硬度。
內嵌富勒烯 :
內嵌富勒烯是將一些原子嵌入富勒烯碳籠而形成的一類新型內嵌富勒烯,如氫、碳、鈧、氮等,大部分是在電弧法製造富勒烯的過程中形成的,也可以通過化學方法將富勒烯打開孔後裝入一些原子或分子。
物理性質 C
60 在室溫下為紫紅色固態分子晶體,有微弱螢光。C
60 分子的直徑約為7.1埃(1埃= 10
-10 米,即一百億分之一米),C
60 的密度為1.68g/cm
3 。分子軌道計算表明,足球烯具有較大的
離域能 。C
60 具有金屬光澤,有許多優異性能,如超導、強磁性、耐高壓、抗
化學腐蝕 、在光、電、磁等領域有潛在的套用前景。
溶解性
富勒烯在大部分溶劑中溶得很差,通常用芳香性溶劑,如
甲苯 、
氯苯 ,或非芳香性溶劑
二硫化碳 溶解。純富勒烯的溶液通常是紫色,濃度大則是紫紅色,C70的溶液比C60的稍微紅一些,因為其他在500nm處有吸收;其他的富勒烯,如C
76 、C
80 等則有不同的紫色。富勒烯是迄今發現的唯一在室溫下溶於常規溶劑的碳的同素異性體。
有些富勒烯是不可溶的,因為他們的
基態 與
激發態 的頻寬很窄,如C
28 ,C
36 和C
50 。C
72 也是幾乎不溶的,但是C
72 的內嵌富勒烯,如La
2 ·C
72 是可溶的,這是因為金屬元素與富勒烯的相互作用。早期的科學科學家對於沒有發現C
72 很是疑惑,但是卻有C
72 的內嵌富勒烯。窄頻寬的富勒烯活性很高,經常與其他富勒烯結合。化學修飾後的富勒烯衍生物的溶解性增強很多,如PC61BM室溫下在氯苯中的溶解度是50mg/mL。C
60 和C
70 在一些溶劑的溶解度列於左表,這裡的溶解度通常是飽和濃度的估算值。
導電性
C60 常態下不導電。因為C60大得可以將其他原子放進它內部,並影響其物理性質,因而不可導電。另外,由於C60 有大量游離電子,所以若把可作β衰變的放射性元素困在其內部,其半衰期可能會因此受到影響。
超導性
在可以大量生產C60後其很多性質被發現,很快Haddon等人 發現鹼金屬摻雜的C
60 有金屬行為,1991年發現鉀摻雜的C
60 在18K時有超導行為,這是迄今最高的分子超導溫度,之後大量的金屬摻雜富勒烯的超導性質被發現。研究表明超導轉化溫度隨著鹼金屬摻雜富勒烯的晶胞體積而升高。
銫 可以形成最大的鹼金屬離子,因此銫摻雜的富勒烯材料被廣泛研究,Cs
3 C
60 As在38K時有超導性質, 不過是在高壓下。常壓下33K時具有最高超導轉化溫度的是 Cs
2 RbC
60 。 C
60 固體超導性的
BCS理論 認為,
超導轉變溫度 隨著晶胞體積的增加而升高,因為C
60 分子間的間隔與
費米能級 N(εF)的
態密度 的升高相關,因此科學家們做了大量的工作試圖增加富勒烯分子間的距離,尤其是將中性分子插入A3C
60 晶格 中來增加間距同時保持C
60 的價態不變。不過,這種氨化技術意外地得到了新奇的富勒烯插入複合物的特別的性質:Mott-Hubbard轉變以及C
60 分子的取向/軌道有序和磁結構的關係。 C
60 固體是由弱相互作用力組成的,因此是分子固體,並且保留了分子的性質。一個自由的C
60 分子的分立能級在固體中只是很弱的彌散,導致固體中非重疊的帶間隙很窄,只有0.5eV。未摻雜的 C
60 固體,5倍hu帶是其HOMO能級,3倍的t1u帶是其空的LUMO能級,這個系統是帶禁阻的。但是當C
60 固體被金屬原子摻雜時,金屬原子會給t1u帶電子或是3倍的t1g帶的部分電子占據有時會呈現金屬性質。雖然它的t1u帶是部分占據的,按照BCS理論A4C
60 的t1u帶是部分占據的應該有金屬性質,但是它是一個絕緣體,這個矛盾可能用Jahn-Teller效應來解釋,高對稱分子的自發變形導致了它的兼併軌道的分裂從而得到了電子能量。這種Jahn-Teller型的電子-聲子作用在C60固體中非常強以致於可以破壞了特定價態的價帶圖案。窄帶隙或強電子相互作用以及簡併的基態對於理解並解釋富勒烯固體的超導性非常重要。電子相互斥力比頻寬大時,簡單的Mott-Hubbard模型會產生絕緣的局域電子基態,這就解釋了常壓時銫摻雜的C
60 固體是沒有超導性的。電子相互作用驅動的t1u電子的局域超過了臨界點會生成Mott絕緣體,而使用高壓能減小富勒烯相互間的間距,此時銫摻雜的C60固體呈現出金屬性和超導性。
關於C60 固體的超導性還沒有完備的理論,但是BCS理論是一個被廣泛接受的理論,因為強電子相互作用和Jahn-Teller電子-聲子偶合能產生電子對,從而得到較高的絕緣體-金屬轉變溫度。
磁性
阿勒曼 (Allemand)等人在C
60 的甲苯溶液中加入過量的強供電子有機物四(二甲氨基)乙烯(TDAE),得到了C
60 (TDAE)C
0.86 的黑色微晶沉澱,經磁性研究後表明是一種不含金屬的軟鐵磁性材料。
居里溫度 為16.1K,高於迄今報導的其它有機分子鐵磁體的居里溫度。由於有機鐵磁體在磁性記憶材料中有重要套用價值,因此研究和開發C
60 有機鐵磁體,特別是以廉價的碳材料製成磁鐵替代價格昂貴的金屬磁鐵具有非常重要的意義。
化學性質 在
親核加成 中富勒烯作為一個
親電試劑 與
親核試劑 反應,它形成
碳負離子 被
格利雅試劑 或有機鋰試劑等親核試劑捕獲。例如,氯化甲基鎂與C
60 在定量形成甲基位於的環戊二烯中間的五加成產物後,質子化形成(CH
3 )
5 HC
60 。賓格反應也是重要的富勒烯環加成反應,形成亞甲基富勒烯。富勒烯在氯苯和
三氯化鋁 的作用下可以發生富氏烷基化反應,該氫化芳化作用的產物是1,2加成的(Ar-CC-H)。
周環反應 富勒烯的[6,6]鍵可以與雙烯體或雙烯親和體反應,如D-A反應。[2+2]環加成可以形成四元環,如苯炔。1,3偶極環加成反應可以生成五元環,被稱作Prato反應。富勒烯與
卡賓 反應形成亞甲基富勒烯。常見周環反應如下:
(1) [4+2]環加成。在[4+2]環加成中,C60 的6/6 雙鍵一直充當親二烯體,大量不同的二烯類物加到C60 上形成六元環(主要合成一元加合物)環加成物的形成條件依賴於二烯的反應活性,在某些情況下加合物的形成是可逆的,如戊二烯和蒽的C60 環加成。
(2) [3+2]環加成。如 C60 與重氮甲烷(R1R2CN2) 、重氮醯胺、重氮乙酸酯類反應,可得到種類很多的亞甲基橋富勒烯,這類反應是基於C60 作為一個1,3 親偶極體,重氮化合物首先加成到6/6雙鍵上,形成二氫化吡唑啉五元環。
(3) [2+2]環加成。用10倍過量的四環烷烴與C60 的甲苯溶液在80℃發生[2+2]熱環加成反應,C60 與富電子有機分子可進行光化學反應,在室溫下,用紫外線照射C60 與N,N-二乙基丙炔基胺的無氧甲苯溶液20min 即形成環加合產物。
(4) [2+1]環加成反應。與C60 的6/6 雙鍵發生加成反應的卡賓有許多不同的方法產生,如通過二氮丙因、甲苯磺醯基腙鋰鹽、環丙烯酮乙縮醛、二唑啉的熱解及α-鹵代羧酸鹽的熱解與費歇爾卡賓的熱分解等等。在C60 存在的情況下由鄰-4-硝基苯基磺醯基異羥肟酸的衍生物通過鹼催化α消除而合成富勒烯1-氮雜環丙烷。
加氫還原 富勒烯氫化有幾個容易的方法。氫化富勒烯如C60 H18 ,C60 H36 。然而,完全氫化的C60 H60 僅僅是假設存在因為分子張力過大。高度氫化富勒烯不穩定,富勒烯與氫氣直接反應在高溫條件下的直接反應會導致籠結構崩潰,而形成的多環芳烴。
羥基反應 富勒烯可以通過羥基化反應得到
富勒醇 ,其水溶性取決於分子中羥基數的多少。一種方法是富勒烯與稀硫酸和硝酸鉀反應可生成C
60 (OH)
15 ,另一種方法是在稀氫氧化鈉溶液的催化下反應由TBAH增加24到26個羥基。羥基化反應也有過用無溶劑氫氧化鈉與過氧化氫和富勒烯反應的報導。用過氧化氫與富勒烯的反應合成C
60 (OH)
8 ,羥基的最大數量,可以達到36至40個。
開孔反應 開孔反應是指通過化學手段選擇性地切斷富勒烯骨架上的碳碳鍵來製備開孔富勒烯的反應,開孔後就可能把一些小分子裝到碳球中,如氫分子、氦、鋰等。第一個開孔富勒烯是在1995由伍德等報導的。
氧化還原 氧化還原反應 :在光照的條件下將C
60 與O
2 反應生成環氧化物C
60 O
2 ,但這種環氧化物不穩定,用礬土分離時能還原成C
60 。
加成反應 C
60 可以與氫或鹵素單質進行加成。把其完全
氫化 便得絨毛球烷(Fuzzyball),化學式為C
60 H
60 (加成進的
氫原子 有可能C
60 在籠內也可能在C
60 外部)。烷基
自由基 R可與C60反應生成RC60加和物,RC60可生成C60直接鍵和啞鈴狀二聚體RC
60 -C
60 R。
親電加成
富勒烯也可以發生親電反應。可以在富勒烯球外加成24個溴原子。最多親電加成紀錄保持者是C60F48。根據氟
矽烷 的結構(在矽元素中)還難以預測C60F60是否可能有一些氟原子在“endo”位置(指富勒烯內部),這種化合物是比起球型更類似於一個管狀的富勒烯分子。
配位反應
富勒烯在有機金屬化學中作為配體。[6,6]
雙鍵 是缺電子的,通常與金屬成鍵的η= 2(配位化學中的常數)。鍵合模式如η= 5或η=6可以因作為配體的球狀富勒烯改變而改變。富勒烯和硫羰基鎢W(CO)
6 在環己烷溶液中,陽光直接照射下反應生成的(η-2-C
60 )
5 W(CO)
6 。
內嵌反應
指通過化學手段選擇性地切斷富勒烯骨架上的碳碳鍵來製備開孔富勒烯的反應。開孔後就可能把一些小分子裝到碳球中,如氫分子、氦、鋰等。第一個
開孔 富勒烯是在1995由Wudl等報導的。
反加成
反加成反應即Retro-Additions(RA)。研究表明,通過RA消去,取代基實現了他們的目的後便與富勒烯主體分離。
金屬反應 C60 與金屬的反應分為兩種情況:一種是金屬被置於C60碳籠的內部;另一種是金屬位於C60 碳籠的外部:
1)C
60 碳籠內配合物生成反應。C
60 碳籠為封閉的中空的多面體結構,其內腔直徑為7.1埃,內部可嵌入原子、離子或
小分子 形成新的
團簇 分子,C
60 + AC
60 (A)。Smalley等人現已發現能與C
60 生成C
60 (A)的金屬有:K、Na、Cs、La、Ba、Sr、U、Y、Ce、Sm、Eu、Gd、Tb、Ho、Th等。除金屬外,He、Ne等惰性氣體及LiF、LiCl、NaCl等極性分子亦可移置C
60 籠中。
2)C
60 碳籠外鍵合反應。Ohno等人發現能與C
60 鍵合 的金屬有:V、Fe、Co、Ni、Rh、Cu、La、Yb、Ag等。
顏色反應 C60 可以溶於CS2 中。顏色呈紫紅色。
C60 的主客體化學
由於C60分子獨特的剛性球狀結構,發展能夠與其高效結合的特定主體是一件很有意義的工作,二十多年來科學家們樂此不疲地用新奇的化合物和有趣的方式將其包起來得到包含物和嵌合物,在富勒烯的主客體化學方面進行了大量的研究並取得了長足的進展,發展了一系列主體化合物,大致分為富π電子化合物和大環主體兩類;前者有
二茂鐵 、
卟啉 、
酞菁 、
四硫富瓦烯 、
苝 、
碗 烯和帶狀多共軛體系等的衍生物,後者有
環糊精 、
杯芳烴 、氮雜杯芳烴,長鏈烷烴和
低聚物 等的衍生物。迄今與富勒烯分子超分子結合力最強的是相田卓三教授合成的卟啉籠分子,在鄰二氯苯中與C
60 的結合常數為lg
Ka = 8.11。
C60衍生物超分子的自組裝
修飾富勒烯可以獲得更多的作用位點,因此富勒烯衍生物的超分子自組裝的研究一直是個熱點,遠遠多於不修飾的富勒烯的組裝,特別是在基於富勒烯的功能材料、光致電子轉移、人工光合作用體系、光子器件等諸多的研究領域。
C60及其衍生物的有序聚集態的製備方法
富勒烯功能化後產生的自組裝前體,通過超分子作用形成有序聚集態結構,既是提高對富勒烯本徵認識以及單分子器件構築水平,也是對富勒烯高新技術功能化材料的需要。十多年來,中國內外很多研究組已經在獲得穩定的C60納米材料如納米顆粒、納米管、納米線、納米帶和高度有序二維結構等方面進行了大量的研究,發展了經典自組裝法、模板法、氣相沉積法,化學吸附和LB膜技術等方法來構築具有特定形貌的有機納米材料。
毒性分析 科學家在生物體腹腔內注射大劑量C60 後的毒理研究後發現,沒有證據表明白鼠在注射5000mg/kg(體重)的C60 劑量後有中毒現象。 也沒有發現給齧齒動物口服 C60 和C70 混合物2000mg/kg的劑量後有中毒現象、遺傳毒性或誘變性, 其他人的研究同樣證明C60 和C70 是無毒的。
另一些科學家發現注射C60 懸浮液不會導致對嚙齒類動物的急性或亞急生毒性,相反一定劑量的C60會保護他們的肝免受自由基傷害。2012年的最新研究表明,口服富勒烯能將小鼠的壽命延長一倍而沒有任何副作用。摩薩(Moussa)教授研究C60 的性質長達18年,著有 《持續餵服小鼠C60使其壽命延長》一文,2012年10月他在一次視頻採訪中宣稱,純C60 沒有毒性。
富勒烯發現以來都沒有明顯的證據表明C
60 是有毒性的,但一些科學家將碳納米管注射到小鼠的腹腔中發現了石棉狀的病灶。不過這項研究不是吸入性研究,雖然在這之前有對納米管的吸入性研究的毒理實驗,因此,憑此項研究還不能確認碳納米管有類似石棉的毒理特性。小鼠吸入C
60 (OH)
24 或納米C
60 並沒有毒副作用,而同樣情況下將石英顆粒注入小鼠則引起強烈的炎症。納米管在
分子量 、形狀、尺寸等化學和物理性質(溶解度)方面都與C
60 迥然不同,因此從毒理學的角度來看,C
60 和碳納米管的不同毒理學性質的差異性沒有關聯性。在分析毒性數據時,必須區別富勒烯的不同分子:(C
60 、C
70 ……);富勒烯衍生物:C
60 或其他化學修飾的富勒烯衍生物;富勒烯複合物(比如,表面活性劑輔助的水溶性富勒烯,如C
60 -
聚乙烯基吡咯烷酮 ;主客體複合物,如與
環糊精 或
卟啉 ),這種情況下富勒烯是與其他分子是通過
超分子 作用與其他分子連線的;C
60 納米顆粒,這是C
60 微晶的沿展固相聚集;以及更大分子量的非球狀的碳納米管。
主要功能 增強金屬 提高金屬材料的強度可以通過合金化、塑性變形和熱處理等手段,強化的途徑之一是通過幾何互動作用,例如將焦炭中的碳分散在金屬中,碳與金屬在晶格中相互交換位置,可以引起金屬的塑性變形,碳與金屬形成
碳化物 顆粒,都能使金屬增強。在增強金屬材料方面,C
60 的作用將比焦炭中的碳更好,這是因為C
60 比碳的顆粒更小、活性更高,C
60 與金屬作用產生的碳化物
分散體 的顆粒大小是0.7nm,而碳與金屬作用產生的碳化物分散體的顆粒大小為2μm~5μm,在增強金屬的作用上有較大差別。
作催化劑 在發現C60以後,化學家們開始探討C
60 用於催化劑的可能性。C60具有
烯烴 的電子結構,可以與過渡金屬(如鉑系金屬和鎳)形成一系列絡合物。例如C
60 與鉑、鋨可以結合成{[(C
2 H
5 )
3 P]
2 Pt}C
60 和C
60 OsO
4 ·(四特
丁基 吡啶)等配位化合物,它們有可能成為高效的催化劑。
日本豐橋科技大學的研究人員合成了具有高度催化活性的鈀與C60的化合物C60Pd6。中國武漢大學的研究人員合成了Pt(PPh3 )2 C60 (PPh3 為三苯基膦),對於矽氫加成反應具有很高的催化活性。
氣體貯存 利用C60獨特的分子結構,可以將C
60 用作比金屬及其合金更為有效和新型的吸氫材料。每一個C
60 分子中存在著30個碳碳雙鍵,因此,把C
60 分子中的雙鍵打開便能吸收氫氣。已知的C
60 的較穩定的C
60 氫化物 有C
60 H
24 、C
60 H
36 和C
60 H
48 。在控制溫度和壓力的條件下,可以簡單地用C
60 和氫氣製成C
60 的氫化物,它在
常溫 下非常穩定,而在80℃~215℃時,C
60 的氫化物便釋放出氫氣,留下純的C
60 ,它可以被100%地回收,並被用來重新製備C
60 的氫化物。與金屬或其合金的貯氫材料相比,用C
60 貯存氫氣具有價格較低的優點,而且C
60 比金屬及其合金要輕,因此,相同質量的材料,C
60 所貯存的氫氣比金屬或其合金要多。
C
60 不但可以貯存氫氣,還可以用來貯存氧氣。與高壓鋼瓶貯氧相比,高壓鋼瓶的壓力為3.9×10
6 Pa,屬於高壓貯氧法,而C
60 貯氧的壓力只有2.3×10
5 Pa,屬於低壓貯氧法。利用C60在
低壓 下大量貯存氧氣對於醫療部門、軍事部門乃至商業部門都會有很多用途。
光學材料 由於C
60 分子中存在的三維高度非定域電子共軛結構使得它具有良好的光學及非線性光學性能。如它的光學限制性在實際套用中可作為光學限幅器。C
60 還具有較大的
非線性光學 係數和高穩定性等特點,使其作為新型
非線性光學材料 具有重要的研究價值,有望在光計算、光記憶、光信號處理及控制等方面有所套用。還有人研究了C
60 化合物的倍頻回響及螢光現象,基於C
60 光電導性能的光電開關和光學玻璃已研製成功。C
60 與花生酸
混合制 得的C
60 -花生酸多層LB膜具有光學累積和記錄效應。光限制性也對於保護眼睛具有重要意義:因為在增加入射光的強度時,C
60 會使光學材料的傳輸性能降低。以C
60 的光學限制性為基礎,可研製出光限制產品,它只允許在敏化
閾值 以下(即對眼的危險閾值以下)的光通過,這樣就起到了保護人眼免受強光損傷的作用。
高分子材料 由於C
60 特殊籠形結構及功能,將C
60 作為新型功能基團引入高分子體系,得到具有優異導電、光學性質的新型
功能高分子材料 。從原則上講,C
60 可以引人
高分子 的主鏈、側鏈或與其它高分子進行
共混 ,Nagashima等人報導了首例C60的有機高分子C
60 Pd
n 並從實驗和理論上研究了它具有的催化
二苯乙炔 加氫 的性能,Y.Wany報導C
60 /C
70 的混和物滲入發光高分子材料聚乙烯
咔唑 (pvk)中,得到新型高分子光電導體,其光導性能可與某些最好的光導材料相媲美。這種光電導材料在靜電複印、靜電
成像 以及光探測等技術中有廣泛套用。C
60 摻入
聚甲基丙烯酸甲酯 (PMMA)可成為很有前途的光學限幅材料。另外,C
60 摻雜的聚苯乙烯的光學雙穩態行為也有報導。
醫學套用 1)用於製造生物活性材料:
尼爾森 (Nelson)等人報導C
60 對田鼠表皮具有潛在的腫瘤毒性。貝爾(Baier)等人認為C
60 與
超氧陰離子 之間存在相互作用。1993年弗萊德曼(Friedman)等人從理論上預測某些C
60 衍生物將具有抑制人體免疫缺損蛋白酶HIVP活性的功效,而愛滋病研究的關鍵是有效抑制HIVP的活性。日本科學家報導一種水溶性C
60 羧衍生物在
可見光 照射下具有抑制毒性
細胞生長 和使DNA開裂的性能,為C
60 衍生物套用於光動力療法開闢了廣闊的前景。1994年Toniolo等人報導一種水溶注C
60 —多肽衍生物,可能在人類單核白血球趨藥性和抑制HIV-1 蛋白酶兩方面具有潛在的套用,
黃文棟 等人製得水溶性C
60 -脂質體,發現其對癌細胞具有很強的殺傷效應。台灣科學家報導多羥基C
60 衍生物—富勒酵具有吞噬黃嘌呤/
黃嘌呤氧化酶 產生的超氧陰離子自由基的功效,還對破壞能力很強的
羥基自由基 具有優良的清除作用。利用C
60 分子的抗輻射性能,將
放射性元素 置於碳籠內注射到癌變部位能提高放射治療的效力並減少副作用。
2)癌細胞的殺傷效應:C
60 經光激發後有很高的單線態氧的產率,而單線態氧與生物機體的生理生化功能、組織損傷、腫瘤以及光化治療技術都有著重要關係。當對C
60 的激發光強度達到4000lx時,癌細胞受單線態氧的作用已接近100%死亡,因此能有效地破壞癌細胞的質膜和細胞內的線粒體
中質 網和核膜等重要的癌細胞結構,從而導致癌細胞的損傷乃至死亡。還有的研究指出,可以將腫瘤細胞的抗體附著在C
60 分子上,然後將帶有抗體的C
60 分子引向腫瘤,也可以達到殺傷腫瘤細胞的目的。
3)抗病毒作用。人體免疫缺損蛋白酶(HIV-1`protease HIVP)被認為是抗病毒療法中主要抑制對象,富勒烯具有抑制 HIVP 活性的功效,而抑制 HIVP活性是研究治療愛滋病的關鍵。HIVP的活性部分可以近似的描述為一個敞開式圓柱體,線性排列著疏水胺基酸,線性圓柱體的半徑和一個C60 分子幾乎相同,但由於富勒烯分子是非極性的,因此將其製備成水溶性的C60 或者其衍生物後,就可以嵌入 HIVP 的活性中心。C60衍生物的疏水部分與 HIVP 的活性部位結合相互起來, 親水部分(極性基團)則在膜表面形成溶劑化層,阻斷了HIVP 的活性中心,從而達到抑制 HIVP 的目的。
4)致使 DNA 裂解。核酸含有生物遺傳信息,是一類重要的生物分子,它包括脫氧核糖核酸DNA和核糖核酸RNA兩大類,而 DNA的裂變將引起細胞凋亡,致使生物體變異。富勒烯具有光物理特性,有很深的顏色,在 UV 和可見光區顯示了豐富的光化學行為,在光的激發下,三線態C60 可產生約一個單位能量,通過能量轉換,可形成高產量的單線態氧1O2 。而三線態也能氧化富電子底物。試驗發現,富勒烯衍生物具有專一地切割 DNA的能力。
當然DNA的裂解也會使有病或異常增值的細胞凋亡,通過連線靶向性的官能團,可能使富勒烯的作用發生在特定的部位,這為治療某些癌症和一些疑難雜症提供了一條新的途徑,而從單線態氧1O2 到單電子轉移轉移機理,標誌著對作用機理認識的深入,隨著富勒烯作用機理的進一步揭示,必將會給富勒烯及其衍生物在DNA裂解方面的套用帶來深遠的影響。
5)清除自由基。C60 被喻為吸收游離基的海綿。在某些情況下,生物體需要活性氧來完成生理過程,如吞噬細菌、凝血酶原合成、肝臟對外來毒物的解毒等。但許多情況下,活性氧積累過剩時,又會產生損傷作用,如氧自由基和H2 O2 能損傷細胞膜,致使一些細胞壞死,人們已經發現許多疾病是由氧自由基觸發的,機體衰老也與此密切相關 Chiang等人報導水溶性的多羥基富勒烯衍生物 fullerenols對消除由黃嘌呤和黃嘌呤氧化酶產生的超氧基有很好的效果, 該富勒烯醇化合物比母體C60 減少了它們固有的生物毒性。一些具有電子親和力的富勒烯醇成為合適的試劑,用於生物體系的自由基去除和水溶性的抗氧化劑以減少有病血液中的自由基的濃度和抑制不正常或有病細胞的生長,試驗表明,當溶液中富勒醇的濃度為50mg /L時,對超氧基的清除率可達到80%,同時通過光譜吸收試驗和化學發光技術試驗還顯示富勒烯醇的存在對黃嘌呤氧化而產生的尿酸的量沒有影響,這意味著它對黃嘌呤氧化酶沒有抑制作用,而直接對超氧基起抑制作用。
其他用途 C
60 的衍生物C
60 F
60 可作為“分子滾珠”和“分子潤滑劑”在高技術發展中起重要作用。將鋰原子嵌人碳籠內有望製成高效能鋰電池。碳籠內嵌人稀土元素銪可望成為新型
稀土發光材料 。水溶性釓的C
60 衍生物有望作為新型核磁造影劑。高壓下C
60 可轉變為金剛石,開闢了金剛石的新來源。C
60 及其衍生物可能成為新型催化劑和新型納米級的分子導體線、分子吸管和晶須增強
複合材料 。C
60 與
環糊精 、環芳烴形成的
水溶性 主客體複合物將在
超分子化學 、
仿生化學 領域發揮重要作用。
由於用C60 薄膜做基質材料可以製成齒狀組合型的電容器,用它來製成的化學感測器具有比傳統的感測器尺寸小、簡單、可再生和價格低等優點,可能成為感測器中頗具吸引力的一種候選產品。
富勒烯還具有記憶性,可以用做記憶材料。
流行文化 在流行文化中的富勒烯元素很多,並且在科學家關注它們之前就出現了。在《
新科學家 》雜誌中,曾經每周有瓊斯(David E. H. Jones)寫的叫做《地達拉斯》(Daedalus)的專欄來描述各種有趣但很難實現的科學和技術。1966年,他建議可能通過摻雜雜原子來扭曲一個平面的六邊形組成的網來得到一個中空的碳球分子。 2010年9月4日,
谷歌 的首頁上用一個旋轉的C
60 富勒烯取代了GOOGLE圖案中的第二個"O"來慶祝巴基球發現25周年。

 C60
C60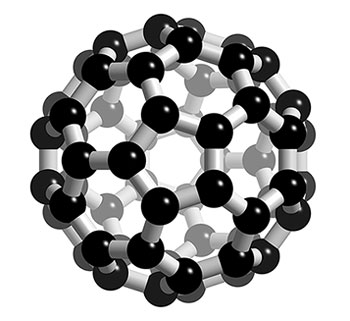 球棍模型
球棍模型




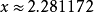
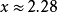
 C540
C540

 C60
C60 球棍模型
球棍模型




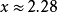
 C540
C540