基本性質
在極性反應中,親核試劑提供能量較高的電子對,用於形成新鍵。親核試劑的電子對可以是親核原子上的未
共用電子對或負電荷,也可來自於試劑分子中σ鍵或π鍵的異裂。根據親核試劑如何提供電子對,將親核試劑分成三種類型:未共用電子對型親核試劑(lone—pair nucleophiles),σ鍵型親核試劑(σ一bond nucleophiles)和π鍵型親核試劑(π一bond nucleophiles)。
未共用電子對型
親核試劑的親核原子上有未共用的電子對,可用於與親電試劑的親電原子形成新鍵。
例如,以下親核反應中,胺作為未共用電子對型親核試劑提供電子,與親電試劑成鍵:
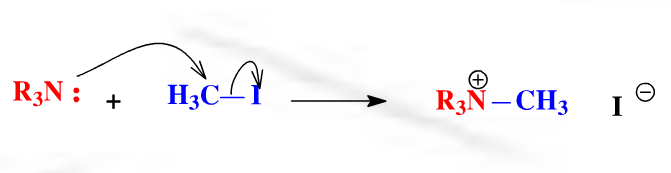 未共用電子對型
未共用電子對型除胺外,常見的未共用電子對型親核試劑還有醇、硫醇、烷氧負離子、碳負離子等。
 未共用電子對型親核試劑
未共用電子對型親核試劑σ鍵型親核試劑
當非金屬原子與金屬原子之間形成共價鍵時,由於非金屬原子的
電負性通常較大,使得非金屬原子帶部分負電荷,金屬原子帶部分正電荷。在極性反應中,這類化合物分子中非金屬原子與金屬原子之間的共價鍵可以異裂,非金屬原子作為親核原子帶著成鍵電子對參與反應,因此稱這類親核試劑為σ鍵型親核試劑。
例如,氫化鋁鋰與羰基化合物反應時,氫化鋁鋰分子中的Al—H鍵發生異裂,氫帶著成鍵電子與羰基碳發生親核加成。
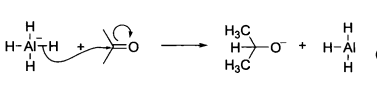 親核加成
親核加成σ鍵型親核試劑的親核原子可以是雜原子(如NaNH2或KOH),也可以是碳原子(如RMgBr、RLi和R2CuLi)或氫原子(如NaBH4和LiAIH4)。但是,強極性的非金屬一金屬鍵Nu—M常被認為是離子鍵(Nu-M+)。例如下圖所示的幾種試劑通常寫成離子鍵的形式:
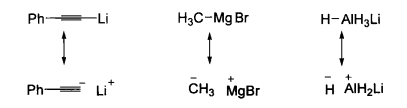 有機金屬試劑的離子鍵結構示意圖
有機金屬試劑的離子鍵結構示意圖按這樣的寫法,這類試劑也可分類為未共用電子對型親核試劑。
π鍵親核試劑
利用π鍵的成鍵電子對與親電試劑的親電原子形成σ鍵。例如,烯烴的π鍵在反應中可以發生
異裂,其中的一個雙鍵碳原子帶著成鍵電子對與親電試劑反應。因此,富電子烯烴是親核試劑。
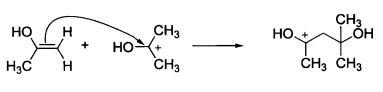 π鍵發生異裂
π鍵發生異裂親核試劑烯烴與親電試劑反應時,總是電子云密度高的雙鍵碳與親電試劑形成新鍵。對於純烷基取代的烯烴,取代較少的碳親核性強,優先與親電試劑結合。
與鹼性關係
由於親核試劑在反應中提供電子,按照Lewis酸鹼理論,提供電子的為鹼,因此,親核試劑通常呈鹼性。許多親核反應在鹼性條件下進行,了解親核性與鹼性的關係很重要。親核試劑的親核性強弱通常用其與親電試劑反生的速率來衡量。
例如,根據其在25℃的水溶液中與CH3Br發生親核取代反應的速率來衡量。因此,親核性是動力學性質。試劑的鹼性是其與H+反應的能力(用平衡常數的負對數表示),是熱力學性質。試劑的親核性與鹼性有聯繫,也有區別。
影響因素
試劑的親核性和鹼性的強弱與親核原子周圍的空間位阻、電荷離域、反應介質等因素均有關係。
1、親核原子周圍立體位阻增加,親核性顯著降低,鹼性則變化不大。
例如,EtO-是強鹼(pKb=17)和強親核試劑,而t-BuO-的親核性則非常小,但鹼性卻略有增加(pKb=19)。這類強鹼弱親核試劑有時也稱為非親核鹼,在親核反應中作為鹼催化劑被廣泛套用。
2、電荷離域使鹼性顯著降低,對親核性影響則較小。例如,EtO-(pKb=17)在較低溫度下與s-BuBr反應,起鹼的作用,生成消除產物2—丁烯;而AcO-(pKb=4.7)在較高的溫度下能作為親核試劑與s-BuBr發生SN2反應生成s-BuOAc。
3、反應介質對試劑的親核性也有重要影響,特別是極性非質子溶劑可以顯著增加試劑的親核性,常作為親核反應的
溶劑。常用的極性非質子溶劑如圖:
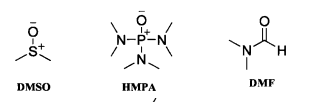 極性非質子溶劑
極性非質子溶劑這些極性非質子溶劑通常具有亞碸、醯胺或磷醯胺的結構,由於共振,處於分子外圍的氧通常帶部分負電荷,而處於分子內部的硫、磷或碳則帶部分正電荷。氟化鈉等親核試劑在這種溶劑中其正離子會被深度溶劑化,使負離子脫離正離子的束縛,親核性顯著增加。
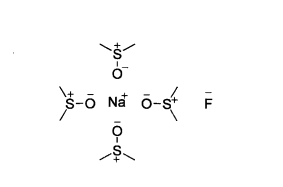 二甲亞碸中氟化鈉的溶劑化
二甲亞碸中氟化鈉的溶劑化 未共用電子對型
未共用電子對型 未共用電子對型親核試劑
未共用電子對型親核試劑 親核加成
親核加成 有機金屬試劑的離子鍵結構示意圖
有機金屬試劑的離子鍵結構示意圖 π鍵發生異裂
π鍵發生異裂 極性非質子溶劑
極性非質子溶劑 二甲亞碸中氟化鈉的溶劑化
二甲亞碸中氟化鈉的溶劑化