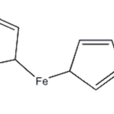
基本介紹
- 中文名:二茂鐵
- 英文名:Ferrocene
- 別稱:雙環戊二烯合鐵
- 化學式:C10H10Fe
- 分子量:186.03
- CAS登錄號:102-54-5
- EINECS登錄號:203-039-3
- 外觀:橙色針狀晶體
- 閃點:100ºC
- 安全性描述:S22 S61
- 危險性描述:R11 R22 R51/53
- 危險品運輸編號:UN 1325
- 線性分子式:Fe(C5H5)2
- 純度:≥99%
- MDL號:MFCD00001427
物理參數,簡介,理論數據,毒理學數據,生態學數據,計算化學數據,質量指標,歷史,電子結構,性質與穩定性,物理性質,化學性質,穩定性,貯存方法,相關反應,親電反應,鋰化反應,還原反應,相關套用,抗震劑,醫藥方面,材料方面,配體,物化性質,衍生物,製備方法,危險說明,
物理參數
蒸汽壓:0.03 mmHg ( 40 °C)
沸點:249 °C(lit.)
熔點:172-174 °C(lit.)
密度:(20°C) 2.69 g/cm3
紫外吸收:λmax 358 nm
簡介
二茂鐵,又稱二環戊二烯合鐵、環戊二烯基鐵,是分子式為Fe(C5H5)2的有機金屬化合物。橙色晶型固體;有類似樟腦的氣味;熔點172.5~173℃,100℃以上升華,沸點249℃;有抗磁性,偶極矩為零;不溶於水、10%氫氧化鈉和熱的濃鹽酸,溶於稀硝酸、濃硫酸、苯、乙醚、石油醚和四氫呋喃。二茂鐵在空氣中穩定,具有強烈吸收紫外線的作用,對熱相當穩定,可耐470℃高溫加熱;在沸水、10%沸鹼液和濃鹽酸沸液中既不溶解也不分解。二茂鐵是最重要的金屬茂基配合物,也是最早被發現的夾心配合物,包含兩個環戊二烯環與鐵原子成鍵。 二茂鐵
二茂鐵
 二茂鐵
二茂鐵二茂鐵的結構為一個鐵原子處在兩個平行的環戊二烯的環之間。在固體狀態下,兩個茂環相互錯開成全錯構型,溫度升高時則繞垂直軸相對轉動。二茂鐵的化學性質穩定,類似芳香族化合物。二茂鐵的環能進行親電取代反應,例如汞化、烷基化、醯基化等反應。它可被氧化為 [Cp2Fe]+,鐵原子氧化態的升高,使茂環(Cp)的電子流向金屬,阻礙了環的親電取代反應。二茂鐵能抗氫化,不與順丁烯二酸酐發生反應。二茂鐵與正丁基鋰反應,可生成單鋰二茂鐵和雙鋰二茂鐵。茂環在二茂鐵分子中能相互影響,在一個環上的致鈍,使另一環也有不同程度的致鈍,其程度比在苯環要輕一些。
二茂鐵由鐵粉與環戊二烯在 300℃的氮氣氛中加熱,或以無水氯化亞鐵與環戊二烯合鈉在四氫呋喃中作用而製得。二茂鐵可用作火箭燃料添加劑、汽油的抗爆劑和橡膠及矽樹脂的熟化劑,也可做紫外線吸收劑。二茂鐵的乙烯基衍生物能發生烯鍵聚合,得到碳鏈骨架的含金屬高聚物,可作航天飛船的外層塗料。
理論數據
毒理學數據
1、急性毒性:大鼠經口LD5O:1320mg/kg;小鼠經口LD5O:832mg/kg
生態學數據
該物質對水有稍微的危害。
計算化學數據
1、 疏水參數計算參考值(XlogP):
2、 氫鍵供體數量:0
3、 氫鍵受體數量:2
4、 可旋轉化學鍵數量:0
5、 互變異構體數量:
6、 拓撲分子極性表面積(TPSA):0
7、 重原子數量:11
8、 表面電荷:0
9、 複雜度:11.6
10、同位素原子數量:0
11、確定原子立構中心數量:0
12、不確定原子立構中心數量:0
13、確定化學鍵立構中心數量:0
14、不確定化學鍵立構中心數量:0
15、共價鍵單元數量:3
質量指標
二茂鐵的質量分數 ≥98.0% 游離鐵 ≤200X10-6
熔點 172~174℃ 甲苯不溶物 ≤0.5%
歷史
二茂鐵的發現純屬偶然。1951年,杜肯大學的 Pauson 和 Kealy 用環戊二烯基溴化鎂處理氯化鐵,試圖得到二烯氧化偶聯的產物富瓦烯(Fulvalene,如圖),但卻意外得到了一個很穩定的橙黃色固體。 當時他們認為二茂鐵的結構並非夾心,而是如右圖所示,並把其穩定性歸咎於芳香的環戊二烯基負離子。與此同時,Miller、Tebboth 和 Tremaine 在將環戊二烯與氮氣混合氣通過一種還原鐵催化劑時也得到了該橙黃色固體。
羅伯特·伯恩斯·伍德沃德和傑弗里·威爾金森,及恩斯特·奧托·菲舍爾分別獨自發現了二茂鐵的夾心結構,並且後者還在此基礎上開始合成二茂鎳和二茂鈷。NMR光譜和X射線晶體學的結果也證實了二茂鐵的夾心結構。二茂鐵的發現展開了環戊二烯基與過渡金屬的眾多π配合物的化學,也為有機金屬化學掀開了新的帷幕。
1973年慕尼黑大學的恩斯特·奧托·菲舍爾及倫敦帝國學院的傑弗里·威爾金森爵士被授予諾貝爾化學獎,以表彰他們在有機金屬化學領域的傑出貢獻。
電子結構
穆斯堡爾譜學數據顯示,二茂鐵中心鐵原子的氧化態為+2,每個茂環帶有一個單位負電荷。因此每個環含有6個π電子,符合休克爾規則中4n+2電子數的要求(n為非負整數),每個環都有芳香性。每個環的6個電子*2,再加上二價鐵離子的6個d電子正好等於18,符合18電子規則,因此二茂鐵非常穩定。
二茂鐵中兩個茂環可以是重疊的(D5h),也可以是錯位的(D5d),它們之間的能壘僅有8-20kJ/mol。重疊構型可能是比較穩定的,但在晶體中分子間作用能在數量級上與能壘差不多大或略大些,所以各種各樣的構型都可存在。
性質與穩定性
物理性質
二茂鐵是對空氣穩定的橙黃色固體,在真空和加熱時迅速升華。和其他對稱且不含電荷的物質類似,二茂鐵可溶於大多數有機溶劑,如苯,但不溶於水。
二茂鐵在100°C時顯著升華。
化學性質
二茂鐵不適於催化加氫,也不作為雙烯體發生Diels-Alder反應,但它可發生傅-克醯基化及烷基化反應。
穩定性
1.避免與氧化劑接觸。
2.該試劑化學性質穩定,400C以內不分解,高於400C加熱分解釋放出辛辣的具刺激性的煙霧。對空氣和濕氣不敏感,不易與酸或鹼反應,但對氧化劑較敏感。此外,應避免吸入或與皮膚接觸,長時間暴露於其中可引起肝部損傷。
貯存方法
1.儲存於陰涼、通風的庫房。遠離火種、熱源、防靜電。防止陽光直射。保持容器密封。應與氧化劑分開存放,切忌混儲。配備相應品種和數量的消防器材。儲區應備有泄漏應急處理設備和合適的收容材料。
相關反應
親電反應
二茂鐵具有芳香化合物的顯著特徵,可與親電試劑反應生成二茂鐵的取代衍生物。大多數取代的類型是1-取代物、1,1'-二取代物及1,2-二取代物(帶“'”表示在A環上,不帶則表示在B環上)。例如二茂鐵與三氯化鋁和 Me2NPCl2 在熱庚烷中反應生成二氯二茂鐵膦(Dichloroferrocenyl phosphine),當與苯基二氯化膦在類似條件下反應得到 P,P-二氯雙(二茂鐵)-P-苯基膦。與苯甲醚類似,二茂鐵與 P4S10 反應生成 Dithiadiphosphetane disulfide。二茂鐵不可以直接硝化和鹵化,因為會先發生氧化反應。
二茂鐵可發生傅-克反應,譬如在磷酸作催化劑時,二茂鐵與乙酸酐或乙醯氯反應生成乙醯基二茂鐵。雖然一方面二茂鐵許多反應類似於芳香烴的相應反應,但另一方面有些反應明顯是鐵原子在起主要作用。
鋰化反應
用丁基鋰可以很快奪取二茂鐵中的質子,產物為1,1'-二鋰代二茂鐵,是很強的親核試劑。它與二乙基二硫代氨基甲酸硒反應,生成的產物具有位阻,兩個環戊二烯基配體靠硒原子連線。該產物可通過加熱開環聚合反應(ROP)生成聚硒化二茂鐵(Poly(ferrocenyl selenide)),矽和磷的類似反應也可合成相應的聚合物(Poly(ferrocenylsilane) 和 Poly(ferrocenylphosphine))。
還原反應
二茂鐵在酸性溶液很容易被氧化為藍色順磁性的二茂鐵鎓離子 [(η5-C5H5)2FeIII]+,其電勢以飽和甘汞電極為標準大約為0.5V。由於產物二茂鐵反應性不強且易於分離,該離子有時被用作氧化劑,以六氟磷酸鹽 [PF6]− 或氟硼酸鹽 [BF4]− 的形式存在。環上不同的取代基會使該電勢值產生變化:吸電子基(如羧基)使得電極電勢值上升;而給電子基(如甲基)則使得該值下降,氧化變得容易。全甲基取代二茂鐵被氧化後生成的鹽 [Fe(η5-C5Me5)2][tcne] (tcne=四氰乙烯)具有不尋常的磁性性質,為深綠色晶體,含有陽離子與陰離子交替出現的長鏈。
二茂釕和鋨的類似陽離子 [MIII(η5-C5H5)2]+ 卻是不穩定的,容易進一步氧化為 [MIV(η-C5H5)2]2+ 陽離子或二聚成為 [(η5-C5H5)2MIII-MIII(η5-C5H5)2]2+。
相關套用
二茂鐵自身的套用並不多,但用已知的方法可以合成出種類繁多的衍生物,大大延伸了二茂鐵的套用範圍。
抗震劑
二茂鐵及其衍生物是汽油中的抗震劑,它們比曾經使用過的四乙基鉛安全得多。在英國的 Halfords 可以買到含二茂鐵的汽油添加劑,它尤其適用於以前專為四乙基鉛抗震劑設計的車輛。二茂鐵分解出的鐵沉積在火花塞表面,增強了其導熱性。
添加二茂鐵同樣也可以減少柴油車冒出的煤煙。
醫藥方面
某些二茂鐵的鹽類具有抗癌活性,如他莫昔芬的二茂鐵同類物,其機理為,他莫昔芬可以與雌激素結合,其細胞毒性可以殺死癌細胞。
材料方面
二茂鐵容易升華的性質可被用於沉積某種特定的富勒烯或碳納米管。
醛和鏻鹽在氫氧化鈉存在下發生維蒂希反應生成乙烯基二茂鐵。該化合物聚合得到類似於聚苯乙烯的聚合物,其中苯基被二茂鐵基取代。
配體
手性二茂鐵膦配體套用於一些過渡元素催化的反應。工業上套用此類反應合成藥物及農用化學品。
雙二苯基膦二茂鐵(dppf)是有機合成中重要的配體,許多偶聯反應的機理即是基於其鈀配合物的生成。
物化性質
桔黃色針狀結晶。熔點172.5-173℃,100℃以上升華,沸點249℃。溶於稀硝酸、濃硫酸、苯、乙醚、石油醚和四氫呋喃,在稀硝酸和濃硫酸中生成帶藍色螢光的深紅色溶液。不溶於水、10%氫氧化鈉和熱的濃鹽酸,這些溶劑的沸液中,二茂鐵既不溶解也不分解,能隨水蒸氣揮發,有類似樟腦的氣味,在空氣中穩定,具有強烈吸收紫外線的作用,對熱相當穩定,可耐470℃高溫加熱。
衍生物
五羰基鐵與環戊二烯在高壓釜中於135°C反應得到一種深紅紫色晶體的雙核絡合物環戊二烯基羰基鐵 [Fe(η5-C5H5)(CO)2]2,它對空氣和水都是穩定的。結構測定表明該化合物中兩個成橋羰基及兩個鐵原子共平面,且存在 Fe-Fe 鍵。環戊二烯基羰基鐵很容易製備,並且在有機合成中有廣泛套用。
製備方法
由鐵粉與環戊二烯在300℃的氮氣氛中加熱,或以無水氯化亞鐵與環戊二烯合鈉在四氫呋喃中反應而得,也可採用電解合成法,採用環戊二烯、氯化亞鐵、二乙胺為原料合成二茂鐵可按下法操作。攪拌下,向四氫呋喃中分次投入無水氯化鐵(FeCL3),再加入鐵粉,在氮氣保護下加熱回流4.5h,得到氯化亞鐵溶液。減壓蒸除溶劑四氫呋喃,得近乾的殘留物。在冰浴冷卻下,加入環戊二烯和二乙胺的混合液,在室溫下猛烈攪拌6-8h,減壓蒸除多餘的胺,殘留物用石油醚回流萃取。將萃取液趁熱過濾,蒸除溶劑後,即得二茂鐵粗品。用戊烷或環已烷重結晶,或採用升華法提出純,即為精製品收率73-84%。
危險說明
危險代碼: F,Xn
危險等級:11-22
安全等級:16-22-36-61
聯合國編號:UN1325