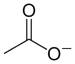
鹽在化學中,是指一類金屬離子或銨根離子(NH4+)與酸根離子或非金屬離子結合的化合物,如硫酸鈣,氯化銅,醋酸鈉,一般來說鹽是複分解反應的生成物,如硫酸與氫氧化鈉生成硫酸鈉和水,也有其他的反應可生成鹽,例如置換反應等。
鹽分為單鹽和合鹽,單鹽分為正鹽、酸式鹽、鹼式鹽,合鹽分為復鹽和絡鹽。其中酸式鹽除含有金屬離子與酸根離子外還含有氫離子,鹼式鹽除含有金屬離子與酸根離子外還含有氫氧根離子,復鹽溶於水時,可生成與原鹽相同離子的合鹽;絡鹽溶於水時,可生成與原鹽不相同的複雜離子的合鹽-絡合物。
通常在標準狀況下,不可溶的鹽會是固態,但也有例外,例如熔鹽(英語:Molten salt)及離子液體。可溶鹽的溶液及熔鹽有導電性,因此可作為電解質。包括細胞的細胞質、血液、尿液及礦泉水中都含有許多不同的鹽類。
基本介紹
- 中文名:鹽
- 外文名:Salt
- 分類:單鹽和合鹽
定義
分類
單鹽
 鹼式碳酸銅
鹼式碳酸銅合鹽
性質
物理性質
化學性質
- 和酸發生反應。複分解反應。
- 酸+鹽→新鹽+新酸(強酸→弱酸)這裡的鹽可以是不溶性鹽。
2HCl+Na2CO3→H2O+CO2↑+2NaCl - 碳酸不穩定會繼續分解成水和二氧化碳。
- 鹼(可溶)+鹽(可溶)→新鹼+新鹽
2NaOH+CuSO4→Cu(OH)2↓+Na2SO4
- 和鹽發生反應。複分解反應。
- 鹽(可溶)+鹽(可溶)→兩種新鹽
CuSO4+BaCl2→BaSO4↓+CuCl2
- 和某些金屬反應。置換反應
- 鹽+金屬(某些)→新金屬+新鹽 反應中的金屬一定要比鹽中的金屬活潑才可以把它給置換出來。請看金屬活動性。
Zn+CuSO4→ZnSO4+Cu
製備
- 鹽也可以由不同的鹽溶液混合,其中的離子發生重組,形成溶解度較低的鹽(另見:溶解平衡),
- 例如Pb(NO3)2(aq) + Na2SO4(aq) → PbSO4(s) + 2 NaNO3(aq)