基本介紹
置換反應可表示為A+BC=B+AC 或 AB+C=AC+B,通常認為置換反應都是
氧化還原反應,但是一些特殊的反應,例如
金屬羰基化合物間的置換,則不是氧化還原反應。
 置換反應
置換反應除此之外,也可以指
路易斯酸間的置換反應,此時並不需要
單質參與反應。(出處:高等教育出版社的《無機化學》(第四版)下冊第460頁正文第3行:“……能將另一個較弱的
路易斯酸MnF4從穩定配離子[MnF6] 2-的鹽中
置換出來”)
反應的吸熱與放熱
1、放熱的反應
(1)金屬和酸發生的置換反應
(2)金屬和鹽發生的置換反應
(3)鋁和金屬氧化物發生的置換反應
(4)活潑金屬和水的置換反應
2、吸熱的反應
(1)不太活潑的金屬和水蒸氣發生的置換反應
(2)碳、氫氣還原金屬氧化物的反應
(3)碳和水蒸氣的置換反應
反應類型
根據反應環境分類
根據反應環境的類別,置換反應有以下2種情況:
(1)固態置換在加熱或高溫條件下固體與固體或固體與氣體發生的置換反應。
1、金屬跟酸的置換:金屬原子與酸溶液中氫離子(H+)之間的反應 特別注意:(1)不能用
濃硫酸,
硝酸等有強氧化性的酸,它們反應時,先將金屬氧化成對應氧化物,氧化物再溶於酸中,然後繼續氧化、
溶解,反應得以繼續。(2)金屬在活動性順序表中需位於氫(H)之前
鎂和酸反應【Mg+2H+====Mg2++H2↑】
鋁和酸反應【2Al+6H+====2Al3++3H2↑】
鋅和酸反應【Zn+2H+====Zn2++H2↑】
鐵和酸反應【Fe+2H+====Fe2++H2↑】(一般情況下,鐵與酸反應生成二價鐵)
2、金屬跟鹽溶液的置換:金屬原子跟鹽溶液中較不活潑金屬的陽離子發生置換 特別注意:置換需滿足金屬活動性順序表先後次序
根據元素性質分類
分類標準:按元素的性質劃分,金屬與非金屬單質間的置換
鋅和鹽酸反應【Zn+2HCl====ZnCl2+H2↑】
鈉和水反應【2Na+2H2O====2NaOH+H2↑】
鎂在二氧化碳中燃燒【2Mg+CO
2==點燃==2MgO+C】
紅熱的鐵和水蒸氣反應【3Fe+4H2O(g)==高溫==Fe3O4+4H2】(H2不標氣體符號)
鈉在二氧化碳中燃燒【4Na+3CO2====2Na2CO3+C】
3、非金屬單質置換金屬單質
4、非金屬單質置換非金屬單質
氟氣溶於水【2F2+2H2O====4HF+O2】(O2不標氣體符號)
碳還原二氧化矽【2C+SiO2==高溫==Si+2CO↑】
碳和水蒸氣反應【C+H2O==高溫==CO+H2】(不標氣體符號)
氫氣還原四氯化矽【2H
2+SiCl
4==高溫==Si+4HCl】(HCl不標氣體符號)
氯氣置換溴【Cl2+2NaBr====Br2+2NaCl】
溴置換碘【Br2+2HI====2HBr+I2】
氧氣和硫化氫反應【O2+2H2S====2S↓+2H2O】
根據元素周期表中位置分類
按元素在周期表的位置劃分,同族元素單質間的置換與不同族元素單質間的置換。
鈉置換鉀【Na+KCl==高溫==NaCl+K↑】(一般是774℃)
鈉置換氫【2Na+2H2O====2NaOH+H2↑】
氧置換硫【O2+2H2S====2S↓+2H2O】
碳置換矽【2C+SiO2==高溫==Si+2CO↑】
氟置換氯【F2+2HCl====2HF+Cl2】(Cl2不標氣體符號)
2、不同主族元素單質間的置換
鎂置換氫【Mg+2H+====Mg2++H2↑】
鋁置換氫【2Al+6H+====2Al3++3H2↑】
鎂置換碳【2Mg+CO2==點燃==2MgO+C】
碳置換氫【C+H2O(g)==高溫==CO+H2】(不標氣體符號)
氫置換矽【2H2+SiCl4==高溫==Si+4HCl】(HCl不標氣體符號)
氯置換硫【H2S+Cl2====S↓+2HCl】
氯置換氮【8NH3+3Cl2====6NH4Cl+N2】
氧置換氮【4NH3+3O2==點燃==2N2+6H2O】(氨氣在純氧中燃燒)
4、副族元素的單質置換主族元素單質
5、副族元素的單質置換副族元素的單質
根據物質類別分類
按物質類別劃分,單質與氧化物間的置換和單質與非氧化物間的置換。
1、單質與氧化物發生置換反應
(1)與H2O反應:生成物之一為H2
鈉【2Na+2H2O====2NaOH+H2↑】
鐵【3Fe+4H2O(g)==高溫==Fe3O4+4H2】(H2不標氣體符號)
氟【2F2+2H2O====4HF+O2】(O2不標氣體符號)
碳【C+H2O(g)==高溫==CO+H2】(不標氣體符號)
(2)與CO2反應:生成物之一為C
鎂【2Mg+CO2==點燃==2MgO+C】
鈉【4Na+3CO2====2Na2CO3+C】
(3)與FeO反應:生成物之一為Fe
碳【C+FeO==高溫==Fe+CO↑】
矽【Si+FeO==高溫==2Fe+SiO2】
此類反應較多,在此不一一列舉
2、單質與非氧化物發生置換反應
(1)和NH3反應:生成物之一為N2
(2)其它
此類反應較多,在此不一一列舉
金屬活動性順序表
Li、Cs、 Rb、 K、Ra、Ba、Fr、Sr、 Ca、 Na 、 La、 Pr 、Nd 、Pm、Sm 、Eu、Ac
鋰、銫、 銣、 鉀、鐳、鋇、鍅、鍶、 鈣、 鈉、 鑭、 鐠、釹、 鉕、釤、銪、 錒、
Gd 、Tb 、Am 、Y 、Mg 、Dy、Tm 、Yb、 Lu 、 Ce、 Ho、 Er 、 Sc、 Pu 、Th 、Be 、Np
釓、鋱、鎇、釔、鎂、鏑、銩、鐿、鑥、 鈰、鈥、鉺、鈧、鈽、釷、鈹、鎿、
U、 Hf 、Al 、Ti 、Zr 、V 、Mn、 Nb、 Zn、 Cr 、Ga 、Fe 、Cd 、In 、Tl 、Co
鈾、鉿、鋁、鈦、鋯、釩、錳、鈮、鋅、鉻、鎵、鐵、鎘、銦、鉈、鈷、
Ni、 Mo、 Sn 、Pb 、(D2)、 (H2)、 Cu、 Po、 Hg 、Ag、 Pd 、Pt 、Au
鎳、鉬、錫、鉛、(氘分子)、(氫分子)、銅、釙、汞、銀、鈀、鉑、金
反應現象
金屬活動性順序簡表(K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au)中,10號氫是過渡元素,它前面的可以置換出氫(有例外,見註解),它後面的則不可以。也就是說:氫前面的可以和酸反應生成氫氣,而氫後面的基本不和酸反應,就算反應也不生成氫氣
1、金屬單質 + 酸 → 鹽 + 氫氣
鎂和酸反應【Mg+2H+====Mg2++H2↑】
鋁和酸反應【2Al+6H+====2Al3++3H2↑】
鋅和酸反應【Zn+2H+====Zn2++H2↑】
鐵和酸反應【Fe+2H+====Fe2++H2↑】
註:
(1)前三項的反應現象為:有氣泡產生
(2)第四項(Fe)的反應現象:有氣泡產生,溶液由無色變成淺綠色
(3)濃鹽酸在加熱時也能與銅(不太活潑的金屬)反應,因為Cl和Cu形成了較穩定的
配離子[CuCl
4],使
平衡向右移動:【2Cu+8HCl(濃)====2H
3[CuCl
4]+H
2↑】
2、金屬單質 + 鹽(溶液)→另一種金屬 + 另一種鹽
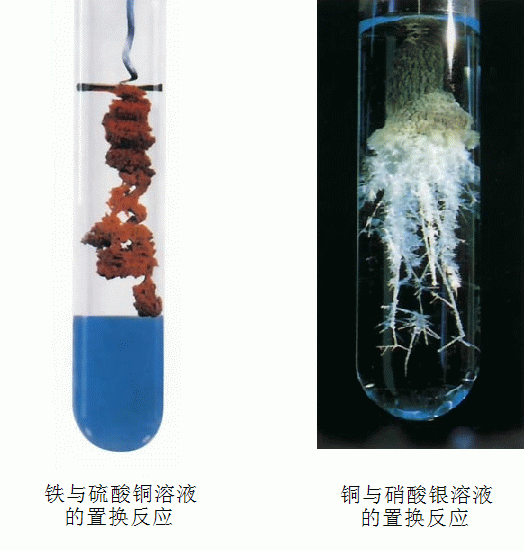
鐵與硫酸銅反應【Fe+CuSO4====Cu+FeSO4】
現象:鐵條表面覆蓋一層紅色的物質,溶液由藍色變成淺綠色。
鋅片放入硫酸銅溶液中【Zn+CuSO4====ZnSO4+Cu】
現象:鋅片表面覆蓋一層紅色的物質,溶液由藍色變成無色。
銅片放入硝酸銀溶液中【Cu+2AgNO3====Cu(NO3)2+2Ag】
現象:銅片表面覆蓋一層銀白色的物質,溶液由無色變成藍色。
3、金屬氧化物+ C或H2→ 金屬 + CO2或H2O 焦炭還原氧化鐵【3C+2Fe
2O
3==高溫==4Fe+3CO
2↑】
現象:紅色粉末變成黑色,
澄清石灰水變渾濁。
木炭還原氧化銅【C+2CuO==△==2Cu+CO2↑】
現象:黑色粉末變成紅色,產生的氣體可以使澄清石灰水變渾濁。
氫氣還原氧化銅【H2+CuO==高溫==Cu+H2O】
現象:黑色粉末變成紅色,試管內壁有水珠生成
氫氣與氧化鐵反應【3H2+Fe2O3==高溫==2Fe+3H2O】
水蒸氣通過灼熱碳層【C+H2O(g)==高溫==CO+H
2】(
水煤氣的製法,不標氣體符號)


 置換反應
置換反應