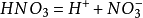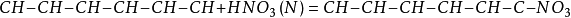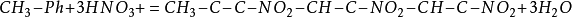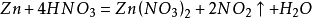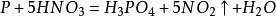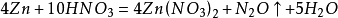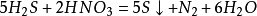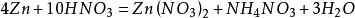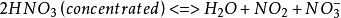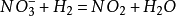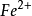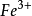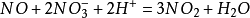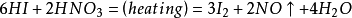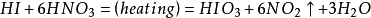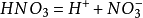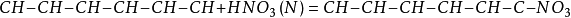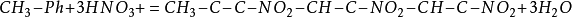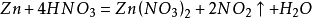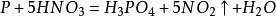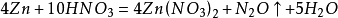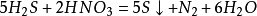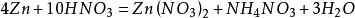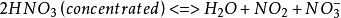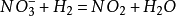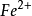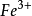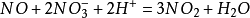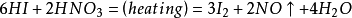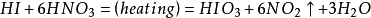發現歷史,存在分布,自然界生成,分子結構,物理性質,化學性質,毒理防範,危險性,急救措施,泄漏應急措施,安全術語,風險術語,製備方法,工業合成,實驗室製法,套用領域,存儲運輸,操作,儲存,運輸,人體影響,
發現歷史
公元八世紀,阿拉伯
鍊金術士
賈比爾·伊本·哈揚(
Jabir ibn Hayyan)在乾餾
硝石的時候發現並製得了硝酸,這是人類關於硝酸最早的記錄。
 賈比爾·伊本·哈揚
賈比爾·伊本·哈揚1905年,挪威出現了
電弧法生產硝酸的工廠,這是歷史上最早的硝酸工業化嘗試。
1908年,德國建成了以鉑網為催化劑的日產能力3噸的硝酸廠。
1913年,合成
氨問世,氨氧化法生產硝酸開始進入工業化階段,至今依然是世界上生產硝酸的主要方法。
1935年,在中國化學家
侯德榜的領導下,中國建成了第一座兼產
合成氨、硝酸、硫酸和
硫酸銨的聯合企業-永利寧廠。
中國硝酸工業的發展
1937年2月,永利寧廠第一次生產出優質的硝酸,但開工不到半年就遇上日本發動侵華戰爭。由於硝酸與國防工業密切相關,日方多次威逼永利寧廠合作,均遭侯德榜拒絕,因此工廠遭日機轟炸而停產。 1945年8月
日本投降後,硝酸生產逐漸恢復,但仍然處於十分落後的狀態,在1949年,中國的硝酸生產企業只有兩家:永利寧廠和大連化學廠(現大連化學工業公司),
1951年5月,大連化學廠的煉焦、合成氨、硝酸和硫酸等車間的生產得到了全面的恢復,產出了硝酸產品。
1952~1958年之間,中國先後在吉林、蘭州、太原等地建成了
綜合法硝酸裝置,其中蘭州化學工業公司的
濃硝酸在1997年之前的幾十年里一直蟬聯著中國最大裝置的桂冠。
1980年起,中國國內硝酸產業的發展開始加速,總產量每年以10%~15%的速度增長。特別是90年代後期,中國的
硝酸工業進入蓬勃發展時期,總產量年增速達到了15%~20%。但這個時期中國硝酸生產技術仍然比較落後,早期的常壓法、綜合法工藝裝置多為淘汰型生產線,高壓法裝置全部靠進口國外的
二手設備。不久,山西化肥廠(現
天脊集團)從國外引進了中國第一套雙加壓硝酸裝置,從此中國的硝酸工業開始向國際先進行列邁進。 1999年,
西安陝鼓動力股份有限公司成功研製出中國第一套“四合一”機組,並套用於雲南
雲峰化學工業公司,從此加快了中國硝酸雙加壓工藝國產裝備向國際先進水平進軍的步伐。雲南雲峰化學工業公司作為第一個使用國產化“四合一”機組的硝酸生產企業,堅定了中國國內硝酸生產企業選擇國產裝備的信心。
2000年後,中國的硝酸工業進入高速發展期,年總產量以高於18%的速度快速增長,擁有各種種類、規模不等的生產廠家約60多家。
2007年11月,中國第一套在滿負荷生產條件下實現副產蒸汽自足、還能富餘外供蒸汽的國產化雙加壓法硝酸裝置在新鄉市永昌化工
有限責任公司誕生,標誌著中國自己研製的國產硝酸裝置完全能夠替代進口,中國國內硝酸工業擺脫了對進口裝備的依賴。
存在分布
自然界中的硝酸主要由雷雨天生成的
一氧化氮或微生物生命活動放出
二氧化氮形成。人類活動也產生氮氧化物,全世界人為污染源每年排出的氮氧化物大約為5300萬噸,這些氮氧化物也會形成硝酸。硝酸性質不穩定,因而無法在自然界長期存在,但硝酸的形成是氮循環的一環。
自然界生成
1.一氧化氮的生成:N2 + O2=閃電=2NO
2.二氧化氮的生成:2NO+ O2=2NO2
3.生成的二氧化氮溶於水中生成硝酸:3NO2+ H2O=2HNO3+ NO
4.有些
海鞘(
Ciona intestinalis)也能分泌硝酸禦敵
分子結構
硝酸分子為平面共價分子,中心氮原子sp
2雜化,未參與雜化的一個p軌道與兩個端氧形成三中心四電子鍵。硝酸中的羥基氫與非羥化的氧原子形成分子內
氫鍵,這是硝酸酸性不及硫酸、鹽酸,熔沸點較前兩者低的主要原因。
鍵長:
O-N:119.9pmO'-N:121.1pm
O-H:96.4pm
N-OH:140.6pm鍵角:
O'-N-O:130.27°
O-N-OH:113.85°O'-N-OH:115.88°N-O-H:102.2°
物理性質
純硝酸為無色透明液體,濃硝酸為淡黃色液體(溶有
二氧化氮),正常情況下為無色透明液體,有窒息性刺激氣味。濃硝酸含量為68%左右,易揮發,在空氣中產生白霧(與濃鹽酸相同),是硝酸蒸汽(一般來說是濃硝酸分解出來的二氧化氮)與水蒸汽結合而形成的硝酸小液滴。露光能產生二氧化氮,二氧化氮重新溶解在硝酸中,從而變成棕色。有
強酸性。能使羊毛織物和動物組織變成嫩黃色。能與乙醇、
松節油、碳和其他有機物猛烈反應。能與水混溶。能與水形成
共沸混合物。相對密度(d204)1.41,熔點-42℃(無水),沸點120.5℃(68%)。對於稀硝酸, 一般我們認為濃稀之間的界線是6mol/L,市售普通試劑級硝酸濃度約為68%左右,而工業級濃硝酸濃度則為98%,通常發煙硝酸濃度約為98%。
化學性質
不穩定性
濃硝酸不穩定,遇光或熱會分解而放出二氧化氮,分解產生的二氧化氮溶於硝酸,從而使外觀帶有淺黃色。但稀硝酸相對穩定。
反應方程式:4HNO3=光照=4NO2↑+O2↑+2H2O
4HNO3=△=4NO2↑+O2↑+2H2O
酯化反應(強酸性)
硝酸可以與醇發生酯化反應生成對應的硝酸酯,在機理上,硝酸參與的
酯化反應過去被認為生成了碳正離子中間體,但許多文獻將機理描述為費歇爾酯化 反應(
Fischer esterification),即“酸脫羥基醇脫氫”與羧酸的酯化機理相同。
硝酸作為氮元素的最高價(+5)水化物,具有很強的酸性,一般情況下認為硝酸的水溶液是完全電離的。硝酸可以與
醇發生酯化反應,如
硝化甘油的製備。(實際上我們會使用
濃硫酸,產生大量NO
2),成本較低而且較容易處理,與其他更強的脫水劑,例如P
4O
10,也可以產生大量的硝醯陽離子,這是
硝化反應能進行的本質。
3nHNO3+ [C6H7O2(OH)3]n——→ [C6H7O2(O-NO2)3]n+ 3nH2O
硝化甘油的製作,方程式見下:
硝化反應
濃硝酸或發煙硝酸與脫水劑(
濃硫酸、五氧化二磷)混合可作為硝化試劑對一些化合物引發
硝化反應,硝化反應屬於
親電取代反應(
electrophilic substitution),反應中的親電試劑為硝鎓離子,脫水劑有利於硝鎓離子的產生。
最為常見的硝化反應是苯的硝化:
這種反應常被利用來生產2,4,6—三硝基甲苯(即TNT),方程式:
氧化還原反應
硝酸分子中氮元素為最高價態(+5)因此硝酸具有強氧化性,其
還原產物因硝酸濃度的不同而有變化,從總體上說,硝酸濃度越高,平均每分子硝酸得到的電子數越少,濃硝酸的還原產物主要為
二氧化氮,
稀硝酸主要為一氧化氮,更稀的硝酸可以被還原為
一氧化二氮、
氮氣、
硝酸銨等,需要指出的是,上述只是優勢產物,實際上隨著反應的進行,硝酸濃度逐漸降低,所有還原產物都可能出現。
硝酸有關電勢圖見下:(標況 E/V)
HNO3—0.803→NO2—1.07→HNO2—0.983→NO—1.591→N2O—1.77→N2—0.27→NH4+
HNO3—0.957→NO
HNO3—1.11→N2O
HNO3—1.24→N2
HNO3—0.88→NH4+
典型反應
濃硝酸:
稀硝酸:
很稀硝酸:
極稀硝酸:
反應注意事項:
2、由於硝酸的強氧化性,所以不可以通過硝酸來製取氫氣,氫離子剛從硝酸中置換出來為氫氣,就被硝酸根離子氧化了。
3、硝酸的強氧化性不是來自硝酸根離子(硝酸根離子本身無氧化性),而是在酸性條件下的硝酸根離子才會有強氧化性。(例:在硝酸亞鐵溶液中滴加鹽酸,溶液顏色由綠變黃,滴加硫氰化鉀溶液,溶液變為血紅色。證明亞鐵離子(
)被再一次氧化成鐵離子(
).
4、硝酸的氧化性與其濃度成正比。稀硝酸與金屬反應生成一氧化氮,濃硝酸與金屬反應同樣也會生成一氧化氮,但濃硝酸的氧化性比稀硝酸強,一氧化氮剛反應出來,就被硝酸根離子在氫離子存在的情況下氧化成二氧化氮。方程式如下:
碘化氫與不同濃度的硝酸反應,把碘離子分別氧化成碘單質和碘酸根離子:
毒理防範
危險性
與硝酸蒸氣接觸有很大危險性。硝酸溶液及硝酸蒸氣對皮膚和黏膜有強刺激和腐蝕作用。濃硝酸煙霧可釋放出五氧化二氮(硝酐)遇水蒸氣形成酸霧,可迅速分解而形成
二氧化氮,濃硝酸加熱時產生硝酸蒸氣,也可分解產生二氧化氮,吸入後可引起急性氮氧化物中毒。人在低於12ppm(30mg/m
3)左右時未見明顯的損害。吸入可引起肺炎。大鼠吸入LC50 49 ppm/4小時。國外報導3例吸入硝酸煙霧後短時間內無呼吸道症狀。4-6h後進行性呼吸困難。入院後均有發紺及口、鼻流出泡沫液體。給機械通氣及100%氧氣吸入。在24h內死亡。經屍檢,肺組織免疫組織學分析及電鏡檢查表明細胞損傷可能由於二氧化氮的水合作用產生自由基所引起的,此種時間依賴的作用可能是遲發性肺損傷症狀的部分原因。 吸入硝酸煙霧可引起急性中毒。口服硝酸可引起腐蝕性口腔炎和
胃腸炎,可出現
休克或
腎功能衰竭等。
危險性類別:酸性腐蝕品、氧化劑、易制爆、強腐蝕(含量高於70%)/氧化劑(含量不超過70%)。
侵入途徑:吸入、食入。
健康危害:吸入硝酸氣霧產生呼吸道刺激作用,可引起急性肺水腫。口服引起腹部劇痛,嚴重者可有胃穿孔、腹膜炎、喉痙攣、腎損害、休克以及窒息。眼和皮膚接觸引起灼傷。 慢性影響 長期接觸可引起牙齒酸蝕症。
環境危害:對環境有害。
燃爆危險:助燃。與可燃物混合會發生爆炸。
急救措施
皮膚接觸:立即脫去污染的衣著,用大量流動清水沖洗20~30分鐘。如有不適感,就醫。
眼睛接觸:立即提起眼瞼,用大量流動清水或生理鹽水徹底沖洗10~15分鐘。如有不適感,就醫。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。呼吸、心跳停止,立即進行心肺復甦術。就醫。
食入:用水漱口,給飲牛奶或蛋清。就醫。
泄漏應急措施
應急處理:根據液體流動和蒸氣擴散的影響區域劃定警戒區,無關人員從側風、上風向撤離至安全區。建議應急處理人員戴正壓自給式呼吸器,穿防酸鹼服。作業時使用的所有設備應接地。穿上適當的防護服前嚴禁接觸破裂的容器和泄漏物。儘可能切斷泄漏源。防止泄漏物進入水體、下水道、地下室或密閉性空間。噴霧狀水抑制蒸氣或改變蒸氣雲流向,避免水流接觸泄漏物。勿使水進入包裝容器內。小量泄漏:用乾燥的砂土或其它不燃材料覆蓋泄漏物。大量泄漏:構築圍堤或挖坑收容。用飛塵或石灰粉吸收大量液體。用農用石灰(CaO)、碎石灰石(CaCO3)或
碳酸氫鈉(NaHCO3)中和。用抗溶性泡沫覆蓋,減少蒸發。用耐腐蝕泵轉移至槽車或專用收集器內。
安全術語
S23:Do not breathe vapour.切勿吸入蒸汽。
S26:In case of contact with eyes, rinse immediately with plenty of water and seek medical advice.
不慎與眼睛接觸後,請立即用大量清水沖洗並徵求醫生意見。
S36:Wear suitable protective clothing.穿戴適當的防護服。
S45:In case of accident or if you feel unwell, seek medical advice immediately (show the label whenever possible.)
若發生事故或感不適,立即就醫(可能的話,出示其標籤)。
R8:Contact with combustible material may cause fire.與可燃物料接觸可能引起火災。
R35:Causes severe burns.引起嚴重灼傷。
風險術語
R8:Contact with combustible material may cause fire. 與可燃物料接觸可能引起火災。
R35:Causes severe burns. 引起嚴重灼傷。
製備方法
工業合成
氨氧化法
硝酸工業與合成氨工業密接相關,氨氧化法是工業生產中製取硝酸的主要途徑,其主要流程是將氨和空氣的混合氣(氧:氮≈2:1)通入灼熱(760~840℃)的
鉑銠合金網,在合金網的催化下,氨被氧化成一氧化氮(NO)。生成的一氧化氮利用反應後殘餘的
氧氣繼續氧化為
二氧化氮,隨後將二氧化氮通入水中製取硝酸。(PS:原料二氧化氮是由
氨氧化而得,因此硝酸工業與制氨工業密不可分。)稀硝酸、
濃硝酸、
發煙硝酸的製取在工藝上各不相同。
4NH3 + 5O2 =催化△= 4NO+6H2O
2NO + O2 = 2NO2(工業上制時要不停通入氧氣)
3NO2 + H2O = 2HNO3+ NO (NO循環氧化吸收)
4NO+3O2+2H2O=4HNO3
4NO2+O2+2H2O=4HNO3
工業上也曾使用濃硫酸和硝石制硝酸,但該法耗酸量大,設備腐蝕嚴重,現基本停止使用
NaNO3(s)+ H2SO4(l) ——→ NaHSO4(s)+ HNO3(g)
實驗室製法
設備:燒瓶,
玻璃管,燒杯,橡皮塞,加熱設備(
酒精燈,煤氣燈等)
原理:NaNO3+ H2SO4= △=NaHSO4+ HNO3 (高沸點酸制低沸點酸)
H2SO4(l)+NaNO3(s) => Na2SO4(s)+ HNO3(g) (不揮發酸製備揮發性酸)
步驟:燒瓶中加入沸石,
濃硫酸,硝酸鈉。置於鐵架台上的鐵圈上,鐵圈下隔 石棉網放置加熱設備,燒瓶口用帶有玻璃管的橡皮塞塞住,玻璃管用橡皮管相連,另一頭置於有水的燒杯中。注意事項:加熱硫酸需要用沸石以防止硫酸暴沸,玻璃管連線處要儘量挨在一起,防止反應生成的NO
2泄露,製備完成後要用鹼中和瓶中物質,以免污染環境。
套用領域
1.作為
硝酸鹽和硝酸酯的必需原料,硝酸被用來製取一系列硝酸鹽類氮肥,如硝酸銨、
硝酸鉀等;也用來製取硝酸酯類或含硝基的炸藥。
2.由於硝酸同時具有氧化性和酸性,硝酸也被用來精鍊金屬:即先把不純的金屬氧化成硝酸鹽,排除雜質後再還原。硝酸能使鐵
鈍化而不致繼續被腐蝕。還可供制氮肥、王水、硝酸鹽、
硝化甘油、硝化纖維素、
硝基苯、
苦味酸等.
3.將
甘油放和濃硝酸、濃硫酸中,會生成硝化甘油。這是一種無色或黃色的透明油狀液體,是一種很不穩定的物質,受到撞擊會發生分解,產生高溫,同時生成大量氣體。氣體體積驟然膨脹,產生猛烈爆炸。所以硝化甘油是一種烈性炸藥。
4.硝化炸藥軍事上用得比較多的是2,4,6-
三硝基甲苯(TNT)。它是由甲苯與濃硝酸和濃硫酸反應製得的,是一種黃色片狀物,具有爆炸威力大、藥性穩定、吸濕性小等優點,常用做炮彈、手榴彈、地雷和魚雷等的炸藥,也可用於採礦等爆破作業。 有機合成原料,濃硝酸可將苯、蒽、萘和其他芳香族化合物硝化製取有機原料。如硝酸和硫酸的混酸(工業上常用由30%與苯反應,生成硝基苯,再加氫生成苯胺,它是合成染料、醫藥、農藥的中間體。 製造草酸,以農作物廢料如玉米蕊、甘蔗渣、穀殼、花生殼等為原料與硝酸反應,製取草酸,硝酸與丙烯或乙烯、乙二醇作用也可製取草酸。
存儲運輸
操作
密閉操作,注意通風。操作儘可能機械化、自動化。操作人員必須經過專門培訓,嚴格遵守操作規程。建議操作人員佩戴自吸過濾式防毒面具(全面罩),穿橡膠耐酸鹼服,戴橡膠耐酸鹼手套。遠離火種、熱源,工作場所嚴禁吸菸。防止蒸氣泄漏到工作場所空氣中。避免與還原劑、鹼類、醇類、鹼金屬接觸。搬運時要輕裝輕卸,防止包裝及容器損壞。配備相應品種和數量的消防器材及泄漏應急處理設備。倒空的容器可能殘留有害物。稀釋或製備溶液時,應把酸加入水中,避免沸騰和飛濺。
儲存
儲存於陰涼、通風的庫房。遠離火種、熱源。庫溫不超過30℃,相對濕度不超過80%。保持容器密封。應與還原劑、鹼類、醇類、鹼金屬等分開存放,切忌混儲。儲區應備有泄漏應急處理設備和合適的收容材料。
運輸
鐵路槽車裝載,其中鉛槽車用以輸送98%濃硝酸, 稀硝酸套用不鏽鋼或玻璃鋼增強塑膠槽車或儲罐輸送或儲存。少量採用耐酸陶瓷壇或玻璃瓶包裝,每壇淨重33-40kg。濃硝酸採用耐酸泥封口,稀硝酸採用石膏封口。每壇裝入襯有細煤渣或細礦渣等物的堅固木箱中,以便運輸。包裝上應有明顯的“腐蝕性物品”標誌。因鋁的表面有一層氧化膜,起了鈍化作用,而且經濟,所以鋁是硝酸理想的容器。個體防護禁止皮膚直接接觸,作業操作時應帶耐酸鹼手套,口罩,以及其他勞保用品。
人體影響
硝酸不論濃稀溶液都有氧化性和腐蝕性,因此對人很危險,僅濺到皮膚上也會引起嚴重燒傷。皮膚接觸硝酸後會慢慢變黃,最後變黃的表皮會起皮脫落(硝酸和蛋白質接觸後,會導致黃蛋白反應而變性)。此外,濃硝酸需以深色玻璃瓶盛裝,避免受到光照反應釋出有毒的NO2。