發現歷史,發現,秦陵寶劍發現鉻,分布,元素分布,鉻礦分布,性質特點,基本性質,物理性質,化學性質,冶煉方法,用途,生理功能,近視,含鉻食物,富鉻酵母,產品特點,套用範圍,產品說明,鉻元素的醫學功能,危害,對人體具體危害,危害途徑,監測方法,環境標準,應急處理處置方法,超標事件,鉻的讀音,
發現歷史
發現
鉻是1797年法國化學家
沃克蘭從當時稱為紅色
西伯利亞礦石中發現的。早在1766年,在俄羅斯聖彼得堡任化學教授的德國的列曼曾經分析了它,確定其中含有鉛。1798年沃克蘭給他找到的這種灰色針狀金屬命名為chrom,來自希臘文chroma(顏色)。由此得到鉻的拉丁名稱chromium和
元素符號Cr。差不多在同一個時期里,
克拉普羅特也從
鉻鉛礦中獨立發現了鉻。
 發現者:沃克蘭
發現者:沃克蘭秦陵寶劍發現鉻
我國考古人員在
秦陵挖掘的寶劍,其劍鋒利無比,原因是劍鋒上面覆蓋了一層鉻,聽起來不算神奇,但是可以證明幾千年前我們就發現並使用鉻了。從
秦兵馬俑二號坑出土的青銅劍,長86厘米劍身上有8個棱面,極為對稱均衡。它們歷經2,000年,從地下出土,卻無蝕無銹,光潔如新。用現代科學方法檢測分析,這些青銅劍表面竟塗有一層厚約10微米的氧化膜,其中含鉻2%。

這一發現立即震動了世界,因為這種鉻鹽氧化處理是近代才掌握的先進工藝。據說德國在1937年,美國在1950年才先後發明並申請專利,而且只有在一套比較複雜的設備和工藝流程下才得以實現。秦人的鑄造水平之高,真是不可思議。
尤為值得稱道的是,這些青銅劍的韌性異常驚人。有一口劍,被一具150公斤重的陶俑壓彎了,彎曲度超過45度。當陶俑被移開的一瞬間,奇蹟發生了,青銅劍反彈平直,自然還原。這精湛的鑄劍技藝,令人瞠目結舌,卻不知為何。
分布
元素分布
自然界中主要以鉻鐵礦FeCr
2O
4形式存在。由氧化鉻用鋁還原,或由鉻氨礬或
鉻酸經電解製得。
按照在地殼中的含量,鉻屬於分布較廣的元素之一。它比在它以前發現的鈷、鎳、鉬、鎢都多。這可能是由於鉻的天然化合物很穩定,不易溶於水,還原比較困難。有人認為沃克蘭取得的金屬鉻可能是鉻的
碳化物。
鉻礦分布
亞鉻酸鹽在地殼中的自然儲量超過18億噸,可開採儲量超過8.1億噸。2004年,世界亞鉻酸鹽開採量為1750萬噸, 其中,南非開採763萬噸,哈薩克斯坦327萬噸,印度295萬噸,辛巴威67萬噸,芬蘭58萬噸。中國鉻礦資源比較貧乏,按可滿足需求的程度看,屬短缺資源。總保有儲量礦石1078萬噸,其中富礦占53.6%。鉻礦
產地有56處,分布於西藏、新疆、內蒙古、甘肅等13個省(區),以西藏為最主要,保有儲量約占全國的一半。中國鉻礦床是典型的與
超基性岩有關的
岩漿型礦床,絕大多數屬蛇綠岩型,礦床賦存於蛇綠岩帶中。西藏羅布莎鉻礦和新疆
薩爾托海鉻礦等皆屬此類。從
成礦時代來看,中國鉻礦形成時代以中生代、
新生代為主。
在冶金工業上,
鉻鐵礦主要用來生產鉻鐵合金和金屬鉻。鉻鐵合金作為鋼的添加料生產多種高強度、抗腐蝕、耐磨、耐高溫、耐氧化的特種鋼,如不鏽鋼、耐酸鋼、耐熱鋼、滾珠軸承鋼、彈簧鋼、
工具鋼等。金屬鉻主要用於與鈷、鎳、鎢等元素冶煉特種合金。這些特種鋼和特種合金是航空、宇航、汽車、造船,以及國防工業生產槍炮、飛彈、火箭、艦艇等不可缺少的材料。在耐火材料上,鉻鐵礦用來製造鉻磚、
鉻鎂磚和其他特殊耐火材料。
鉻鐵礦在化學工業上主要用來生產重鉻酸鈉,進而製取其他鉻化合物,用於顏料、紡織、
電鍍、製革等工業,還可製作催化劑和觸媒劑等。
鉻鐵礦是中國的短缺礦種,儲量少,產量低,每年消費量的80%以上依靠進口。鉻具有
親氧性和親鐵性,以親氧性較強,只有在還原和硫的逸度較高的情況下才顯示親硫性。在內生作用條件下鉻一般呈三價。六次酸位的Cr
3+和Al
3+ 、Fe
3+的離子半徑相接近,故它們之間可以呈廣泛的
類質同象。此外,可與鉻類質同象代替的元素還有Mn、Mg、Ni、Co、Zn等,所以在鎂鐵
矽酸鹽礦物和
副礦物中有鉻的廣泛分布。在表生帶強烈氧化條件下(鹼性介質),Cr
3+氧化成Cr
6+形式的鉻
酸根離子,使不活動的鉻離子變成
易溶的鉻陰離子發生遷移。遇極化性很強的離子(如Cu、Pb等),則形成難溶的鉻酸性礦物。
在自然界中已發現的含鉻礦物約有50餘種,分別屬於氧化物類、鉻酸鹽類和
矽酸鹽類。此外還有少數氫氧化物、
碘酸鹽、
氮化物和硫化物。其中氮化鉻和硫化鉻礦物只見於隕 石中。具有工業價值的鉻礦物都屬於鉻尖晶石類礦物,它們的化學
通式為(Mg、Fe
2+)(Cr、Al、Fe
3+)
2O
4或(Mg、Fe
2+)O(Cr、Al、Fe
3+)
2O
3,其Cr
2O
3含量為18%~62%。
有工業價值的鉻礦物,其Cr2O3含量一般都在30%以上,其中常見的是:
1.鉻鐵礦
化學成分為(Mg、Fe)Cr
2O
4,介於亞鐵鉻鐵礦(FeCr2O4,含FeO32.09%、Cr
2O
3 67.91)與鎂鉻鐵礦(MgCr
2O
4,含MgO
20.96%、Cr
2O
3 79.04%)之間,通常有人將亞鐵鉻鐵礦和鎂鉻鐵礦也都稱為鉻鐵礦。鉻鐵礦為
等軸晶系,晶體呈細小的八面體,通常呈粒狀和緻密塊狀集合體,顏色黑色,條痕褐色,
半金屬光澤,硬度5.5,比重4.2~4.8,具弱磁性。鉻鐵礦是
岩漿成因礦物,產於超
基性岩中,當含礦岩石遭受風化破壞後,鉻鐵礦常轉 入
砂礦中。鉻鐵礦是煉鉻的最主要的礦物原料,富含鐵的劣質礦石可作
高級耐火材料。
2.富鉻類晶石
又稱鉻鐵尖晶石或鋁鉻鐵礦。
化學成分為Fe(Cr,Al)
2O
4,含Cr
2O
3 32%~38%。其形態、物理性質、成因、產狀及用途與鉻鐵礦相同。
3.硬鉻尖晶石
化學成分為(Mg、Fe)(Cr、Al)
2O
4,含Cr
2O
3 32%~50%。其形態、
物理性質、成因、產狀及用途也與鉻鐵礦相同。
性質特點
基本性質
中文別名:含鉻色料的通稱;金屬鉻;鉻(微晶);鉻粉;鉻粒;鉻片;鉻單晶片;鉻濺射耙材
英文名稱:Chromium(III) atomic absorption standard solution
英文別名:chromium coating quality balzers 0.7-3.5 mm等
CAS:7440-47-3
EINECS:231-157-5
元素符號:Cr
CAS號:7440-47-3
元素類型:金屬元素
元素在太陽中的含量:(ppm)20
元素在海水中的含量:(ppm)太平洋表面 0.00015
地殼中含量:(ppm)100
原子序數:24
所屬周期:4
所屬族數:VIB
核電荷數:24
電子層:K-L-M-N
外圍電子層排布:3d
54s
1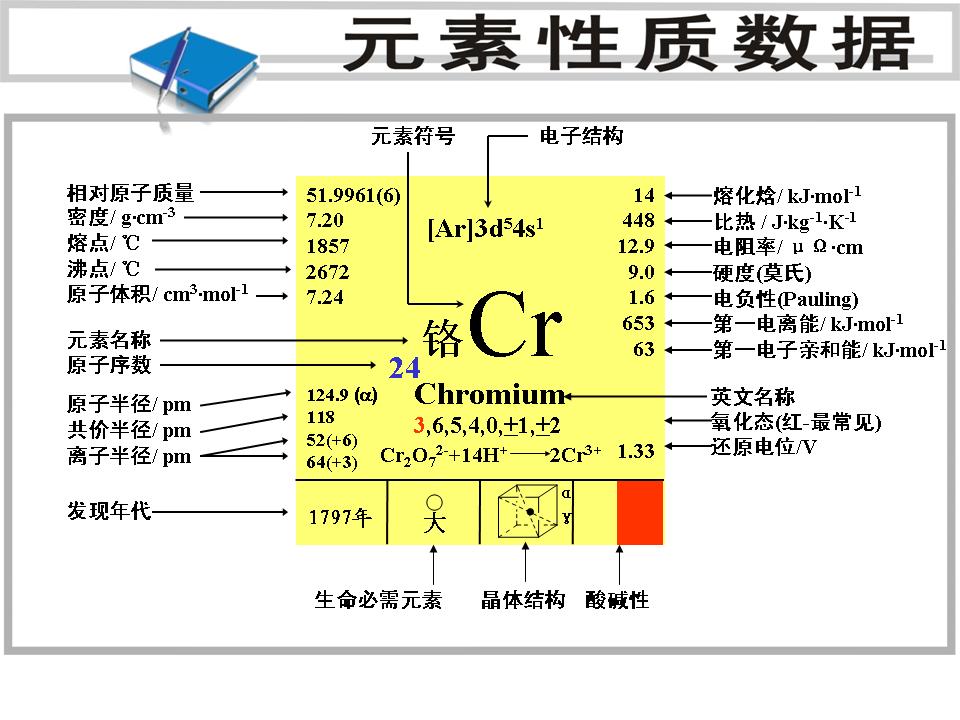
晶體結構:
晶胞為體心立方晶胞,每個晶胞含有2個金屬原子。
氧化態:MainCr+3
OtherCr-2, Cr-1, Cr0, Cr+1, Cr+2, Cr+4, Cr+5, Cr+6
外圍
電子排布: 3d5 4s1核外電子排布: 2,8,13,1
同位素及
放射線: Cr-49[42.3m] Cr-50 Cr-51[27.7d] *Cr-52 Cr-53 Cr-54
電子親合和能: 0 KJ·mol-1
 鉻
鉻第二電離能: 1592 KJ·mol-1
第三電離能: 2987 KJ·mol-1
固態密度: 7.19 g/cm3
液態密度:6.9g/cm3
比熱:448J/kg.K (300K)。
熱導率:90.7W/m.K (300K)。
單質熔點: 1857.0 ℃ 單質沸點: 2672.0 ℃
共價半徑: 1.18 埃
a = 291 pm
b = 291 pm
c = 291 pm
α = 90°
 鉻
鉻β = 90°
γ = 90°
電離能 (kJ /mol)
M - M+ 652.7
M+ - M2+ 1592
M2+ - M3+ 2987
M3+ - M4+ 4740
M4+ - M5+ 6690
M5+ - M6+ 8738
M6+ - M7+ 15550
M7+ - M8+ 17830
M8+ - M9+ 20220
M9+ - M10+ 23580
物理性質
鉻是銀白色有光澤的金屬,純鉻有延展性,含雜質的鉻硬而脆。密度7.20g/cm
3。可溶於
強鹼溶液。鉻具有很高的耐腐蝕性,在空氣中,即便是在赤熱的狀態下,氧化也很慢。不溶於水。鍍在金屬上可起保護作用。
 金屬鉻塊,玻封鉻展示標本
金屬鉻塊,玻封鉻展示標本化學性質
鉻能慢慢地溶於稀鹽酸、稀硫酸,而生成藍色溶液。與空氣接觸則變成綠色,是因為被氧化成綠色的CrCl3的緣故。
Cr + 2HCl= CrCl2 + H2↑
4CrCl2 + 4HCl + O2= 4CrCl3+ 2H2O
鉻與濃硫酸反應,則生成二氧化硫和硫酸鉻(Ⅲ)。
2Cr + 6H2SO4 =Cr2(SO4)3+ 3SO2↑ + 6H2O
但鉻不溶於濃硝酸,因為表面生成緊密的氧化物薄膜而呈鈍態。在高溫下,鉻能與鹵素、硫、氮、碳等直接化合。
鉻與稀硫酸反應。
Cr + H2SO4 = CrSO4 + H2↑
冶煉方法
鋼鐵工業中廣泛套用的鉻鐵合金和
矽鉻合金是用電爐冶煉的。金屬鉻生產則採用金屬熱還原(鋁熱)法及電解法。
鋁熱法生產包括從鉻礦製取氧化鉻和鋁還原氧化鉻製得金屬鉻兩道工序,主要工藝流程如圖。
氧化鉻製取鉻鐵礦磨細至160~200目,配加
純鹼和白雲石,於1050~1150℃下氧化焙燒,再用水逆流浸出(見浸取)和過濾,獲得含Na
2CrO
4大於 200克/升的溶液。加硫酸中和
鉻酸鈉溶液,使其pH為7~8,濾出
氫氧化鋁等雜質後蒸發到含Na
2CrO
4大於 450克/升,濾出Na
2SO
4結晶。溶液用硫酸調整pH為4±0.2,再濾出Na
2SO
4結晶,獲得
重鉻酸鈉(Na
2Cr
2O
7)溶液。濃縮溶液到約含Na
2Cr
2O
71100克/升時,冷卻濾出Na
2SO4結晶,再將溶液濃縮到含Na
2Cr
2O
71500~1550克/升,並於90~100℃保溫8小時,然後冷卻到35℃以下,結晶出重鉻酸鈉。鉻酸鈉轉化成重鉻酸鈉也可用
碳酸法,即在15~16大氣壓下通入含50%CO
2的氣體,析出的沉澱為
碳酸氫鈉:2Na
2CrO
4+2CO
2+H
2O─→Na
2Cr
2O
7+2NaHCO
3碳酸氫鈉可以回收使用。此法可把在
焙燒中配加的純鹼重新回收一半,較硫酸法獲得
硫酸鈉為有利,但
鉻酸鈉不能完全轉化為重鉻酸鈉。
三氧化二鉻的製備可用:①
氯化銨還原法。即在
重鉻酸鈉晶體中配入一定量的氯化銨,混勻後在還原爐中於700~800℃還原,然後洗去NaCl,過濾獲得
三氧化二鉻濾餅,經過乾燥、破碎,在迴轉窯中於1150~1200℃煅燒。用此法獲得的三氧化二鉻呈墨綠色,顆粒較大,純度高,但生產工序多,並產生有害氣體 HCl。②煅燒鉻
酸酐法。即把重鉻酸鈉加入反應鍋中,注入
濃硫酸,在200℃下重鉻酸鈉與硫酸反應生成鉻酸酐:
Na
2Cr
2O
7+2H
2SO
4─→2CrO
3+2NaHSO
4+H
2O靜置後鉻酸酐和硫酸氫鈉沉積成兩層。將上部的
硫酸氫鈉舀出,留在鍋中的鉻酸酐再加熱,用水洗去殘留的硫酸鈉,從底部放出
鉻酸酐。鉻酸酐在800~950℃下煅燒分解,用水洗去未分解的鉻酸酐,過濾獲得三氧化二鉻。用此法工序少,但產品雜質含量較高。③煅燒
氫氧化鉻法。即將含Na
2CrO
4大於 200克/升的溶液加溫至95℃以上,加入純淨的
硫化鈉溶液,攪拌後生成大顆粒氫氧化鉻Cr(OH)
3沉澱。氫氧化鉻在迴轉窯中於1300℃煅燒分解為
三氧化二鉻Cr
2O
3。此法工序少,產品成本低,純度高,但顆粒細,易損失。
鋁熱還原要求原料含 Cr
2O
3大於99%,含硫低於0.02%,含鉛、砷、
錫、銻各低於0.001%。鋁粒粒度應小於0.5毫米,鋁量應不大於理論量的98%。用
硝石、
鎂屑和鋁粒作引火劑。
反應焓ΔH圏=-65.0千卡/摩爾(鋁)。為了保持
自熱反應過程並使金屬粒與渣順利分離,ΔH圏至少應為-72千卡/摩爾(鋁),要添加
硝酸鈉、
氯酸鉀、鉻酸酐或鹼金屬
重鉻酸鹽等供氧劑補充熱量;也可將
混合料預熱到350~400℃再行入爐。還原反應在內砌鎂磚的圓錐形爐筒內進行。先在爐內加入部分混合
爐料,在料面中心加引火劑,點燃後在爐料開始反應時,用流槽連續送入其餘爐料。反應終止,冷卻至室溫,拆開爐筒取出金屬錠,噴砂清除表面
夾渣和
氧化膜。生產大金屬錠,能提高鉻的
回收率,渣的流動性也好。鋁熱法可獲得純度大於98.5%的金屬鉻,其中含鋁不大於0.5%。渣中含Al
2O
3高達90%,可作研磨材料。
電解法生產一般用碳素鉻鐵作原料,採用鉻銨礬法
電解流程(圖2)。把碳素鉻鐵粉碎,溶於電解
陽極返回液、結晶母液和硫酸的混合溶液中,過濾除去
矽酸鹽等殘渣,濾液用
硫酸銨處理並除鐵。純
鉻銨礬溶液經
陳化(保持30~35℃,放置15日)後,結晶出純鉻銨礬Cr
2(SO4)
3·(NH
4)
2SO
4·24H
2O。純鉻銨礬溶於熱水送入隔膜電解槽電解。用不鏽鋼作陰極,鉛銀合金(1%Ag)作陽極,電流密度753安/米2,槽電壓 4.2伏,電解液溫度52~54℃。應控制通過電解液進入陽極室的流速,並準確地控制溶液的pH為2.1~2.4。平均
電流效率 45%,電耗約18.5千瓦·時/公斤。產品純度為99.2~99.4%的片狀金屬鉻,含氧0.3~0.5%,呈脆性。為了提高金屬鉻的純度,可通過真空處理或氫還原降低含氧量。用+6價鉻溶液電解(
電流密度 9500安/米2,溫度84~87℃),可得高純度金屬鉻(含氧0.01~0.02%),但電流效率很低(6~7%)。
用途
鉻用於制不鏽鋼,汽車零件,工具,磁帶和
錄像帶等。 鉻鍍在金屬上可以防鏽,也叫可多米,堅固美觀。
鉻可用於制不鏽鋼。紅、綠寶石的色彩也來自於鉻。作為現代科技中最重要的金屬,以不同百分比熔合的鉻
鎳鋼千變萬化,種類繁多,令人難以置信。
鉻的毒性與其存在的
價態有關,六價鉻比
三價鉻毒性高100倍,並易被人體吸收且在體內蓄積,三價鉻和六價鉻可以相互轉化。天然水不含鉻;海水中鉻的平均濃度為0.05ug/l;飲用水中更低。鉻的污染源有含鉻礦石的加工、金屬
表面處理、皮革鞣製、印染等排放的污水。
鉻是人體必需的微量元素。三價的鉻是對人體有益的元素,而六價鉻是有毒的。人體對無機鉻的吸收利用率極低,不到1%;人體對有機鉻的利用率可達10-25%。鉻在天然食品中的含量較低、均以三價的形式存在。
確切地說,鉻的生理功能是與其它控制代謝的物質一起配合起作用,如激素、胰島素、各種酶類、細胞的基因物質(DNA和RNA)等。
工業上使用的鉻礦石為鉻鐵礦,屬
尖晶石(MgO·Al
2O
3)和
磁鐵礦(FeO·Fe
2O
3)類,其通用
化學式是(Fe,Mg)O·(Cr,Fe,Al
2O
3)。由於二價元素(Mg
2+、Fe
2+、Zn
2+ )和三價元素(Al
3+、Fe
3+、Cr
3+)相互置換,可以出現各種不同成分的礦石。除主成分FeO及Cr
2O
3外,一般含有不同成分的 MgO、Al
2O3 及其他雜質。
礦石結構組成對使用有明顯影響,如鉻尖晶石比鉻鐵礦(FeO·Cr
2O
3)難於還原;含
蛇紋石的鉻礦石,若其中揮發物大於 2%,用它製造的鉻質耐火磚在加熱到1000℃時,會因釋放結晶水而炸裂。美國1978年耗用鉻鐵礦917000噸,其用途分配如下:冶金61%,化工21%,耐火材料18%。1981年倫敦市場鉻礦石價格:土耳其礦(48%Cr
2O
3,Cr/Fe=3)130~135美元/噸,
南非(阿扎尼亞)鉻礦(44%Cr
2O
3)60~70美元/噸。
 鉻
鉻由於鉻合金性脆,作為金屬材料使用還在研究中,鉻主要以
鐵合金(如鉻鐵)形式用於生產不鏽鋼及各種合金鋼。金屬鉻用作
鋁合金、鈷合金、
鈦合金及高溫合金、電阻發熱合金等的添加劑。氧化鉻用作耐光、耐熱的塗料,也可用作磨料,
玻璃、陶瓷的
著色劑,化學合成的催化劑。鹼式硫酸鉻(三價鉻鹽)用作皮革的
鞣劑。鉻礬、
重鉻酸鹽用作織物染色的
媒染劑、浸漬劑及各種顏料。鍍鉻和滲鉻可使鋼鐵和銅、鋁等金屬形成抗腐蝕的表層,並且光亮美觀,大量用於家具、汽車、建築等工業。此外,鉻礦石還大量用於製作
耐火材料。
生理功能
鉻是人體內必需的微量元素之一,它在維持人體健康方面起關鍵作用。鉻對人體十分有利的微量元素,不應該被忽視,它是正常生長發育和調節血糖的重要元素。鉻在人體內的含量約為7毫克,主要分布於骨骼、皮膚、腎上腺、大腦和肌肉之中。那么,鉻元素對人體到底有什麼樣的作用呢?
隨著年齡的增長而逐漸減少,鉻的需要量很少,鉻作為一種必要的微量營養元素在所有胰島素調節活動中起重要作用,它能幫助胰島素促進葡萄糖進入細胞內的效率,是重要的血糖調節劑。在血糖調節方面,特別是對糖尿病患者而言有著重要的作用。它有助於生長發育,並對血液中的膽固醇濃度也有控制作用,缺乏時可能會導致心臟疾病。
當缺乏鉻時,就很容易表現出糖代謝失調,如不及時補充這種元素,就會患糖尿病,誘發冠狀動脈硬化導致心血管病,嚴重的會導致白內障、失明、尿毒症等併發症。
鉻還是葡萄糖耐量因子的組成成分,它可促進胰島素在體內充分地發揮作用。在生理上對機體的生長發育來說,胰島素和生長激素同等重要,缺一不可。胰島素在人體內的作用非常大,既是體內重要的合成激素可促進葡萄糖的攝取、貯存和利用,又可促進脂肪酸的合成,還能促進蛋白質的合成和貯存。因此,青少年想健康、科學的成長發育,一定不能缺少鉻。
有一些人聽說自己缺鉻,就盲目補鉻。把高鉻食物當做營養品來長期服用,使人體處在一個高鉻的狀態。其實盲目地補鉻是不可取的,如果攝取過量鉻的毒性與其存在的價態有極大的關係,六價鉻的毒性比三價鉻高約100倍,但不同化合物毒性不同。六價鉻化合物在高濃度時具有明顯的局部刺激作用和腐蝕作用,低濃度時為常見的致癌物質。在食物中大多為三價鉻,其口服毒性很低,可能是由於其吸收非常少。
鉻雖然人體需要量很少,但作用很大。它是使胰島素起作用的一種重要元素。糖尿病人存在缺鉻和缺鋅的問題,並且有併發症時患者的鉻、鋅含量均顯著低於無併發症患者。三價鉻可以改善胰島素的敏感性。
含鉻量比較高的食物有主要是一些粗糧,如我們通常食用的小麥、花生、蘑菇等等,另外胡椒、以及動物的肝臟、牛肉、雞蛋、紅糖、乳製品等都是含有鉻元素比較高的食品。多吃這些食品,就能保證人體的鉻元素的充足。當然,前提是保證流失不會過多。
近視
提起近視,許多人常將其歸咎於不良用眼,如看書距離不當,光太暗,持久用眼等。但飲食不當也是誘發青少年近視的原因之一。
美國紐約大學研究員貝蘭博士對大量青少年近視病例進行研究之後指出,體內缺乏微量元素鉻與近視的形成有一定的關係。鉻元素在人體中與球蛋白結合,為球蛋白正常代謝必需。在糖與脂肪的代謝中,鉻協助胰島素髮揮重要的生理作用。處於生長發育旺盛時期的青少年,鉻的需求比成人大。鉻主要存在於粗糧、
紅糖、蔬菜及水果等食物中,有些家長不注意食物搭配,長期給孩子吃一些精細食物,從而造成缺鉻,眼睛
晶體滲透壓的變化,使晶狀體變凸,屈光度增加,產生近視。
鉻的測定濕式消解法:準確稱取1.0~2.0g樣品,置於消解瓶中,同時做
試劑空白。如為乾燥固體樣品,可酌加適量的水,使含水約75%以上,加硝酸10~15m1,混合放置,然後徐徐加熱。待激烈反應停止並冷卻後,加硫酸5~7.5m1,再徐徐加熱。如消解過程中有大量氣泡可加
辛醇2~3滴。溶液如變為暗色時,再加2~3ml硝酸繼續加熱,至產生
三氧化硫白煙而溶液呈現淡黃色或無色時消解完成。若消解不完全可再加少量硝酸及
高氯酸1m1,加熱以加速消解,消解液冷卻後加5ml水及5m1
草酸銨溶液,加熱至生成三氧化硫白煙為止,冷後加水使成50ml作為待測溶液,同時做試劑空白。
吸取鉻
標準溶液(3.2)0,0.20,0.50,1.00,2.00,4.00,6.00,8.00ml,分別置於150ml三角瓶中,加純水至50ml。
向標準系列中加0.5ml 1+1硫酸,0.5ml 1+1磷酸及2~3滴6%高錳酸鉀溶液。如紫紅色消褪則應再加高錳酸鉀溶液。各加幾粒玻璃珠,加熱煮沸,如紫紅色消退,需補加高錳酸鉀至煮沸後仍需保持紫紅色。
冷卻後向各瓶中加1ml 20%尿素溶液(1),然後滴加2%亞硝酸鈉溶液,每加1滴需充分振搖,直到紫紅色剛褪去為止。待瓶中不冒氣泡後再將溶液轉移到50ml比色管中,用純水稀釋至刻度。
向比色管各加入2.5ml 1+7硫酸,0.5ml 1%二苯碳醯二肼,立即搖勻放置10min(2)在波長540nm下用3cm比色皿以純水作參比測定吸光度值。繪製標準曲線。
含鉻食物
鉻是維持人體生命活動的必需元素,能幫助胰島素促進葡萄糖進入細胞內的效率,是重要的血糖調節劑及促進生長發育的功能。此外,鉻是糖尿病的“剋星“,在日常生活中可以多攝取富含鉻的食物。而富含鉻的食物有哪些呢?
鉻是動物和人體必不可少的微量營養素之一。其主要作用是幫助維持身體中所允許的正常葡萄糖含量。飲食中供鉻不足與葡萄糖和類脂同化作用的改變有關。腸胃中鉻的吸收與食品中元素的化學結構有關。研究表明,飲食中攝人的無機鉻只有1%被吸收,鉻一旦被吸收,便迅速離開血液分布於各個器官中,特別是肝臟,有3價鉻存在。在所有細胞組織中鉻的濃度都隨著年齡的增加而下降。吸收的鉻主要通過腎臟排泄。人體的頭髮含鉻濃度最高,約為0.2~2.0毫克/千克。
鉻的最好來源是肉類,尤以肝臟和其他內臟,是生物有效性高的鉻的來源。啤酒酵母、未加工的穀物、麩糠、硬果類、乳酪也提供較多的鉻;軟體動物、海藻、紅糖、粗砂糖中的鉻的含量高於白糖。家禽、魚類和精製的穀類食物含有很少的鉻。長期食用精製食品和大量的精糖,可促進體內鉻的排泄增加,因此造成鉻的缺乏。
鉻的豐富來源有乾酪、蛋白類和肝。
良好來源有蘋果皮、香蕉、牛肉、啤酒、麵包、紅糖、黃油、雞、玉米粉、麵粉、土豆、植物油和全麥。
一般來源有胡蘿蔔、青豆、柑橘、菠菜和草莓。
微量來源有大部分的水果和蔬菜、牛奶及糖。
需要補充鉻的人群可以多吃點上面列舉的食物。
鉻有助於胰島素促進葡萄糖進入細胞內的效率,是血糖調節劑,可以預防糖尿病。大家在日常飲食中注意通過這些食物補充鉻元素,特別是糖尿病患者,更加應該增加鉻元素的攝入量。
富鉻酵母
富鉻酵母是在酵母培養的過程中加入無機鉻,通過酵母在生長過程中對鉻的自主吸收和轉化,降低鉻的毒性,使鉻能夠被人體更高效、更安全地吸收利用。
產品特點
鉻含量高:富鉻酵母的鉻含量為2000mg/kg以上
利用率高:通過酵母吸收轉化,人體吸收利用率遠遠高於無機鉻
毒性低:富鉻酵母的毒性大大低於三氯化鉻
套用範圍
各種食品、保健食品和藥品的原料
營養強化食品,如:乳製品、餅乾、飲料、果汁、麵粉、嬰幼兒配方食品中鉻營養素強化的原料
產品說明
【主要成分】富鉻酵母
【使用量】 視產品需要和原料鉻含量而定
【產品標準】Q/YB.J02.37-2002
【產品規格】5kg/袋;10kg/箱;20kg/ 桶
【保質期】 24月
【貯藏條件】陰涼乾燥處
感官特性,項目要求。
色澤: 黃色或淡黃色。
外觀: 細度均勻的粉末或粒度均勻的顆粒。
雜質:無外來可見雜質。
鉻元素的醫學功能
控制血糖水平
鉻對血糖代謝至關重要,它可以提高胰島素作用,使葡萄糖順利進入人體細胞進行代謝產生能量,如果你患有糖尿病或是低血糖你可以通過鉻來調節體內葡萄糖的代謝。
保護心血管
鉻在提高高密度脂蛋白(HDL,對人體有利的脂蛋白),降低膽圍醇水平方面也發揮著積極的作用,有助於預防及改善動脈硬化、預防高血壓等心血管疾病。
控制體重
鉻有助於人們減少對甜食的渴求,幫助降低體脂含量、增加瘦肌肉組織、從而有助於促進新陳代謝維持理想體重(瘦肌肉組織越多,代謝率越高),在減肥食品里很受歡迎。
危害
對人體具體危害
1、對人皮膚
皮膚直接接觸鉻化合物所造成的傷害:
鉻性皮膚潰瘍(鉻瘡)
鉻化合物並不損傷完整的皮膚,但當皮膚擦傷而接觸鉻化合物時即可發生傷害作用。鉻性皮膚潰瘍的發病率偶然性較高,主要與接觸時間長短,皮膚的過敏性及個人衛生習慣有關。鉻瘡主要發生於手、臂及足部,但只要皮膚發生破損,不管任何部位,均可發生。指甲根部是暴露處,容易積留髒物,皮膚也最易破損,因此這些部位也易形成鉻瘡。形成鉻瘡前,皮膚最初出現紅腫,具搔癢感,不作適當治療可侵入深部。潰瘍上蓋有分泌物的硬痂,四周部隆起,中央深而充滿腐肉,邊緣明顯,呈灰紅色,局部疼痛,潰瘍部呈倒錐形,潰瘍面較小,一般不超過3mm,有時也可大至12—30mm,或小至針尖般大小,若忽視治療,進一步發展可深放至骨部,劇烈疼痛,癒合甚慢。
鉻性皮炎及濕疹
接觸六價鉻也可發生鉻性皮炎及濕疹,患處皮膚搔癢並形成水泡,皮膚過敏者接觸鉻污染物數天后即可發生皮炎,鉻過敏期長達3—6月,濕疹常發生於手及前臂等暴露部份,偶爾也發生在足及踝部,甚至臉部、背部等。
2、對呼吸道
鉻性鼻炎
接觸鉻鹽常見的呼吸道職業病是鉻性鼻炎,該病早期症狀為鼻黏膜充血,腫脹、鼻腔乾燥、搔癢、出血,嗅覺減退,粘液分泌增多,常打噴嚏等,繼而發生鼻中隔潰疹,潰疹部位一般在鼻中隔軟骨前下端1.5cm處,無明顯疼痛感。鉻性鼻炎根據潰瘍及穿孔程度,可為三期:
糜爛性鼻炎,鼻中隔黏膜縻爛,呈灰白色斑點。
潰瘍性鼻炎,鼻中隔變薄,鼻黏膜呈凹性缺損,表面有濃性痂蓋,鼻中黏膜蒼白,嗅覺明顯衰退。
鼻中隔穿孔,鼻中隔軟骨可見圓形成三角形孔洞穿孔處有黃色痂,鼻黏膜萎縮,鼻腔乾燥。
3、對眼及耳
眼皮及角膜接觸鉻化合物可能引起刺激及潰瘍,症狀為眼球結膜充血、有異物感、流淚刺痛、視力減弱,嚴重時可導致角膜上皮脫落。
鉻化合物侵蝕鼓膜及外耳引起潰瘍僅偶然發生。
4、對腸胃道
誤食入六價鉻化合物可引起口腔黏膜增厚,水腫形成黃色痂皮,反胃嘔吐,有時帶血,劇烈腹痛,肝腫大,嚴重時使循環衰竭,失去知覺,甚至死亡。六價鉻化合物在吸入時是有致癌性的,會造成肺癌。
5、全身中毒
此種情況甚少,症狀是:頭痛消瘦,腸胃失調,肝功能衰竭,腎臟損傷,單接血球增多,血鈣增多及血磷增多等。
首先要明確,鉻是人體的一種必需微量元素。正常人體內只含有6-7毫克,但對人體很重要。儘管需要量很少,但缺鉻的問題仍然存在,這主要是因為人們從食物中攝取鉻,而大量的精加工食品在加工過程中喪失了大量的鉻。 鉻的主要功能是在
糖代謝中起作用。糖
利用時要消耗鉻,當糖大量利用時有可能造成鉻的不足;鉻不足時又影響糖的利用。例如,一些長期胃腸外營養的病人,由於鉻未能及時補充而使糖耐受量下降和體重喪失,補充鉻後即得到恢復。 此外,經證明鉻具有抗糖尿的作用,含鉻豐富的食物,可增強胰島素的效應,預防糖尿病的發生,缺鉻嚴重的地區糖尿病發病率高。鉻的這種功能是通過胰島素而實現的,葡萄糖負荷可造成鉻丟失,水果和蔬菜雖然也含豐富的糖,但不會引起鉻丟失,因為含的是果糖,果糖釋放的很慢,而且含有足夠的鉻能與澱粉和糖的作用拮抗。 鉻和動脈粥樣硬化關係也很密切。低鉻食物能引起動脈硬化症。在食物中加入含絡化合物可預防和控制動脈粥樣硬化的發生。冠心病患者血中鉻含量明顯低於正常人,死於冠心病的人大動脈組織內鉻含量明顯低於突發事故死亡者。 但是,過猶不及。鉻的過量攝入會造成中毒。 鉻的中毒主要是偶然吸入極限量的鉻酸或
鉻酸鹽後,引起腎臟、肝臟、神經系統和血液的廣泛病變,導致死亡。也有
鉻酸鈉經灼傷創面吸收引起中毒的事例。長期職業接觸、空氣污染或接觸鉻的灰塵,可引起皮膚過敏和潰瘍,鼻腔的炎症、壞死,甚至肺癌。經口攝入,可引起胃腸道損傷,循環障礙、腎衰竭。治療方法在於離開接觸,採用螯合劑治療,高糖攝入也使鉻排泄量增多。 鉻有2價、3價和6價三種化合物。引起中毒主要是指6價鉻而言,它具有強氧化性,易穿入生物膜而起作用;2價、3價鉻在皮膚表層即與蛋白質結合,形成穩定的配合物,不會引起生物效應。
危害途徑
侵入途徑:吸入、食入。
健康危害:三價鉻對人體幾乎不產生有害作用,未見引起
工業中毒的報導。進入人體的鉻被積存在人體組織中,代謝和被清除的速度緩慢。鉻進入血液後,主要與血漿中的球蛋白、白蛋白、r-球蛋白結合。
六價鉻還可透過
紅細胞膜,15分鐘內可以有50%的六價鉻進入細胞,進入紅細胞後與血紅蛋白結合。鉻的
代謝物主要從腎排出,少量經糞便排出。六價鉻對人主要是慢性毒害,它可以通過消化道、呼吸道、皮膚和黏膜侵入人體,在體內主要積聚在肝、腎和內分泌腺中。通過呼吸道進入的則易積存在肺部。六價鉻有強
氧化作用,所以慢性中毒往往以局部損害開始逐漸發展到不可救藥。經呼吸道侵入人體時,開始侵害上呼吸道,引起鼻炎、咽炎和喉炎、
支氣管炎。
監測方法
1、現場應急監測方法
速測管法;目視比色法;攜帶型分光光度法《突發性環境污染事故應急監測與處理處置技術》萬本太主編
攜帶型比色計(六價鉻)(義大利哈納公司產品)
2、實驗室監測方法
監測方法 來源 類別
高錳酸鉀氧化-
二苯碳醯二肼光度法 GB7466-87水質(總鉻)
火焰
原子吸收法 GB/T17137-1997 土壤(總鉻)
二苯碳醯二肼光度法
直接火焰原子吸收法 GB/T1555.5-95
硫酸亞鐵銨容量法 GB/T1555.8-95
硫酸亞鐵銨容量法
二苯碳醯二肼光度法 GB/T1555.4-95 固體廢物浸出液(六價鉻)
二苯碳醯二肼光度法 GB7467-87 水質(六價鉻)
二苯碳醯二肼比色法 CJ/T97-99 城市生活垃圾(總鉻)
二苯碳醯二肼光度法 《空氣和
廢氣監測分析方法》國家環保局編 空氣和廢氣(六價鉻)
環境標準
中國(TJ36-79) 居住區大氣中有害物質的
最高容許濃度0.0015mg/m3(一次值)(六價鉻)
0.080(表1);0.070(表2)
②最高允許排放速率(kg/h):
二級 0.009~0.19;三級 0.014~0.29(表1)
二級 0.008~0.16;三級 0.012~0.25(表2)
③無組織排放監控濃度限值:
0.070mg/m3(表2);0.080mg/m3(表1)
中國(GB5749-85) 生活飲用水水質標準 0.05mg/L(六價鉻)
中國(GB5048-92)
農田灌溉水質標準0.1mg/L(水作、旱作、蔬菜)(六價鉻)
中國(GB/T14848-93) 地下
水質量標準(mg/L)(六價鉻) Ⅰ類 Ⅱ類 Ⅲ類 Ⅳ類 Ⅴ類
0.005 0.01 0.05 0.1 >0.1
中國(GB3097-1997)
海水水質標準(mg/L) Ⅰ類 Ⅱ類 Ⅲ類 Ⅳ類
六價鉻 0.005 0.010 0.020 0.050
總鉻 0.05 0.10 0.20 0.50
中國(GHZB1-1999)
地表水環境質量標準(mg/L)(六價鉻) Ⅰ類 Ⅱ類 Ⅲ類 Ⅳ類 Ⅴ類
0.01 0.05 0.05 0.05 0.1
中國(GB15618-1995)
土壤環境質量標準(mg/kg) 一級 二級 三級
水田 90 250 ~ 350 400
旱地 90 150 ~ 250 300
中國(GB5058.3-1996) 固體廢棄物浸出毒性鑑別標準值 10mg/L(鉻);1.5(六價鉻)
中國(GB8172-87) 城鎮垃圾農用控制標準 300mg/kg
應急處理處置方法
切斷火源。戴好口罩和手套。收集回收。
國內處理含六價鉻廢水的常用方法有硫酸亞鐵-石灰法、
離子交換法、鐵氧體法等。
二、防護措施
一般不需特殊防護,但需防止煙塵危害。
三、急救措施
皮膚接觸:脫去污染的衣著,用流動清水沖洗。
眼睛接觸:立即翻開上下眼瞼,用流動清水或生理鹽水沖洗。
吸入:脫離現場至空氣新鮮處。
食入:給飲足量溫水,催吐,就醫。
滅火方法:乾粉、砂土。
超標事件
2012年4月,據調查,9家藥廠生產的13個批次藥品所用膠囊鉻超標,最高超標90倍,這13個產品被暫停銷售和使用。
鉻是一種毒性很大的重金屬,容易進入人體細胞,對肝、腎等內臟器官和DNA造成損傷,在人體內蓄積具有致癌性並可能誘發基因突變。
在調查華星、卓康兩家膠囊廠時,分別對白袋子明膠原料和藥用膠囊成品進行取樣送檢,兩廠明膠鉻含量分別是62.43mg/kg和103.64mg/kg,分別超標30多倍和50多倍;膠囊鉻含量分別為42.19mg/kg和93.34mg/kg,分別超標20多倍和40多倍。
據介紹,被曝光的這些藥品都屬於常用藥品,而非急救藥品或者是必需藥品,市面上都有替代藥品。本市各醫院將由醫生、藥師為患者開具替代藥物,零售藥店也將指定藥師負責幫助患者推薦替代藥物,並進行用藥方面的指導,患者不會因為這些產品被停售影響到治療。
市藥監局還將會在全市開展13個產品之外的膠囊藥品監督檢查,隨時發現,隨時查處。此外,北京仍會加大對外埠流入產品的監查力度,防範和杜絕使用鉻超標膠囊。
針對此情況,國家食品藥品監督管理局發出緊急通知,要求對13個藥用空心膠囊產品暫停銷售和使用。國家食品藥品監管局稱,已責成相關省食品藥品監管局對媒體報導的藥用空心膠囊鉻超標情況開展監督檢查和
產品檢驗,並派員赴現場進行督查。被叫停銷售和使用的產品,待檢驗結果明確後,合格產品將繼續銷售,不合格產品依法處理。對違反規定生產銷售使用藥用空心膠囊的企業,將嚴肅查處。
鉻的讀音
在字典上,鉻的讀音是:gè
但是在實際生活中,特別是在工廠里,一代代傳下來的是luò。造成這種現象的原因,有一種說法說是為了區別於化學元素里的
鎘(gé),而採用這種讀音。造成luo這個讀音是因為人有語感,鉻是金屬,而帶有“各”字邊旁又能聯想到金屬的字是“烙鐵”的烙,烙讀作lao、luo(文白二讀,後改成多音字),語感讓我們產生二者之間的聯想,所以人們才會偏向於luo這個發音,這也是為什麼很多相近的事物辭彙發音都比較接近的原因,這也是語言發展的客觀規律。
鉻字將來會讀作gè還是會讀作luò,是需要經過長時間的口語上的使用,由人們淘汰掉讓人覺得不方便不舒適的發音,最終約定俗成保留其中一個最適合的發音。字典也是遵循語言的這一發展規律而不停的每隔一段時間就需要進行修訂。
而現在,我們需要同時學會gè跟luò兩個發音,以便在各種場合都能準確無誤的表達和理解。
 發現者:沃克蘭
發現者:沃克蘭


 鉻
鉻 鉻
鉻 金屬鉻塊,玻封鉻展示標本
金屬鉻塊,玻封鉻展示標本
 鉻
鉻
 發現者:沃克蘭
發現者:沃克蘭


 鉻
鉻 鉻
鉻 金屬鉻塊,玻封鉻展示標本
金屬鉻塊,玻封鉻展示標本
 鉻
鉻