基本介紹
- 中文名:電子排布
- 外文名:Electronic configuration
- 別名:核外電子排布
- 學科:原子物理學
簡介,原子軌道的種類,排布的規則,電子構型對性質的影響,參見,
簡介
正如其他基本粒子,電子遵從量子物理學,而不是一般的經典物理學;電子也因此有波粒二象性。而且,根據量子物理學中的《哥本哈根詮釋》,任一特定電子的確實位置是不會知道的(軌道及軌跡放到一旁不計),直至偵測活動進行使電子被偵測到。在空間中,該測量將會檢測的電子在某一特定點的機率,和在這一點上的波函式的絕對值的平方成正比。
電子能夠由發射或吸收一個量子的能量從一個能級躍遷到另一個能級,其形式是一個光子。由於泡利不相容原理,沒有兩個以上的電子可以存在於某個原子軌道(軌道不等於電子層);因此,一個電子只可跨越到另有空缺位置的軌道。
原子軌道的種類
主條目:原子軌道
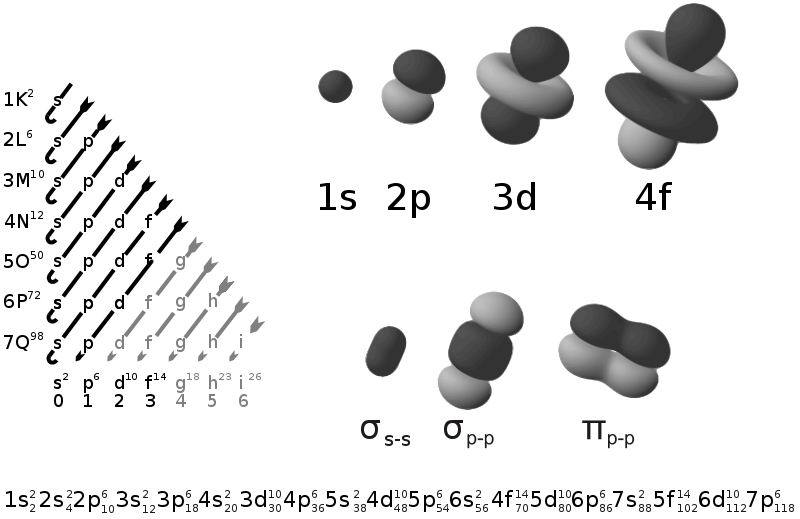
作為薛丁格方程的解,原子軌道的種類取決於主量子數(n)、角量子數(l)和磁量子數(ml)。其中,主量子數就相當於電子層,角量子數相當於亞層,而磁量子數決定了原子軌道的伸展方向。另外,每個原子軌道里都可以填充兩個電子,所以對於電子,需要再加一個自旋量子數(ms),一共四個量子數。
n可以取任意正整數。在n取一定值時,l可以取小於n的自然數,ml可以取 -l到 +l。不論什麼軌道,ms都只能取±1/2,兩個電子自旋相反。因此,s軌道(l=0)上只能填充2個電子,p軌道(l=1)上能填充6個,一個軌道填充的電子數為4l+2。
具有角量子數0、1、2、3的軌道分別叫做s軌道、p軌道、d軌道、f軌道。之後的軌道名稱,按字母順序排列,如角量子數l=4時叫g軌道。
排布的規則
電子的排布遵循以下規則:
- 構築原理:整個體系的能量越低越好。一般來說,新填入的電子都是填在能量最低的空軌道上的。
- 洪德規則:電子儘可能的占據不同軌道,自旋方向相同。
- 泡利不相容原理:在同一體系中,沒有兩個電子的四個量子數是完全相同的。
- 能級交錯:電子層數較大的某些軌道的能量反低於電子層數較小的某些軌道能量的現象。
1s | ||||
2s | 2p | |||
3s | 3p | |||
4s | 3d | 4p | ||
5s | 4d | 5p | ||
6s | 4f | 5d | 6p | |
7s | 5f | 6d | 7p | |
8s | 5g | 6f | 7d | 8p |
電子構型對性質的影響
主條目:元素周期律