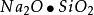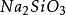基本結構
由於其結構上的特點,種類繁多(
矽酸鹽礦物的基本結構是
矽――氧四面體;在這種四面體內,矽原子占據中心,四個氧原子占據四角。這些四面體,依著四面體,依著不同的配合,形成了各類的矽酸鹽)。矽酸鹽結構眾多、種類繁多:有島狀的橄欖石、層狀的石英、環狀的蒙脫石等。它們大多數熔點高,化學性質穩定,是
矽酸鹽工業的主要原料。矽酸鹽製品和材料廣泛套用於各種工業、科學研究及日常生活中。
礦物分類
鏈狀結構
具有由一系列[ZO4]四面體以角頂相連成一維無限延伸的鏈狀矽氧骨幹的矽酸鹽礦物。鏈與鏈間由金屬陽離子(主要有Ca、Na、Fe、Mg、Al、Mn等)相連。已發現鏈的類型有20餘種,其中最主要的是輝石單鏈[Si2O6]4-和閃石雙鏈[Si4O11]6-。
在鏈狀結構矽酸鹽礦物中,由於矽氧骨幹呈一向延伸的鏈,而且平行分布,所以其晶體結構的異向性比島狀和環狀的要突出得多。礦物在形態上表現為一向伸長,經常呈柱狀、針狀以及纖維狀的外形。在物理性質上,解理平行於鏈的方向較發育,平行或近於平行鏈的方向折射率較高,垂直於鏈的方向較低,雙折射率較島狀或環狀礦物的大。化學組成中具有過渡元素的礦物的多色性和吸收性是非常明顯的,如富含鐵、鈦等元素的輝石族和閃石族礦物。
層狀結構
具有由一系列[ZO4]四面體以角頂相連成二維無限延伸的層狀矽氧骨幹的矽酸鹽礦物。矽氧骨幹中最常見的是每個四面體均以三個角頂與周圍三個四面體相連而成六角網孔狀的單層,其所有活性氧都指向同一側。它廣泛地存在於雲母、綠泥石、滑石、葉蠟石、蛇紋石和粘土礦物中,通常稱之為四面體片。四面體片通過活性氧再與其他金屬陽離子(主要是Mg2+、Fe2+、Al3+等)相結合。這些陽離子都具有八面體配位,各配位八面體均共棱相連而構成二維無限延展的八面體片。四面體片與八面體片相結合,便構成了結構單元層。
如果結構單元層只由一片四面體片與一片八面體片組成,是1∶1型結構單元層,如高嶺石、蛇紋石中的層。如是由活性氧相對的兩片四面體片夾一片八面體片構成,則為2∶1型結構單元層,如雲母、滑石、蒙脫石中的層。如果結構單元層本身的電價未達平衡,則層間可以有低價的大半徑陽離子(如K+、Na+、Ca2+等)存在,如雲母、蒙脫石等。後者的層間同時還有水分子存在。此外,八面體片中與四面體片的一個六元環範圍相匹配的是中心呈三角形分布的三個八面體。當八面體位置為二價陽離子占據時,此三個八面體中都必須有陽離子存在,才能達到電價平衡。若為三價陽離子時,則只需有兩個陽離子即可達到平衡,此時另一個八面體位置是空的。
化學性質
化學上,指由矽和
氧組成的化合物(
),有時亦包括一種或多種金屬或
氫元素。從概念上可以說矽酸鹽是矽,氧和金屬組成的化合物的總稱。它亦用以表示由
二氧化矽或
矽酸產生的鹽。能與酸反應生成矽酸固體。在普通情況下,最穩定的矽酸鹽是二氧化矽(
)--俗稱
石英,和其他物質組成的化合物。二氧化矽經常有微量的矽酸(
)處於
平衡狀態。化學家認為石英是不可
溶解的,但在長時間尺度下,它是可以流動的。此外,在鹼性條件下,會出現
。大部分矽酸鹽都是不可溶解的。
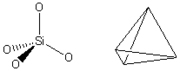 矽氧四面體
矽氧四面體矽酸鹽礦物的特徵是它們的
正四面體結構,有時這些正四面體以鏈狀、雙鏈狀、片狀、三維架狀方式連結起來。按正四面體聚合的程度,矽酸鹽再細分為:島狀矽酸鹽類、環狀矽酸鹽類等。
矽酸在水中的溶解度很低,25℃下約為0.002mol⋅L-1。在溶解度範圍內,矽酸以單矽酸形式存在。矽酸在溶液中濃度高於溶解度時發生聚合,聚合作用是矽酸的重要性質,即單矽酸聚合成低聚矽酸,再聚合成高聚矽酸。
分析方法
原理
微波是
電磁波中位於遠紅外與無線電之間的一種電磁輻射,它的頻率範圍為300MHz~3×105MHz。微波加熱與傳統的加熱方式有所不同,微波加熱屬於一種內部加熱方式,其被加熱的樣品與酸混合物通過吸收微波能產生的即時深層加熱。與此同時,微波所產生的交變磁場會促使介質分子發生極化的現象,而極性分子又可以隨著頻率高的磁場交替排列,導致了分子的高速振盪。對於這種振盪而言,又會受到分子熱運動與相鄰分子之間相互作用的阻礙與干擾,產生了類似於摩擦作用使得分子獲得高能量。因此,這種高能量可以擊碎岩石礦物之中的化學性質穩定的矽酸鹽,從而對其分子可以進行測定。
試驗部分
1 儀器與試劑
儀器:家用微波爐。
試劑:水泥熟料標樣;普通矽酸鹽水泥標樣;水泥生料標樣;TEA(三乙醇胺)(體積配合比1:2);鹽酸;KOH溶液;EDTA標樣;鈣黃綠素-甲基百里香酚藍-酚酞混合指示劑(CMP混合指示劑)。
2 實驗方法
(1)EDTA標液的標定
首先取一定體積的CaCO3溶液稀釋8倍,如在實際的實驗過程之中,吸取了10mL該溶液稀釋至80mL,然後加入適量的CMP混合指示劑,在磁力攪拌器攪拌的作用下滴加200g/L的KOH溶液之後一直到出現綠色螢光之後再滴定過量2mL左右。以EDTA標液滴定溶液滴定至綠色螢光消失且呈現紅色。
(2)樣品的消解
a.首先對水泥熟料標樣或普通矽酸鹽水泥標樣的消解:稱取0.1000g已於105~110℃烘過兩個小時的水泥熟料標樣或是普通矽酸鹽水泥標樣,放入400mL的燒杯之中,加入20~30mL的蒸餾水與3~4mL體積配合比為1:1的鹽酸溶液中對樣品進行溶解,蓋上表面皿,放入微波爐加熱消解,取出,冷卻至室溫,定容於100mL的容量瓶之中,待用。
b.水泥生料標樣的消解:稱取0.2000g已於105~110℃溫度條件下烘過兩個小時的水泥生料標樣,放於400mL的燒杯之中,加入適量的蒸餾水與HCl溶液對樣品進行溶解,蓋上表面皿,置於微波爐之中進行加熱消解。然後取出並冷卻至室溫,定容於100mL的容量瓶中,待用。
3 結果與討論
主要對水泥熟料與普通矽酸鹽水泥之中的CaO的含量進行了測定。
可以看出,在微波小火條件下,消解2min以上,氧化鈣含量已在允差範圍之內,符合測定要求。
常見分類
礦物學上,矽酸鹽礦物按其分子結構分為以下類別:
綠簾石(double tetrahedra) - 島狀矽酸鹽類
電氣石(rings of tetrahedra) - 環狀矽酸鹽類
輝石(single chain) - 鏈狀矽酸鹽類
角閃石(double chain) - 鏈狀矽酸鹽類
雲母和白土(sheet) - 層狀矽酸鹽類
天然矽酸鹽-自然界存在的各種天然矽酸鹽礦物約占地殼質量的95%。
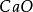
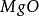
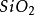
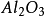
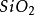

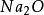


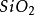
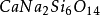
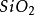
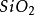
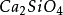

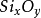
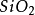


 矽氧四面體
矽氧四面體