上游原料
理化性質
三氧化硫是
非極性分子。它的氣體形式是一種嚴重的污染物,是形成酸雨的主要來源之一。
常溫下為無色透明油狀液體或固體(取決於具體晶型),標況為固體,具有強刺激性臭味。
強氧化劑,能被硫、磷、碳還原。較硫酸、
發煙硫酸的脫水作用更強。對金屬的腐蝕性比硫酸、發煙硝酸弱。
成鍵方式
SO
3中,S元素採取sp
2雜化,在豎直方向(就是沒形成雜化軌道剩下的p軌道)上的p軌道中有一對電子,在形成的雜化軌道中有一對成對電子和2個成單電子,有2個氧
原子分別與其形成σ鍵,2個氧原子豎直方向上p軌道各有1個電子,一個氧原子與
雜化軌道的
孤對電子形成配位鍵,其豎直方向上有2個電子,這樣,在4個原子的豎直方向的電子共同形成一套四中心六電子
大π鍵,這套大π鍵是離域的鍵。
分子構型
氣態的SO
3是一種具有D3h對稱的平面正三角形分子,這與價層
電子對互斥理論(VSEPR)所預測的結論是一致的。
三氧化硫中,硫元素的化合價為+6,分子為非極性分子。
SO3分子中的S已經達到+6價,所有的電子都參與成鍵,沒有孤對電子,不需要給孤對電子留出空間了,所以它是很對稱的平面正三角形。
與二氧化硫一樣都是硫的氧化物。
化學反應
SO
3是硫酸(H
2SO
4)的
酸酐。因此,可以發生以下反應:
和水化合成硫酸:SO
3(l) + H
2O(l) = H
2SO
4(aq) (
=-88 kJ/mol)
這個反應進行得非常迅速,而且是放熱反應。在大約340 ℃以上時,硫酸、三氧化硫和水才可以在
平衡濃度下共存。
三氧化硫也與二氯化硫發生反應來生產很有用的試劑——
亞硫醯氯:
SO3+ SCl2 →SOCl2 + SO2
三氧化硫還可以與鹼類發生反應,生成硫酸鹽及其它物質,如:SO3+2NaOH=Na2SO4+H2O
三氧化硫不可用濃硫酸乾燥,因為SO
3和濃硫酸會生成
焦硫酸:
H2SO4+SO3=H2S2O7
二氧化硫可轉為三氧化硫(反應條件為加熱,催化劑一般為V2O5):
固態結構
天然的SO
3固體有一種令人驚訝的、因痕量水導致結構改變的複雜結構。由於氣體的液化,極純的SO
3冷凝形成一種通常稱作γ-SO
3的三聚體。這種分子形式是一種熔點在16.8 ℃的無色固體。它形成的環狀結構被稱為[S(=O)2(μ-O)]
3。
如果SO
3在27 ℃以上冷凝,可形成熔點為16.83℃的"α-SO
3" . α-SO
3 外觀為類似石棉的纖維狀(雖然兩者相差甚遠)。在結構上來說,它是形如[S(=O)2(μ-O)]n的
聚合物。聚合物分子的每個末端都以-OH結束。β-SO
3是與α構型相類似、但
相對分子質量不同的纖維狀聚合物,其分子末端亦皆為
羥基,熔點為62.4 ℃。γ構型和β構型都是介穩的,在長時間放置後最終會轉化為穩定的α構型。這種轉化是由痕量水導致的。
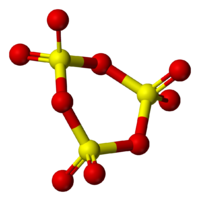 γ-SO3分子的結構模型
γ-SO3分子的結構模型在同一溫度下固體SO
3的相對蒸氣壓大小為α<β<γ,亦指明它們相對分子質量的大小。液態三氧化硫的蒸氣壓說明它是γ構型。因此加熱α-SO
3的晶體至其熔點時會導致蒸氣壓的突然升高,巨大的壓力甚至可以衝破加熱它的玻璃管。這個結果被稱為 "α爆炸"。SO
3 極易
水解。事實上,該水化熱足以使混合了SO
3的木頭或者棉花點燃。在這種情況下,SO
3使那些碳水化合物脫水。
SO3中氧硫鍵的鍵長並不相同,固態SO3主要以兩種形式存在:一種是三聚體的環狀形式,另外一種是石棉鏈狀的纖維結構兩種結構中,共享的S—O鍵長和非共享的S—O鍵長是不同的。
製備
實驗室製法
在實驗室中常用濃硫酸與五氧化二磷共熱製取三氧化硫,其中會產生磷酸。在反應中生成的三氧化硫需要用冰水混合物冷卻,尾氣用濃硫酸(85%)吸收。
工業製法
SO
3的工業製法是
接觸法。二氧化硫通常通過硫的燃燒或
黃鐵礦礦石(一種含硫鐵礦石,主要成分二
硫化亞鐵FeS
)的煅燒得到的,先通過靜電沉澱進行提純。提純後的SO
2在400至600℃的溫度下,用負載在硅藻土上的含
氧化鉀或硫酸鉀(助催化劑)的
五氧化二釩作為催化劑,將二氧化硫用氧氣氧化為三氧化硫。
鉑同樣可以充當這個反應的催化劑但是價格昂貴,比混合物更容易發生
催化劑中毒(導致失效)。以這種方式製得的三氧化硫大部分都被轉化為了硫酸,但不能用水進行吸收,否則將形成大量
酸霧,但如果採用98.3%硫酸作
吸收劑,因其液面上水、三氧化硫和硫酸的總
蒸氣壓最低,故吸收效率最高。
化學產品
品名及成分
化學品中文名稱:三氧化硫
化學品英文名稱:sulphur trioxide
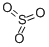 三氧化硫化學分子結構式
三氧化硫化學分子結構式英文名稱2:Sulfuric anhydride
技術說明書編碼:1236
CAS No.:7446-11-9
EINECS號:231-197-3
InChI:InChI=1/O3S/c1-4⑵3
分子式:SO3
分子結構:S原子以sp2雜化軌道成鍵,分子為平面正三角形分子。
有害物成分 三氧化硫
CAS No.7446-11-9
危險性概述
侵入途徑:
健康危害:其毒性表現與硫酸相同。對皮膚、黏膜等組織有強烈的刺激和
腐蝕作用。可引起
結膜炎、
水腫。角膜混濁,以致失明;引起呼吸道刺激症狀,重者發生呼吸困難和
肺水腫;高濃度引起喉痙攣或聲門水腫而死亡。口服後引起消化道的燒傷以至潰瘍形成。嚴重者可能有胃穿孔、腹膜炎、喉痙攣和聲門水腫、腎損害、休克等。慢性影響有牙齒
酸蝕症、慢性支氣管炎、肺氣腫和肝硬變等。
環境危害:對環境有危害,對大氣可造成污染。
燃爆危險:該品不燃,具強腐蝕性、強刺激性,可致人體灼傷。
應急處理
皮膚接觸:立即脫去污染的衣著並迅速擦淨接觸部分,之後用大量流動清水沖洗至少15分鐘。就醫。
眼睛接觸:立即提起眼瞼,用大量流動清水或生理鹽水徹底沖洗至少15分鐘。就醫。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。
食入:用水漱口,給飲牛奶或蛋清。就醫。
危險特性:與水發生爆炸性劇烈反應。與氟、
氧化鉛、次氯酸、
亞氯酸、高氯酸、磷、四氟乙烯等接觸劇烈反應。與有機材料如木、棉花或草接觸,會著火。
吸濕性極強,在空氣中產生有毒的
白霧。遇潮時對大多數金屬有強腐蝕性。
滅火方法:該品不燃。消防人員必須佩戴過濾式防毒面具(全面罩)或隔離式呼吸器、穿全身防火防毒服,在上風向滅火。儘可能將容器從火場移至空曠處。噴水保持火場容器冷卻,直至滅火結束。滅火時儘量切斷泄漏源,然後根據著火原因選擇適當滅火劑滅火。禁止用水和泡沫滅火。
泄漏應急處理:迅速撤離泄漏污染區人員至安全區,並立即隔離150m,嚴格限制出入。建議應急處理人員戴自給正壓式呼吸器,穿
防酸鹼工作服。儘可能切斷泄漏源。若是液體。小量泄漏:用砂土、蛭石或其它惰性材料吸收。大量泄漏:構築圍堤或挖坑收容。用泵轉移至槽車或專用收集器內,回收或運至廢物處理場所處置。若是固體,用潔淨的鏟子收集於乾燥、潔淨、有蓋的容器中。若大量泄漏,收集回收或運至廢物處理場所處置。
處置與儲存
操作注意事項:密閉操作,注意通風。操作儘可能機械化、自動化。操作人員必須經過專門培訓,嚴格遵守操作規程。建議操作人員佩戴防塵面具(全面罩),穿橡膠耐酸鹼服,戴橡膠耐酸鹼手套。遠離易燃、可燃物。避免與還原劑、鹼類、活性
金屬粉末接觸。尤其要注意避免與水接觸。搬運時要輕裝輕卸,防止包裝及容器損壞。配備
泄漏應急處理設備。倒空的容器可能殘留有害物。
儲存注意事項:儲存於陰涼、乾燥、通風良好的庫房。遠離火種、熱源。保持容器密封。應與易(可)燃物、
還原劑、鹼類、活性金屬粉末等分開存放,切忌混儲。儲區應備有泄漏應急處理設備和合適的收容材料。
控制及防護
中國PC-TWA(mg/m3):1
PC-STEL(mg/m3):2
TLVTN:未制定標準
TLVWN:未制定標準
工程控制:密閉操作,注意通風。儘可能機械化、自動化。提供安全淋浴和洗眼設備。
呼吸系統防護:可能接觸其粉塵時,必須佩戴防塵面具(全面罩);可能接觸其蒸氣時,應該佩戴自吸過濾式防毒面具(全面罩)。
眼睛防護:呼吸系統防護中已作防護。
身體防護:穿橡膠耐酸鹼服。
手防護:戴橡膠耐酸鹼手套。
其他防護:工作完畢,淋浴更衣。單獨存放被
毒物污染的衣服,洗後備用。保持良好的衛生習慣。
理化特性
主要成分:純品
外觀與性狀:針狀固體或液體,有刺激性氣味。
熔點(℃):16.8
沸點(℃):44.8
相對密度(水=1):1.97
相對蒸氣密度(空氣=1):2.8
臨界溫度(℃):無資料
臨界壓力(MPa):無資料
辛醇/水分配係數的對數值:無資料
引燃溫度(℃):無意義
爆炸上限%(V/V):無意義
爆炸下限%(V/V):無意義
溶解性:劇烈反應
其它理化性質:暫無
穩定性和反應活性
穩定性:暫無
禁配物:
強鹼、強還原劑、活性金屬粉末、水、易燃或可燃物。
避免接觸的條件:潮濕空氣。
聚合危害:暫無
分解產物:2SO3 = 2SO2 + O2
生態、毒理學
急性毒性:LD50:無資料
LC50:無資料
刺激性:暫無
致敏性:暫無
致突變性:暫無
致畸性:暫無
致癌性:暫無
生態毒理毒性:暫無
非生物降解性:暫無
生物富集或生物積累性:暫無
其它有害作用:該物質對環境有危害,應特別注意對大氣的污染。有造成酸雨的危害。
廢棄處置
廢棄處置方法:根據國家和地方有關法規的要求處置。或與廠商或製造商聯繫,確定處置方法。
廢棄注意事項:暫無
運輸、法規信息
UN編號:1829
包裝標誌:暫無
包裝類別:暫無
包裝方法:特製金屬容器,外用堅固木箱;耐酸壇或陶瓷瓶外普通木箱或半花格木箱;磨砂口玻璃瓶或螺紋口玻璃瓶外普通木箱。
運輸注意事項:鐵路運輸時應嚴格按照鐵道部《
危險貨物運輸規則》中的危險貨物配裝表進行配裝。起運時包裝要完整,裝載應穩妥。運輸過程中要確保容器不泄漏、不倒塌、不墜落、不損壞。嚴禁與易燃物或可燃物、還原劑、鹼類、活性金屬粉末、食用化學品等混裝混運。運輸時運輸車輛應配備泄漏應急處理設備。運輸途中應防曝曬、雨淋,防高溫。公路運輸時要按規定路線行駛,勿在居民區和人口稠密區停留。

 γ-SO3分子的結構模型
γ-SO3分子的結構模型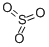 三氧化硫化學分子結構式
三氧化硫化學分子結構式
