定義
在一定溫度下難溶電解質晶體與溶解在溶液中的離子之間存在溶解和結晶的平衡,稱作多項
離子平衡,也稱為沉澱溶解平衡。
以
AgCl為例,儘管AgCl在水中溶解度很小,但並不是完全不溶解。
從固體
溶解平衡角度認識:AgCl在溶液中存在下述兩個過程:
①在水分子作用下,少量Ag+和Cl-脫離AgCl表面溶入水中;
②溶液中的Ag+和Cl-受AgCl表面
正負離子的吸引,回到AgCl表面,析出沉澱。
在一定溫度下,當沉澱溶解和沉澱生成的速率相等時,得到AgCl的
飽和溶液,即建立下列動態平衡:
AgCl(s)<=> Ag+(aq)+ Cl-(aq)
其
平衡常數Ksp稱為溶解平衡常數;它只是溫度的函式,即一定溫度下Ksp一定。
性質
中學裡介紹某溫度下100克水裡某物質溶解的最大克數叫溶解度.。習慣上把溶解度小於0.01g/100g 水的物質叫“
難溶物”。其實,從
相平衡的角度理解溶解度更確切,即在一定溫度下,固液達到平衡時的狀態。這時把
飽和溶液里的物質濃度稱為“溶解度”,常用S(mol/L)表示.
極性溶劑水分子和固體表面粒子(離子或
極性分子)相互作用,使
溶質粒子脫離固體表面成為
水合離子進入溶液的過程叫溶解。溶液中水合離子在運動中相互碰撞重新結合成晶體從而成為固體狀態並從溶液中析出的過程叫沉澱。溶解、沉澱兩個相互矛盾的過程是一對
可逆反應,存在平衡狀態,此平衡稱為沉澱溶解平衡。
在科研和生產過程中,經常要利用
沉澱反應製取
難溶化合物或抑制生成難溶化合物,以鑑定或分離某些離子。究竟如何利用沉澱反應才能使沉澱能夠生成並沉澱完全、或將沉澱溶解、轉化,這些問題要涉及到
難溶電解質的沉澱和
溶解平衡。
溶度積
嚴格地說,在水中絕對不溶的物質是不存在的。通常將溶解度小於0.01 g/100 mL水的物質稱為
難溶電解質。例如,在一定溫度下,將過量AgCl固體投入水中,Ag+和Cl-離子在水分子的作用下會不斷離開固體表面而進入溶液,形成
水合離子,這是
AgCl的溶解過程。同時,已溶解的Ag+和 Cl-離子又會因固體表面的異號電荷離子的吸引而回到固體表面,這就是AgCl的沉澱過程。當沉澱與溶解兩過程達到平衡時,此時的狀態稱為沉澱溶解平衡。
溶解
AgCl(s) ==== Ag+ + Cl-
但因c(
AgCl)為常數,a(Ag+) = c(Ag+), a(Cl-) = c(Cl-)
故上式可寫成 ∴ a(Ag+) ´ a(Cl-) = c(Ag+) ´ c(Cl-) = K Ө = Ksp Ө
AmBn(s) ==== mAn+ + nBm-
Ksp=c^m(An+)×c^n(Bm-)
上式的意義是:在一定溫度下,難溶電解質
飽和溶液中各
離子濃度冪的乘積為一常數。嚴格地說, 應該用
溶解平衡時各
離子活度冪的乘積來表示。但由於難溶電解質的溶解度很小,溶液的濃度很稀。一般計算中,可用濃度代替
活度。
Ksp的大小反映了難溶電解質
溶解能力的大小。當
化學式所表示的組成中陰、陽離子個數比相同時, Ksp數值越大的
難溶電解質在水中的溶解能力越強。
(1)Ksp的大小隻與此時溫度有關,而與難溶電解質的質量無關;
(2)表達式中的濃度是沉澱溶解達平衡時離子的濃度,此時的溶液是飽和或準
飽和溶液;
(3)由
Ksp的大小可以比較同種類型難溶電解質的溶解度的大小;不同類型的難溶電解質不能用Ksp比較溶解度的大小。
換算
根據
溶度積常數關係式,可以進行
溶度積和溶解度之間的計算。但在換算時必須注意採用
物質的量濃度(單位用mol/L)作單位。另外,由於
難溶電解質的溶解度很小,溶液很稀,難溶電解質
飽和溶液的密度可認為近似等於水的密度,即1 kg/L。
例1 已知AgCl在298 K時的溶度積為1.8×10^-10 ,求AgCl的溶解度。
解: 設AgCl的溶解度為x mol/L
∵ AgCl(s)=(可逆)= Ag+ + Cl-
Ksp(
AgCl) = c(Ag+)×c(Cl-) = x^2
∴ x = 1.34×10^-5 mol/L
∴AgCl
飽和溶液濃度為1.34×10^-5 mol/L
S=m(AgCl)=nM(AgCl)=c(AgCl)VM=1.9229×10^-3 g
例2: 298K時,Ag2CrO4 飽和溶液濃度為1.34×10^-4 mol/L,計算Ag2CrO4的
溶度積。
S=4.316×10^-2 g
c(Ag)=2×1.34×10^-4 mol ·L=2.68×10^-4 mol ·L,
c(CrO4-)=1.34×10^-4 mol ·L;
Ksp(Ag2CrO4)=c(Ag)^2·c(CrO4-)=(2.68×10^-4)^2×1.34×10^-4=9.62×10^-12。
從上述兩例的計算可以看出,
AgCl的溶度積(1.8×10^-10 )比Ag2CrO4的
溶度積(9.62×10^-12)大,AgCl的溶解度卻比Ag2CrO4 的溶解度(4.316×10^-2)小,這是由於AgCl的溶度積表達式與Ag2CrO4的溶度積表達式不同所致。因此,只有對同一類型的
難溶電解質,才能套用溶度積來直接比較其溶解度的相對大小。而對於不同類型的難溶電解質,則不能簡單地進行比較,要通過計算才能比較。
溶度積和溶解度的聯繫與差別
①與溶解度概念套用範圍不同,
Kspθ只用來表示難溶電解質的溶解度;
③用Kspθ比較難溶電解質的溶解性能只能在相同類型化合物之間進行,溶解度則比較直觀。
溶度積和Gibbs函式可用實驗測得,可用熱力學方法計算
在化學熱力學基礎一章,曾學過
平衡常數和Gibbs函式的關係式 Δ
因為溶度積也是一種平衡常數,所以上式可用來計算溶度積。
例 已知AgCl(s),Ag+和Cl-的標準Gibbs函式Δ 分別是-109.72,77.11和-131.17 kJ/mol,求298 K時AgCl的溶度積。
解: ∵ AgCl(s) === Ag+ + Cl
Δ /(kJ/mol) -109.72 77.11 -131.17
Δ = 77.11 +(-131.17)- (-109.72) = 55.66 kJ/mol
= = -9.7484 ∴ = 1.8×10-10
與其它
平衡常數如電離平衡常數一樣,也是溫度T的函式。對大多數
難溶鹽來說,溫度升高,溶解度增加,但溫度對某些鹽的影響不是很大,如NaCl。因此,在實際工作中,常用室溫時的數據。
[引出] 往NaCl溶液中滴AgNO3,是否一定生成沉澱?如何判斷能否生成沉澱?
溶度積規則---用於判斷沉澱平衡移動的方向,即van’t Hoff等溫式在沉澱溶解平衡中的套用。
根據
溶度積常數,可以判斷某一難溶電解質的
多相系統中沉澱 、溶解過程進行的方向。例如,在一定溫度下,將過量的
BaSO4固體放入水中,溶液達到飽和後,如果設法增大c(Ba2+)或c(SO42-),如加入BaCl2或Na2SO4,則平衡會發生移動,生成BaSO4沉澱
BaSO4(s) === Ba2+ + SO42- 平衡向左移動
由於沉澱的生成,系統中的c(Ba2+)或c(SO42-)會逐漸減小,當它們的乘積c(Ba2+)c(SO42-) = 時,系統達到了一個新的
平衡狀態。
如果設法降低上述平衡系統中的c(Ba2+)或c(SO42-),則平衡也會發生移動,使
BaSO4溶解
BaSO4(s) === Ba2+ + SO42- 平衡向右移動
當c(Ba2+)c(SO42-)= 時,BaSO4沉澱溶解又達到了平衡。
一定溫度下,某物質在水中的溶解度為Qc;
當Qc>
Ksp,溶液
過飽和,有沉澱析出,直到溶液到達新的平衡;
當Qc = Ksp,溶液恰好飽和,沉澱與溶解處於
平衡狀態;
當Qc<Ksp,溶液未達到飽和,無沉澱析出,若加入過量
難溶電解質,難溶電解質溶解直到溶液飽和。
溶度積規則的套用:
(1)判斷沉澱的生成和溶解
(2)控制離子濃度使反應向需要的方向移動。
在某難溶
電解質的溶液中,要使該物質的沉澱生成,根據溶度積規則,則必須達到沉澱生成的必要條件,即 Qc>
Ksp例:(1)將等體積的4 ×10-5 mol.L-1 AgNO3 和4 ×10-5 mol.L-1 K2CrO4 混合時,有無磚紅色Ag2CrO4 沉澱析出?
Q = [Ag+] [CrO42-] = 8×10^-15 < Ksp= 9 ×10^-12 。因此無Ag2CrO4 沉澱生成。
(2)改變AgNO3和K2CrO4的濃度為4.0´ 10-3mol dm-3 ,則
Q = [Ag+] [CrO42-] = 8×10^-9 > Ksp 因此有沉澱生成。
相關效應
例如,如果在
BaSO4的沉澱溶解平衡系統中加入BaCl2(或Na2SO4)就會破壞平衡,結果生成更多的BaSO4沉澱。當新的平衡建立時,BaSO4的溶解度減小。
注意:
沉澱劑的用量不是越多越好,有時過量的沉澱劑反而會使溶解度增加。
其他離子效應是指加入可以與溶液中的離子反應,生成更難溶或更難
電離或氣體的離子時,促進該難溶電解質的溶液。例如,
鹵化銀的沉澱轉化實驗。
常用方法
根據
溶度積規則,沉澱溶解的必要條件是Qc<Ksp 。只要採取一定的措施,降低
難溶電解質沉澱溶解平衡系統中有關離子的濃度,就可以使沉澱溶解。溶解方法有以下幾種:
(1) 利用酸、鹼或某些
鹽類(如
NH4+鹽)與難溶
電解質組分離子結合成
弱電解質(如弱酸,弱鹼或H2O)可以使該難溶電解質的沉澱溶解。
例如,固體ZnS可以溶於鹽酸中,其反應過程如下
ZnS(s) =(可逆)= Zn2++S2- ①
S2- + H+ =(可逆)= HS- ②
HS- + H+ =(可逆)= H2S ③
由上述反應可見,因H+與S2-結合生成
弱電解質,而使c(S2-)降低,使ZnS沉澱溶解平衡向溶解的方向移動,若加入足夠量的鹽酸,則ZnS會全部溶解。
將上式①②③相加,得到ZnS溶於HCl的溶解反應式
ZnS(s) + 2H+ === Zn2+ + H2S
例4—13 欲使0.10 mol/L ZnS或0.10 mol/L CuS溶解於1 L鹽酸中,所需鹽酸的最低濃度是多少?
解; (1) 對ZnS: 根據 ZnS(s) + 2H+ === Zn2+ + H2S
= =
式中 (H2S) = 9.1×10-8 (H2S) = 1.1×10-12 c(H2S) = 0.10 mol/L (飽和H2S溶液的濃度)
所以c(H+)=
= = 2.0 mol/L
(2)對CuS,同理c(H+) =
= = 1.3×107 mol/L
計算表明,
溶度積較大的ZnS可溶於
稀鹽酸中, 而溶度積較小的CuS則不能溶於鹽酸(市售
濃鹽酸的濃度僅為12 mol/L)中。
加入一種氧化劑或還原劑,使某一離子發生氧化還原反應而降低其濃度,從而使 < 。 如CuS、PbS、
Ag2S等都不溶於鹽酸,但能溶於
硝酸中。
3CuS(s) + 8HNO3 = 3Cu(NO3)2 + 3S↓+ 2NO↑+ 4H2O
硝酸將S2-氧化成單質硫析出,c(S2-)降低了,故 < 。
在
難溶電解質的溶液中加入一種配位劑,使難溶電解質的
組分離子形成穩定的
配離子,從而降低難溶電解質組分離子的濃度。例如,
AgCl溶於
氨水 AgCl(s) + 2NH3 === [Ag(NH3)2]+ + Cl-
由於生成了穩定的[Ag(NH3)2]+配離子,降低了c(Ag+),使 < 。所以AgCl沉澱溶解了。
以上介紹的使沉澱溶解的幾種方法,都能降低難溶電解質組分離子的濃度。
分步轉化
分步沉澱
在實際工作中,常常會遇到系統中同時含幾種離子,當加入某種
沉澱劑時,幾種離子均可能發生
沉澱反應,生成
難溶電解質。例如,向含有相同濃度的Cl-和CrO42-的溶液中,滴加AgNO3溶液,首先會生成白色的
AgCl沉澱,然後生成磚紅色的Ag2CrO4沉澱。這種先後沉澱的現象,叫
分步沉澱。對於混合溶液中幾種離子與同一種沉澱劑反應生成沉澱的先後次序,可用
溶度積規則來進行判斷。
比如,設某混合液中,c(Cl-) = c(CrO42-) = 0.010 mol/L, 逐滴加入AgNO3後,析出沉澱所需要的Ag+最低濃度是_____
AgCl: c(Ag+) = = = 1.8×10^-8 mol/L
Ag2CrO4:c(Ag+) = = 3.10×10^-5 mol/L
由於析出
AgCl沉澱所需的c(Ag+)比析出Ag2CrO4沉澱所需要的小得多,所以AgCl會先沉澱。
隨著AgCl沉澱不斷地生成,c(Cl-)會不斷減少,若要繼續生成沉澱,就必須繼續加入Ag+,當c(Ag+)增加到能使CrO42-開始析出Ag2CrO4沉澱時c(Ag+) = = 3.10×10^-5 mol/L 此時由於兩者處於同一溶液
用c(Ag+) c (Cl-) = (AgCl) = 1.8×10^-10 mol/L 可算出
c(Cl-)= 6.72×10^-7mol/L
計算表明,當Ag2CrO4開始析出沉澱,c(Cl-)<<10-5 mol/L,Cl-早已沉澱完全。因此,根據
溶度積原理,適當地控制條件就可以達到分離的目的。
對於同類型的沉澱來說,
Ksp小的先沉澱,溶度積差別越大,
後沉澱離子的濃度越小,分離效果就越好。
(1) 與 Ksp 及沉澱類型有關
沉澱類型相同,被沉澱
離子濃度相同, Ksp 小者先沉澱, Ksp 大者後沉澱;
沉澱類型不同,要通過計算確定。
(2) 與被沉澱離子濃度有關
--對於酸溶解反應來說,例如,MnS和CuS在酸中的溶解,實際上是一個包含了沉澱溶解平衡和
酸鹼平衡的
多重平衡。
例題:在0.10 mol·L-1 ZnCl2 溶液中用H2S飽和(0.10 mol·L-1)。試計算為防止ZnS沉澱所需的 c(H+)。
∵ (1) = (2) + (3) ∴ K1Ө = c2(H+) / c(Zn2+) c(H2S) = K2 ´ K3
c2(H+) /(0.1 ´0.1) = 91.3 c(H+) = Ö 91.3 ´ 0.01 = 0.96 mol·L-1
即 c(H+)大於0.96 mol·L-1 即可防止ZnS沉澱產生。
沉澱轉化
藉助於某種試劑,將一種
難溶電解質轉變為另一種難溶電解質的過程,叫做沉澱的轉化。
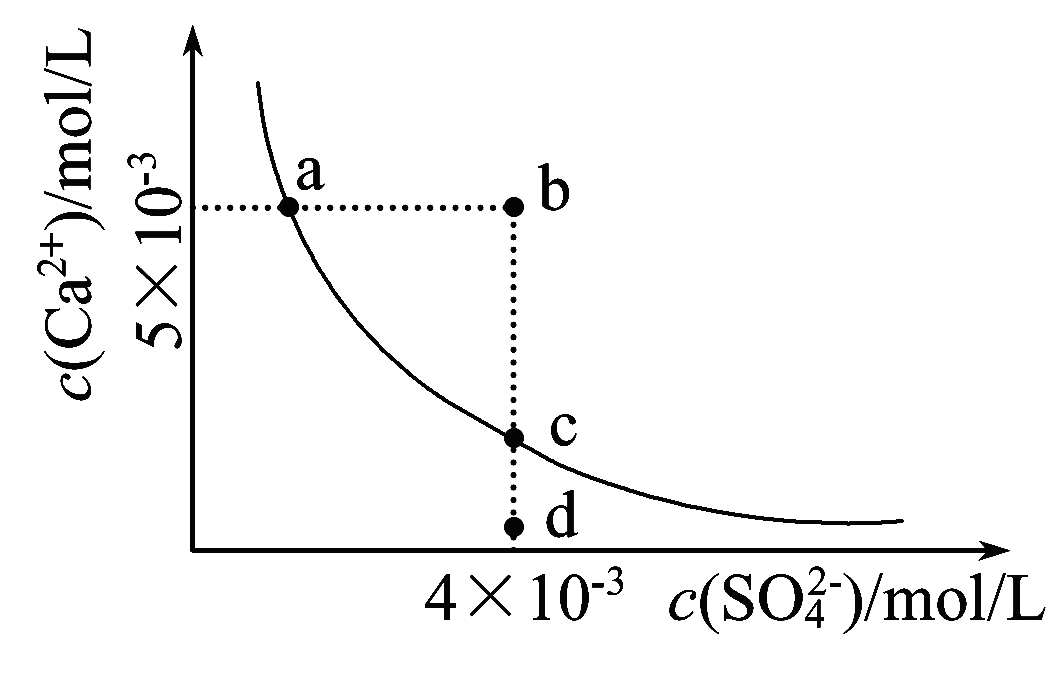
例如,CaSO4 + CO32- == CaCO3 + SO42-(計算略)
計算表明,上述沉澱轉化的
平衡常數很大。說明
硫酸鈣轉化為
碳酸鈣很容易實現。一般來講,溶解度較大的難溶電解質容易轉化為溶解度較小的難溶電解質。如果兩種難電解質的溶解度相差越大,沉澱轉化越完全。但是欲將溶解度較小的難溶電解質轉化為溶解度較大的難溶電解質就比較困難;如果溶解度相差太大,則轉化實際上不能實現。