基本介紹
- 中文名:平衡常數
- 外文名:equilibrium constant
- 影響因素:受溫度影響,與p等無關
- 描述:平衡常數越大,反應越徹底
- 用處:用以通過計算來確定生產條件
- 意義:進行得越完全,反應物轉化率越大
介紹
表示

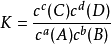
注意事項
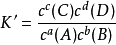
關係
標誌
書寫
 平衡常數表達式的書寫
平衡常數表達式的書寫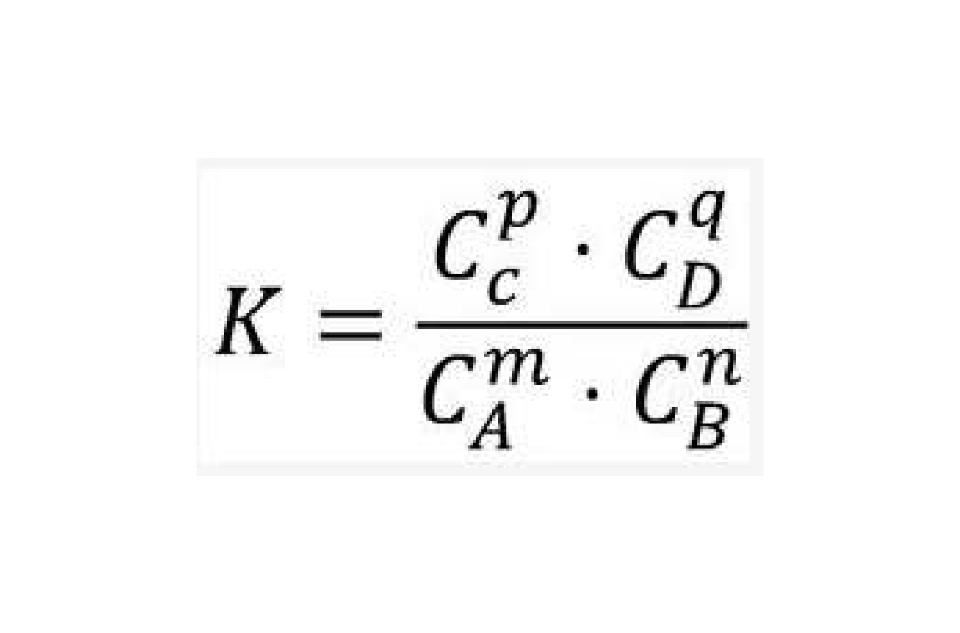

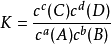
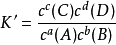
 平衡常數表達式的書寫
平衡常數表達式的書寫在特定條件下(如溫度、壓力、溶劑性質、離子強度等),可逆化學反應達到平衡狀態時生成物與反應物的濃度(方程式係數冪次方)乘積比或反應產物與反應底物的濃度(方程式...
化學平衡常數,是指在一定溫度下,可逆反應無論從正反應開始,還是從逆反應開始,也不考慮反應物起始濃度大小,最後都達到平衡,這時各生成物濃度的化學計量數次冪的乘積...
Ksp沉澱平衡常數 (solubility product constant)Ksp簡稱溶度積.難溶電解質在水中會建立一種特殊的動態平衡。難溶電解質儘管難溶,但還是有一部分陰陽離子進入溶液,...
在一定溫度下,可逆反應達到平衡時,產物濃度計量係數次方的乘積與反應物濃度計量係數次方的乘積之比為平衡常數。若在上面的平衡常數表達式中,若各物質均以各自的標準...
弱電解質在一定條件下電離達到平衡時,溶液中電離所生成的各種離子濃度以其在電離方程式中的計量數為冪的乘積,跟溶液中未電離分子的濃度以其在化學方程式中的計量數...
Ka,酸反應平衡常數。...... Ka,酸反應平衡常數。含義Ka,其中,a作為角標,是acid(酸)的縮寫。K是常數的常用寫法。詞條標籤: 科學, 學科 ...
平衡常數是氧化還原反應進行的程度。可用平衡常數的大小來衡量,氧化還原反應的平衡常數可根據能斯特方程式從有關電對的標準電極電位或條件電極電位求得。若考慮了溶液...
相平衡常數指在一定溫度和壓力下,氣液兩相達到平衡狀態時,氣相中某一組分的摩爾分數與其液相中此組分的摩爾分數的比值。表達的是互成平衡的氣-液兩相組成之間的...
穩定常數指絡合平衡的平衡常數。通常指絡合物的累積穩定常數,用K穩表示。例如:對具有相同配位體數目的同類型絡合物來說,K穩值愈大,絡合物愈穩定。配合物的穩定性...
解離常數(pKa)是水溶液中具有一定解離度的溶質的極性參數。解離常數給予分子的酸性或鹼性以定量的量度,Ka增大,對於質子給予體來說,其酸性增加;Ka減小,對於質子接受...
化學平衡是指在巨觀條件一定的可逆反應中,化學反應正逆反應速率相等,反應物和生成物各組分濃度不再改變的狀態。可用ΔrGm=ΣνΑμΑ=0判斷,μA是反應中A物質...
沉澱在溶液中達到沉澱溶解平衡狀態時,各離子濃度保持不變( 或一定) ,其離子濃度冪的乘積為一個常數,這個常數稱之為溶度積常數,簡稱溶度積。溶度積與溶解度都...
鹽類在溶液中,與水作用而改變溶液的酸鹼性的反應叫作鹽類的水解。水解常數的大小表示鹽的水解達到平衡時,水解程度的大小,水解常數的大小取決於鹽中弱酸或弱鹼的解離...
的乘積的比值,即溶液中的電離出來的各離子濃度乘積(c(A+)*c(B+))與溶液中未電離的電解質分子濃度(c(AB))的比值是一個常數,叫做該弱電解質的電離平衡常數...
分配平衡常數partition equil}i}tium con,tant;parritiun。。- elficiFnt;'Vernsr partition tonxtant指同一分子在兩相間的 Vernst分配平衡常數,符號以n表不。...
同位素交換反應平衡常數er}uili6riurn constant for iso-tope exchange reactior:表示同位索交換反應中各同位索分子間平衡濃度的關係。平衡常數用來定量地描述同位素...
萃取平衡常數extra}iin} equilibrium constant又稱萃取常數,它是萃取過程化學反應的平衡常數。...
絡合物的累積穩定常數是指絡合平衡中的一種穩定常數,用β表示。例如:對具有相同配位體數目的同類型絡合物來說,穩定常數值愈大,表示形成配離子的傾向越大,此配合...
對於氣相化學反應 mA+nB(可逆號)xC+yD 在一定溫度下達到化學平衡時,其平衡常數表達式為: k(p)=[p(C)^x*p(D)^y]/[p(A)^m*p(B)^n], K(p)=K(c...
水的離子積常數,簡稱水的離子積,是表示溶液中氫氧離子和H2O的比例關係的常數。c(H+)·c(OH-)=K(W),其中K(W)稱作水的離子積常數,c(H+)和c(OH-)是...
離子積常數是化學平衡常數的一種形式,多用於純液體和難溶電解質的電離。...... 這就限制了離子積常數隻適用於反應物是純液體或純固體的反應,因為在計算平衡常數時...
反應速率方程 r=k【A】^a【B】^b,此比例係數k,是一個與濃度無關的量,稱為速率常數(rate constant),也稱為速率係數。...
反應進行的方向和方式可以由ΔG進行判斷: 點擊載入更多詞條目錄 百科名片 簡介 提出 定義 特點 等溫公式 物理意義 自由能 平衡常數 原理...
