基本介紹
- 中文名:溶度積
- 外文名:solubility product
- 拼音:róng dù jī
- 字母表示:Ksp
- 含義:溶解物質濃度的冪次方乘積
- 平衡狀態:動態平衡
定義

詳細解釋



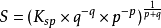
溶度積規則
例題講解
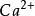





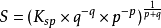
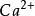

溶度積是指難溶電解質儘管難溶,但還是有一部分陰陽離子進入溶液,同時進入溶液的陰陽離子又會在固體表面沉積下來,當這兩個過程的速率相等時,難溶電解質的溶解就...
沉澱在溶液中達到沉澱溶解平衡狀態時,各離子濃度保持不變( 或一定) ,其離子濃度冪的乘積為一個常數,這個常數稱之為溶度積常數,簡稱溶度積。溶度積與溶解度都...
化合物的溶度積常數表,是一張各常見化合物的溶度積常數的數據表格。從中可快速查找到常見化合物的溶度積常數。化合物的溶度積常數表 [1] ...
Ksp沉澱平衡常數 (solubility product constant)Ksp簡稱溶度積.難溶電解質在水中會建立一種特殊的動態平衡。難溶電解質儘管難溶,但還是有一部分陰陽離子進入溶液,...
難溶電解質的離子積常數能很好地反映電解質的溶解程度,因此這一種常數又叫做溶度積常數,符號為Ksp。如氯化銀的微弱電離:即在25℃的AgCl的飽和溶液中,銀離子濃度...
溶解性表是表示物質溶解度的數據表格。其中“溶”表示那種物質可溶於水,“難”表示難溶於水,“微”表示微溶於水,“揮”表示那種物質具有揮發性。...
溶度積:(通常以Ksp表示) 難溶電解質在水中會建立一種特殊的動態平衡。 儘管難溶電解質無法溶解,但仍有一部分陰陽離子進入溶液,同時進入溶液的陰陽離子又會在固體...
然後將純的碳酸鉛溶於其中(使鹽酸過量),將溶液冷卻至0-15℃結晶,吸濾出二...9、複雜度:2.810、同位素原子數量:011、確定原子立構中心數量:0...
溶解度(水):0.013 g/100g水CAS 號:12054-48-7PubChem CID:25500為淺綠色結晶粉末,溶於酸類,不溶於水、鹼,溶於氨及銨鹽的水溶液生成絡合物,加熱則分解。...
水的離子積常數,簡稱水的離子積,是表示溶液中氫氧離子和H2O的比例關係的常數。c(H+)·c(OH-)=K(W),其中K(W)稱作水的離子積常數,c(H+)和c(OH-)是...
當溶液的濃度極低,即離子的活度可以看做1時,這個表達式可以改寫為以下的“溶度積”表達式:這個表達式說明了硫酸鈣的水溶液達平衡時,由硫酸鈣電離出的兩種離子濃度...
溶度積規則---用於判斷沉澱平衡移動的方向,即van’t Hoff等溫式在沉澱溶解平衡中的套用。根據溶度積常數,可以判斷某一難溶電解質的多相系統中沉澱 、溶解過程...
根據分步沉澱的原理,溶度積(Ksp)小的先沉澱,溶度積大的後沉澱。由於AgCl的溶解度小於Ag2CrO4的溶解度,當Ag+進入濃度較大的Cl-溶液中時,AgCl將首先生成沉澱,...
(1)溶度積Ksp的大小和平衡常數一樣,它與難溶電解質的性質和溫度有關,與濃度無關,離子濃度的改變可使溶解平衡發生移動,而不能改變溶度積Ksp的大小。...
P點稱為臨界混溶點。將代表各平衡液相組成的點連線起來,便得到實驗溫度下該三元物系的溶解度曲線。溶解度曲線將三元系分為兩個區域:由溶解度曲線與底邊所圍成的...
