基本介紹
- 中文名:多相離子平衡
- 外文名:heterogeneous equilibrium of ions
- 實質:水溶液平衡的一種
- 別稱:沉澱溶解平衡
- 套用:進行沉澱與溶解轉化、分離離子等
- 平衡性質:動態平衡
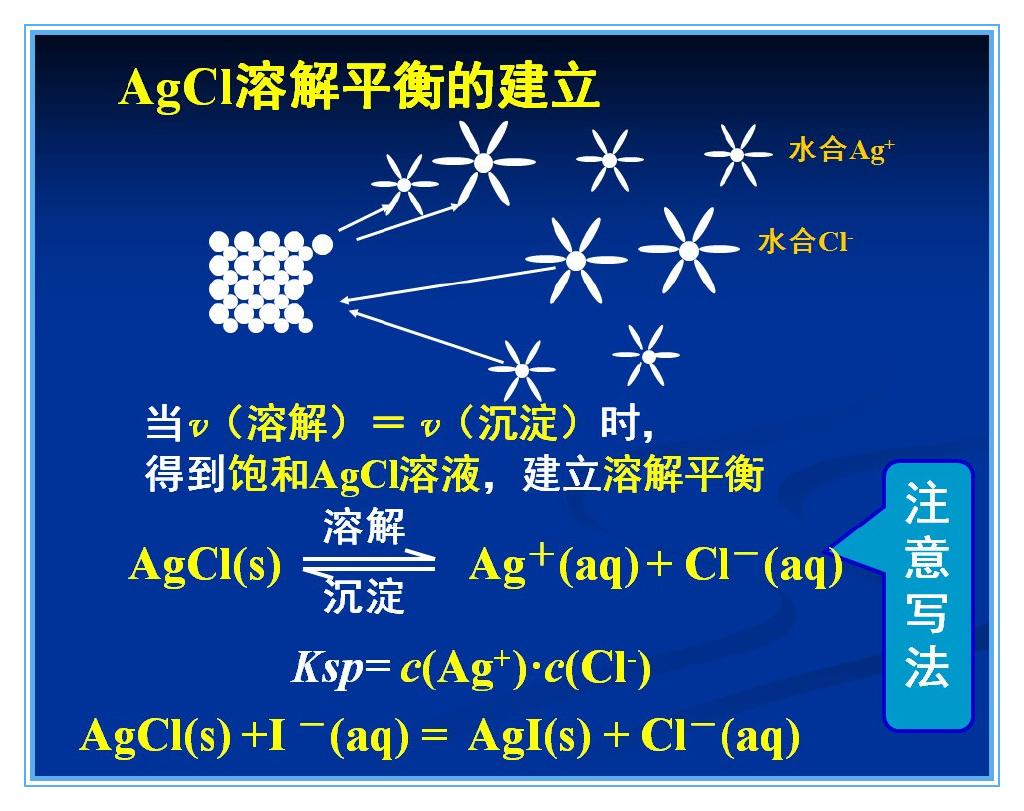
在一定溫度下難溶電解質晶體與其溶解在溶液中的離子之間存在溶解和結晶平衡。在飽和溶液中,電解質固體的溶解速度與離子結晶形成該固體的沉澱速度相等,達到該固體物質...
在多相離子平衡中的套用 目錄 1 基本定義 2 基本舉例 溶度積規則基本定義 編輯 當溶液中的離子濃度([Am+]m)的乘積等於溶度積(L)時,則溶液是飽和的;若小於...
3.3 難溶電解質的多相離子平衡 3.3.1 多相離子平衡和溶度積 3.3.2 溶度積規則及其套用 3.4 膠體與界面化學 3.4.1 膠體的結構與穩定性 3.4.2 膠體...
全書分5篇15章,溶液篇——依數性、電解質溶液、緩衝溶液、多相離子平衡、膠體和乳狀液,基本原理篇——化學熱力學基礎、化學反應速率、電極電位,物質結構篇——...
課題4.2 難溶電解質的多相離子平衡 課題4.3 原電池 課題4.4 電極電勢 課題4.5 電動勢與電極電勢在化學上的套用...
3.3.1多相離子平衡和溶度積3.3.2溶度積規則及其套用3.4水的淨化與廢水處理選讀材料水污染及其危害本章小結學生課外進修讀物複習思考題...
非電解質稀溶液通性及計算 滲透壓概念電解質溶液的電離平衡 電離常數及計算同離子效應和緩衝溶液 水的離子積及PH值 鹽類水解平衡及溶液的酸鹼性 多相離子平衡 溶...
▪ 對映體 ▪ 多電子原子 ▪ 多相離子平衡 ▪ 多原子分子 ▪ 二氧化碳 ▪ 反應的活化能 ▪ 反應方向 ▪ 反應機理 ▪ 反應級數 ▪ 反應歷...
5.2 均相離子平衡 5.2.1 酸鹼質子理論 5.2.2 弱電解質的解離平衡 5.2.3 同離子效應和緩衝溶液 5.3 多相離子平衡 5.3.1 溶度積和溶解度 5.3.2 ...
4 3 1多相離子平衡104 [1] 4 3 2溶度積規則及套用1064 4配位平衡1104 4 1配離子的穩定性1104 4 2配離子平衡濃度的計算1114 4 3含有配離子平衡的多...
第五章難溶強電解質的多相離子平衡(31)小結(31)自測題(32)自測題參考答案(33)習題參考答案(34)第六章原子結構和共價鍵(36)小結(36)...
3.2.3配位平衡 / 114 3.3酸鹼理論 / 119 3.3.1酸鹼質子理論 / 119 3.3.2酸鹼反應 / 121 3.4溶液中多相離子平衡 / 122 3.4.1難溶電解質的溶度...
5 4酸鹼平衡1305 4 1酸鹼理論簡介1305 4 2水溶液中的單相離子平衡1315 4 3緩衝溶液1335 5難溶電解質的多相離子平衡1365 5 1溶度積常數和溶解度136...
第六節 水溶液中的多相離子平衡第七節 配位化合物及其解離平衡第八節 膠體化學基礎第九節 離子交換樹脂習題第三章 火力發電廠水處理...
第四節 多相離子平衡習題第五章 氧化還原與電化學反應第一節 氧化還原反應第二節 原電池第三節 電解與金屬腐蝕習題第六章 有機化學...
全書共分十章,內容包括:化學熱力學基礎、化學動力學初步、化學平衡、溶液與水溶液中的離子平衡、電化學原理及其套用、原子結構與周期系、化學鍵與分子結構、晶體結構...
3.2.3 多相離子平衡3.3 氧化還原與電化學3.3.1 氧化還原反應的基本概念3.3.2 氧化還原反應方程式的書寫與配平3.3.3 原電池...
實驗9單、多相離子平衡69實驗10氧化還原反應73實驗11醋酸電離常數的測定77實驗12I-3I2+I-體系平衡常數的測定80實驗13電導法測定硫酸鋇的溶度積常數81...
實驗一 玻璃工操作實驗二 單、多相離子平衡實驗三 氧化還原反應實驗四 物質結構和性質的關係實驗五 平衡原理綜合實驗第8章 重要元素及化合物性質實驗...
第二節 化學平衡第三節 焓、熵和自由能習題與思考題第五章 電解質溶液第一節 電解質及其電離第二節 同離子效應與鹽效應第三節 多相離子平衡與溶度積原理...
實驗三十三 離子平衡乙酸電離常數的測定實驗三十四 多相離子平衡實驗三十五 氧化還原反應和電化學實驗三十六 B?Z振盪反應實驗三十七 鐵、鈷、鎳...
3.2.3 多相離子平衡3.3 氧化還原與電化學3.3.1 氧化還原反應的基本概念3.3.2 氧化還原反應方程式的書寫與配平3.3.3 原電池...
3.2.3 多相離子平衡3.3 氧化還原與電化學3.3.1 氧化還原反應的基本概念3.3.2 氧化還原反應方程式的書寫與配平3.3.3 原電池...
6.3多相離子平衡94 6.3.1溶解度和溶度積95 6.3.2溶度積規則及其套用96 本章內容小結98 習題100 第7章配位化合物及配位平衡103 7.1配位化合物103...
《全國高等學校醫學規劃教材?基礎化學》分五篇十五章:溶液篇——稀溶液的依數性、電解質溶液、緩衝溶液、難溶強電解質的多相離子平衡、膠體和乳狀液;基本原理篇...
本教材共分十一章,主要內容包括:化學熱力學、化學平衡和化學反應速率、溶液與離子平衡、表面現象與膠體化學、原子結構和元素周期系等。...
3.3 難溶電解質的多相離子平衡3.4 膠體與界面化學3.5 水污染及其危害本章小結與學習體會第4章 電化學與金屬腐蝕4.1 原電池4.2 電極電勢...
