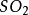組成成分
超分子:NH
3·xH
2O(NH
3 分子周圍
飽和蒸氣壓直接以
氫鍵締合的水分子有4個,則 x = 4 )。這4個氫鍵中,
氨分子作為“質子受體”並導致部分質子轉移而表現出
弱鹼性的那個氫鍵 N···H-O 較強些,其餘3個都是氨分子作為“質子給體”卻難發生質子轉移的氫鍵 O···H-N 則稍弱些。為突出這一導致部分質子轉移而表現出弱鹼性的氫鍵 N···H-O ,總把氨的水合物(主要是NH
3·4H
2O )簡作NH
3·H
2O 。

分子:NH3、H2O、NH3·H2O
離子:NH4+,OH-和H+
其中 H2O(多)NH3(較少)NH4+(少) OH- (少) H+ (很少) NH3·H2O(較多)
物化性質
揮發性
氨水易揮發出氨氣,隨溫度升高和放置時間延長而揮發率增加,且隨濃度的增大揮發量增加。
腐蝕性
氨水有一定的腐蝕作用,
碳化氨水的腐蝕性更加嚴重。對銅的腐蝕比較強,鋼鐵比較差,對
水泥腐蝕不大。對木材也有一定腐蝕作用。屬於
危險化學品,
危規號82503。
弱鹼性
NH3+H2O⇌NH3·H2O
NH
3·H
2O⇌NH
4+ +OHˉ(可逆反應)
電離常數:K=1.8×10
-5(25℃)
因此僅有一小部分氨分子與水反應而成銨離子NH
4+和
氫氧根離子OH
-,故呈
弱鹼性。
NH3+HCl=NH4Cl(白煙)
NH3+HNO3=NH4NO3(白煙)
而遇不揮發性酸(如硫酸、磷酸)無此現象。因此實驗室中可用此法檢驗水中氨分子的存在。
工業上,利用氨水的弱鹼性來吸收硫酸工業尾氣,防止污染環境。
SO
2+2NH
3·H2O=(NH
4)
2SO
3+H
2O(NH
4)
2SO
3+SO
2+H
2O=2NH
4HSO
3不穩定性
NH3·H2O=△=NH3↑+H2O
實驗室中,可用加熱
濃氨水制氨或常溫下用濃氨水與固體
燒鹼混合的方法制氨氣,其裝置與操作簡便,且所得到的氨氣濃度較大,做“噴泉”實驗效果更佳。
由於氨水具有揮發性和不穩定性,故氨水應密封保存在棕色或深色試劑瓶中,放在冷暗處。
可燃性
可以和氧氣反應生成水和氮氣,故有前景做無害燃料。但是缺點是必須在純氧氣中燃燒。(燃燒現象:氨氣在純氧中燃燒,放出紅光,發熱,生成無色氣體和無色液滴)
沉澱性
氨水是很好的沉澱劑,它能與多種金屬離子反應,生成難溶性弱鹼或兩性
氫氧化物。例如:
Al
3+ +3NH
3·H
2O
Al(OH)
3↓+3NH
4+生成的Al(OH)3沉澱難溶於過量氨水。
Fe2﹢2NH3·H2O=Fe(OH)2↓+2NH4+
生成的白色沉澱易被氧化生成紅褐色沉澱
4Fe(OH)2+O2+2H2O=4Fe(OH)3
利用此性質,實驗中可製取Al(OH)3、Fe(OH)3 、Fe(OH)2(苯層覆蓋)等。
絡合性
氨水與Ag
+、Cu
2+、Cr
3+、Zn
2+等離子能發生
絡合反應,當氨水少量時,產生不溶性弱鹼,當氨水過量時,不溶性物質又轉化成絡離子而溶解。
Ag2O+4NH
3·H
2O
2[Ag(NH3)2]﹢ +2OHˉ+3H
2O 實驗室中用此反應配製銀氨溶液。
Zn(OH)2+4NH
3·H
2O
[Zn(NH3)4]2﹢+2OHˉ+4H
2O
Cu(OH)2+4NH
3·H
2O
[Cu(NH3)4]2+(深藍色) +2OHˉ+4H
2O
還原性
氨水錶現出弱的還原性,可被強氧化劑氧化。如氨水可與氯水發生反應:
3Cl
2+8NH
3·H
2O
=6NH
4Cl+N
2+8H
2O
也可與KMnO4反應。
氧化性
氨分子中+1氧化態的氫則表現出弱氧化性,可將強還原劑氧化。如液氨把鹼金屬氧化:
2NH
3+ 2Na = 2NaNH
2 + H
2↑
主要用途
實驗室用途
氨水是實驗室重要的試劑,主要用作分析試劑,
中和劑,生物鹼浸出劑,鋁鹽合成和弱鹼性溶劑。用於鋁鹽合成和某些元素(如銅、鎳)的檢定和測定,用以沉澱出各種元素的氫氧化物。
軍事用途
作為一種鹼性消毒劑,用於消毒
沙林類
毒劑。常用的是10%濃度的
稀氨水(密度0.960),冬季使用濃度則為20%。
工業用途
毛紡、絲綢、印染等工業用於洗滌羊毛、呢絨、坯布,溶解和調整酸鹼度,並作為助染劑等。 有機工業用作胺化劑,生產熱固性酚醛樹脂的催化劑,無機工業用於制選各種
鐵鹽。
工業上用於大規模積體電路減壓或電漿CVD,以生長二氧化矽膜鍋爐給水pH值調節劑,氨用來中和給水中的碳酸,提高pH值,減緩給水中二氧化碳的腐蝕。也是鍋爐停爐保護劑,對鍋爐內有少量存水不能放出的鍋爐也有較好的保護效果。
5.醫藥上用稀氨水對呼吸和循環起反射性刺激,醫治暈倒和昏厥,並作皮膚刺激藥和消毒藥。
農業用途
農業上經稀釋後可做化肥
農用氨水的氨濃度一般控制在含氮量15%~18%的範圍內,碳化度最好大於100%。施肥簡便,方法也較多,如
溝施、面施、隨著灌溉水施或噴灑施用。使用時須先用水稀釋至千分之一以下,切忌同莖葉接觸以免灼傷。
氨水的施用原則是“一不離土,二不離水”。不離土就是要深施覆土;不離水就是加水稀釋以降低濃度、減少揮發,或結合灌溉施用。由於氨水比水密度小,灌溉時要注意避免局部地區積累過多而灼傷植株。氨水可作基肥也可作追肥。
我國常用的農用氨水濃度為含氨15%、17%和20%三種,國外農用氨水的濃度稍高,一般為含氨25%(含氮20%)的產品。我國2008年氨水的產量不到氮肥總產量的0.2%。
注意事項
危險性概述
侵入途徑:吸入、食入
健康危害:吸入後對鼻、喉和肺有刺激性,引起咳嗽、氣短和哮喘等;可因喉頭水腫而窒息死亡;可發生肺水腫,引起死亡。氨水濺入眼內,可造成嚴重損害,甚至導致失明,皮膚接觸可致灼傷。慢性影響:反覆低濃度接觸,可引起支氣管炎。皮膚反覆接觸,可致皮炎,表現為皮膚乾燥、癢、發紅。如果身體皮膚有傷口一定要避免接觸傷口以防感染。
急救措施
皮膚接觸:立即用水沖洗至少15分鐘。若有灼傷,就醫治療。對少量皮膚接觸,避免將物質播散面積擴大。注意患者保暖並且保持安靜。
眼睛接觸:立即提起眼瞼,用流動清水或生理鹽水沖洗至少15分鐘。或用3%
硼酸溶液沖洗。立即就醫。
吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。呼吸困難時給輸氧。呼吸停止時,立即進行人工呼吸。就醫。如果患者食入或吸入該物質不要用口對口進行人工呼吸,可用
單向閥小型呼吸器或其他適當的醫療呼吸器。脫去並隔離被污染的衣服和鞋。
食入:誤服者立即漱口,口服稀釋的醋或檸檬汁,就醫。吸入、食入或皮膚接觸該物質可引起遲發反應。確保醫務人員了解該物質相關的個體防護知識,注意自身防護。
消防措施
滅火方法:霧狀水、二氧化碳、砂土。
泄漏應急處理
應急處理:疏散泄漏污染區人員至安全區,禁止無關人員進入污染區,建議應急處理人員戴自給式呼吸器,穿化學防護服。不要直接接觸泄漏物,在確保全全情況下堵漏。用大量水沖洗,經稀釋的洗水放入廢水系統。也可以用沙土、
蛭石或其它惰性材料吸收,然後以少量加入大量水中,調節至中性,再放入廢水系統。如大量泄漏,利用圍堤收容,然後收集、轉移、回收或無害處理後廢棄。
操作處置
儲存注意事項:儲存於陰涼、乾燥、通風處。遠離火種、熱源。防止陽光直射。保持容器密封。應與酸類、金屬粉末等分開存放。露天貯罐夏季要有降溫措施。分裝和搬運作業要注意個人防護。搬運時要輕裝輕卸,防止包裝及容器損壞。運輸按規定路線行駛,勿在居民區和人口稠密區停留。
製備方法
先製備氨氣,氨氣的製備可以用
氯化銨和氫氧化鈉製取,要加熱,或是銨鹽和鹼混和製備加熱。收集用
向下排空氣法,將氣體通入水中,形成氨水。再將製備好的氨水用棕色瓶裝瓶即可。
毒理學數據
1、急性毒性:
人體口經LDLo:43mg/kg;人體吸入LCLo:5000ppm;人體吸入TCLo:408ppm;小鼠口經LD50:350mg/kg;小鼠皮下LDLo:160mg/kg;小鼠靜脈LD50:91mg/kg;小貓口經LDLo:750mg/kg;小兔皮下LDLo:200mg/kg;大鼠經口LD50:350mg/kg。
2.急性毒性 LD50:350mg/kg(大鼠經口)
3.刺激性
家兔經皮:250μg,重度刺激。
家兔經眼:44μg,重度刺激。
現狀發展
1,氨水行業生命周期。通過對氨水行業的市場增長率、需求增長率、產品品種、競爭者數量、進入壁壘及退出壁壘、技術變革、用戶購買行為等研判行業所處的發展階段;
2,氨水行業市場供需平衡。通過對氨水行業的供給狀況、需求狀況以及進出口狀況研判行業的供需平衡狀況,以期掌握行業市場飽和程度;
3,氨水行業競爭格局。通過對氨水行業的供應商的討價還價能力、購買者的討價還價能力、潛在競爭者進入的能力、替代品的替代能力、行業內競爭者的競爭能力的分析,掌握決定行業利潤水平的五種力量;
4,氨水行業經濟運行。主要為數據分析,包括氨水行業的競爭企業個數、從業人數、工業總產值、銷售產值、出口值、產成品、銷售收入、利潤總額、資產、負債、行業成長能力、盈利能力、償債能力、運營能力。
5,氨水行業市場競爭主體企業。包括企業的產品、業務狀況(BCG)、財務狀況、競爭策略、市場份額、競爭力(SWOT分析)分析等。
6,投融資及併購分析。包括投融資項目分析、併購分析、投資區域、投資回報、投資結構等。
7,氨水行業市場行銷。包括行銷理念、行銷模式、行銷策略、渠道結構、產品策略等。
常見謠言
謠言:2NH3+3H2O2=N2+6H2O
駁斥:這是以偏概全,事實上過氧化氫與氨水的反應比較複雜,除了形成氮氣的反應外還可以得到肼或者羥胺。
生成肼的反應:
實驗結果表明,在微波作用下,以磷酸二氫銨或磷酸二氫鉀為催化劑、乙腈為助催化劑,用低濃度過氧化氫氧化氨可以得到濃度為5.1%的水合肼。
生成羥胺的反應:
(丁酮氨氧化)肟化反應機理為羥胺路線,即先由H2O2和NH3在TS-1催化作用下生成羥胺,生成的羥胺與丁酮進行肟化反應生成丁酮肟。