基本介紹
- 中文名:水合離子
- 外文名:hydrated ion
- 形成:離子跟水分子結合生成的帶電微粒
- 舉例:[Na(H2O)m]+和[Cl(H2O)n]-
- 形成:水合物
- 分類:水合陽離子,水合陰離子等
定義
形成過程
結構組成
單核水合離子
- 水合質子
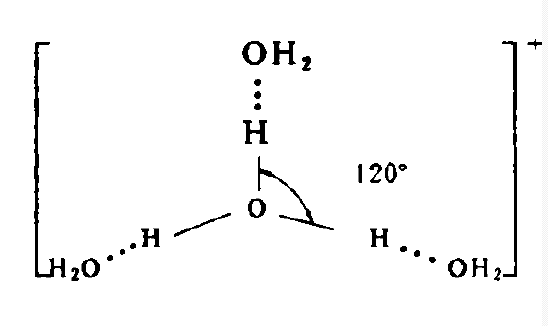 水合質子
水合質子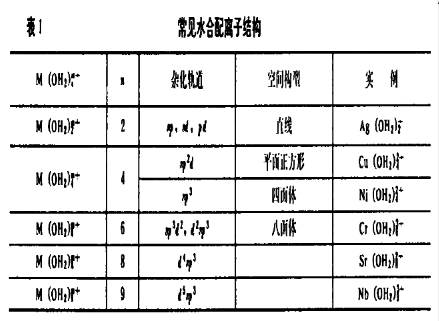 常見水合配離子結構
常見水合配離子結構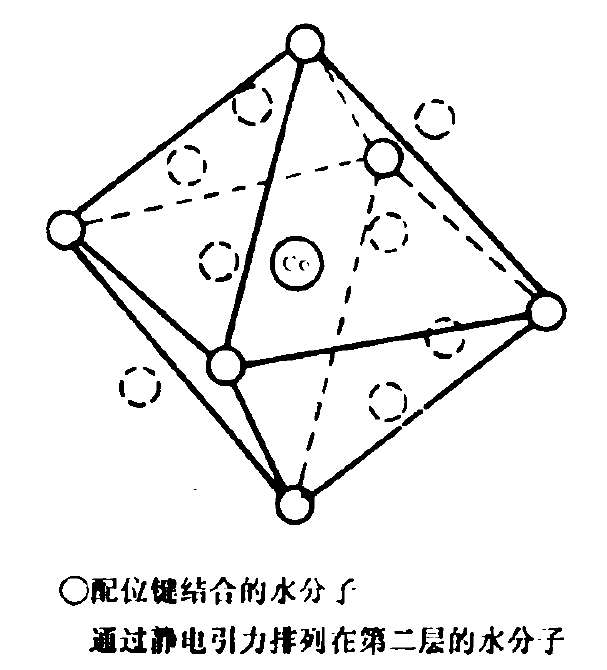 Co2+的水合
Co2+的水合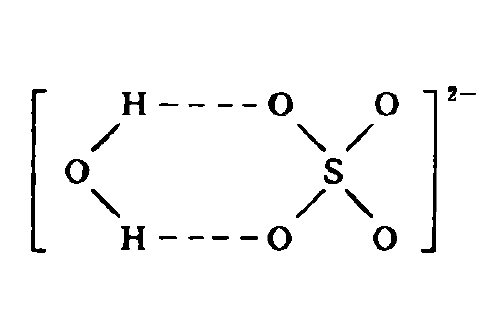 膽礬結構
膽礬結構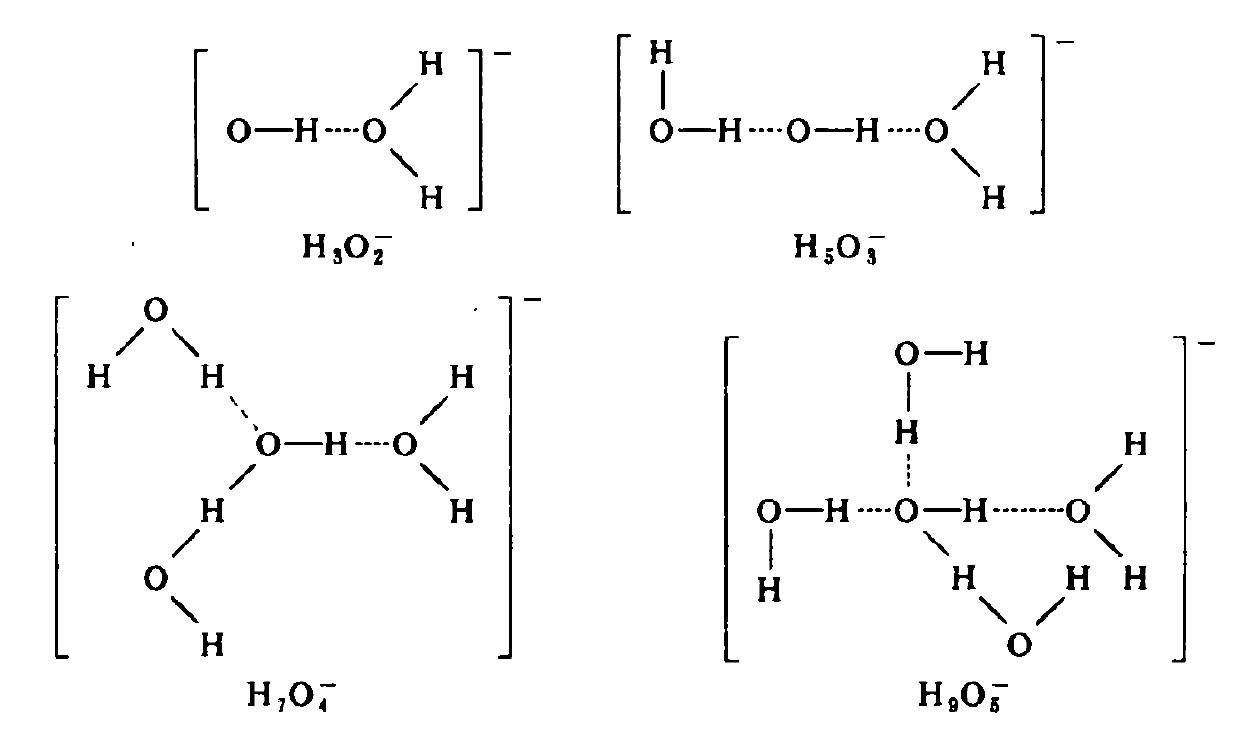 水合氮氧根離子的幾種可能結構
水合氮氧根離子的幾種可能結構多核水合離子
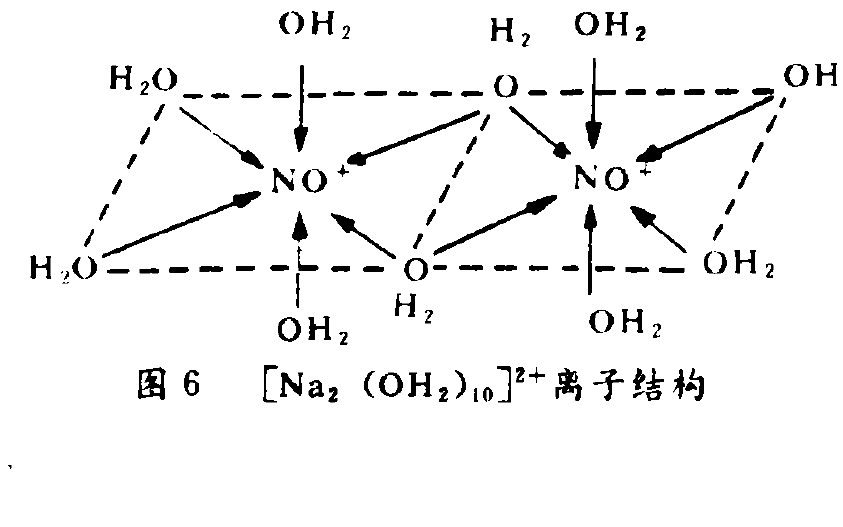 離子結構
離子結構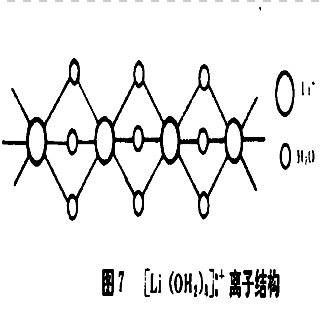 離子結構
離子結構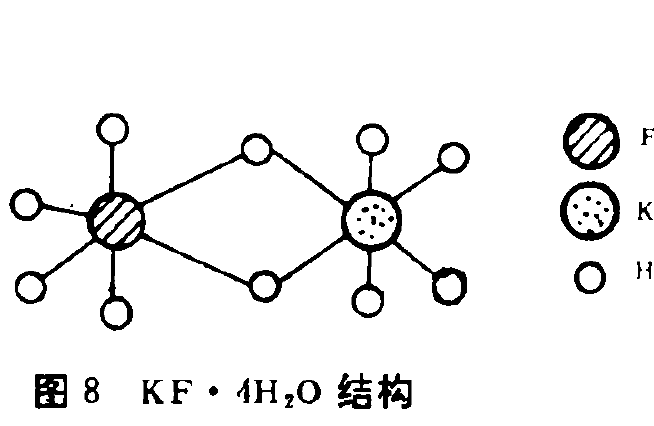 離子結構
離子結構結論
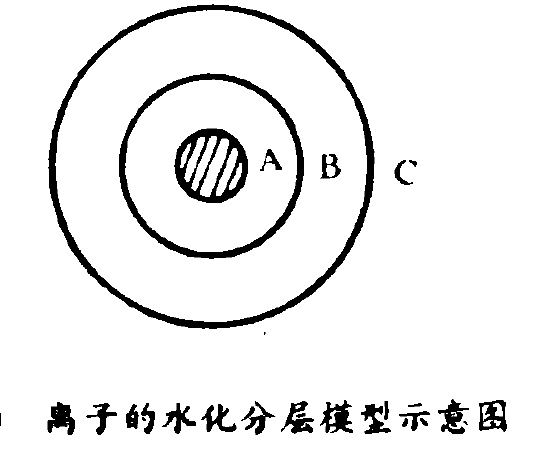 離於的水化分層模型示意圖
離於的水化分層模型示意圖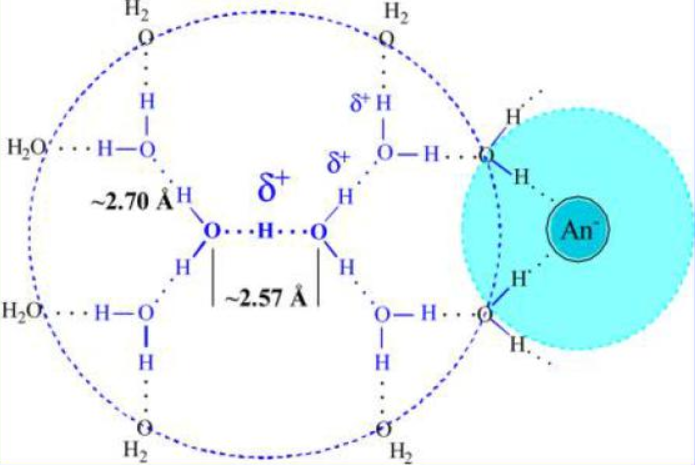
 水合質子
水合質子 常見水合配離子結構
常見水合配離子結構 Co2+的水合
Co2+的水合 膽礬結構
膽礬結構 水合氮氧根離子的幾種可能結構
水合氮氧根離子的幾種可能結構 離子結構
離子結構 離子結構
離子結構 離子結構
離子結構 離於的水化分層模型示意圖
離於的水化分層模型示意圖在電解質溶液里,離子跟水分子結合生成的帶電微粒,叫水合離子。例如[Fe(H2O)6]2+,[Mg(H2O)6]2+等。在水溶液里的離子大都以水合離子形式存在。有些離子與...
離子水合作用指的是離子和水分子之間的靜電作用(屬於離子-偶極作用)。當離子進入水中時,這種靜電作用就使水分子朝離子圍攏過來,最終使水分子與離子以特定的方式結合...
水合氫離子指的是氫原子在失去電子後,剩餘由1個質子構成的核,即氫離子,氫離子是“裸露”的質子,半徑很小,易被水分子吸引生成水合氫離子,通常用H3O+表示,所以...
離子水合是指離子與水分子相互作用並在離子周圍形成水化膜的過程。在電解質水溶液中,離子帶有正電荷或負電荷,而水分子為極性分子,它們之間必然存在靜電引力。當水...
水合物指的是含有水的化合物,其範圍相當廣泛。其中水可以以配位鍵與其他部分相連,如水合金屬離子,也可以是以共價鍵相結合,如水合三氯乙醛。也可以指是天然氣...
水合作用的實質是水分子整體進入礦物晶格,從而使礦物體積增大的作用。...... 溶質的分子或離子與溶劑的分子相結合的作用稱為溶劑化作用,生成水合分子(水合離子),...
水合金屬離子又稱水合離子,是水溶液中的金屬離子與水分子絡合生成的絡離子。...... 水合金屬離子又稱水合離子,是水溶液中的金屬離子與水分子絡合生成的絡離子...
水合質子指的是氫原子在失去電子後,剩餘由1個質子構成的核,即氫離子。氫離子是“裸露”的質子,半徑很小,易被水分子吸引生成水合質子,通常用H3O+表示,所以水的...
揭示水合離子的原子結構和幻數效應,2018年度中國科學十大進展之一。...... 2019年2月27日,揭示水合離子的原子結構和幻數效應入選中國科學十大進展。 [1] ...
水合反應( hydrated reaction),也叫作水化。是無機化學中指物質溶解在水裡時,與水發生的化學作用。一般指溶質分子(或離子)和水分子發生作用,形成水合分子(或水...
**注:中學一般認為鐵離子是黃色的,實際是錯誤的,嚴格來說最正確的解釋應該是六水合物的淡紫色,而其黃色來自於[Fe(H2O)6]3+水解後生成的[Fe(H2O)n(OH)6-...
解釋 全部H2O分子配位於金屬陽離子。例如, 六水合物Co(ClO4)2·6H2O中的6個H2O分子全部配位於Co2+離子, 可將其寫成[Co(H2O)6](ClO4)2。 ...
許多物質從水溶液里析出晶體時,晶體裡常含有一定數目的水分子,這樣的水分子叫做結晶水。含有結晶水的物質叫做結晶水合物。 水合物含一定量水分子的固體化合物。水...
絡離子是指由某些分子、原子或陽離子通過配位鍵與電中性分子或陰離子形成的複雜離子,例如水合離子。絡離子本身可以屬於陽離子或陰離子。 屬性 在化合物的原子間進...
多數水化金屬離子可以發生水解反應。根據酸鹼質子理論,由離子水化模型,我們認為水解反應是:水化金屬離子內配位層的配位水分子與溶劑水分子發生質子授受反應。即 M...
以碳酸氫銨為沉澱劑合成了十五種稀土碳酸鹽晶體。化學分析的結果表明,輕稀土碳酸鹽(鑭、鈰、鐠、釹)為八水合正碳酸鹽;部分中重稀土碳酸鹽(釤、銪、釓、鋱、...
絡合(Complexation)是電子對給予體與電子接受體,互相作用而形成各種絡合物的過程。給予體有原子或離子,不論構成單質或化合物,凡能提供電子對的物質,接受體有金屬...
水化反應在無機化學中指物質溶解在水裡時,與水發生的化學作用。一般指溶質分子(或離子)和水分子發生作用,形成水合分子(或水合離子)的過程。...
水分子的正、負電荷中心並不重合,是偶極子。它又有很強的的氫鍵作用,故水有特殊的結構。當鹽類溶於水中生成電解質溶液時,離子的靜電力破壞了原來的水結構,在其...
水可以用來溶解很多種物質,是很好的無機溶劑,用水作溶劑的溶液,即稱為水溶液。 當物質溶解於水時,一些共價化合物和離子化合物在水中發生電離,以水合離子的形式存...
水合氫離子的濃度取決於弱酸與其共軛鹼的濃度比。當加入少量強鹼時,酸被中和,導致了氫氧根離子在溶液中很少累積,從而 的濃度增加, 的濃度減少。可以看到,雖然加入了...
