物質簡介,水的形態,在宇宙中,在地球上,結構分析,內部結構,功能特性,生命搖籃,水與氣候,水的性質,純水密度,熱冰,顏色密度,冰點沸點,汽化熔化,熱容量,雪片,表面張力,動力粘滯性,介電常數,其他性質,
物質簡介 水 (
化學式 :H2O)是地球表面上最多的
分子 ,除了以氣體形式存在於大氣中,其液體和固體形式占據了地面70-75%的組成部分。
標準狀況 下,水在液體和氣體之間保持
動態平衡 。室溫下,它是無色,無味,透明的液體。作為通用溶劑之一,水可以溶解許多物質。因此,自然界極少有水的
純淨物 。 微生物易寄在水體表面。
心臟能跳動,血液能流動
水分子 肺能呼吸,關節能活動,肌肉能運動
多虧有了人體的冷卻系統!
--埃維昂公司瓶裝水廣告語節選
水的功能遠不止這些。
水是用得最普遍的物質。沒有水就沒有
生命 ,世界氣候就會是另一個樣子,最要緊的是無法用微波爐加熱食物。水這種物質如此特殊的原因何在?關鍵在於它的
分子結構 。
水的形態 水以多種形態存在,固態的水即我們熟知的
冰 ,氣態的水即我們所說的
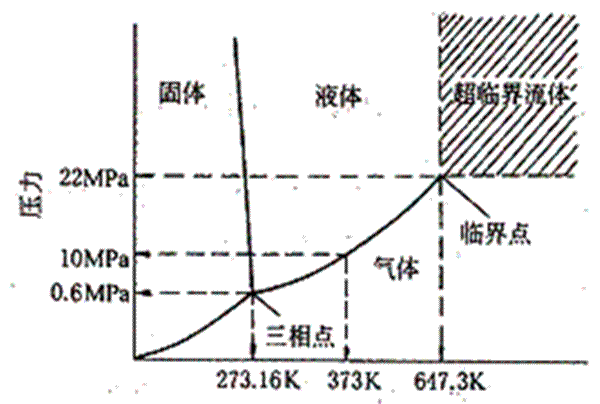
水蒸氣 (無色,我們看到的白色水氣是水蒸氣冷凝後的液態小水滴),而一般只有液態的水才被視為水。在其臨界溫度及壓力(647K及22.064MPa)時,水分子會變為一種“超臨界”狀態,液態般的水滴漂浮於氣態之中。
在宇宙中 在
銀河系 星雲中被探明存在水,由於
氫 和
氧 是構成宇宙的主要元素,科學家認為其他星系中依然存在大量水。
由於星雲塵埃的凝聚,形成各種
彗星 ,
行星 ,
矮行星 及其衛星,水也會存在於這些天體上。在太陽系中,水以固體形式存在於以下天體:
只在地球上發現液態形式的水,科學家也預測說液態水極有可能存在於
土衛二 的表面。
在地球上 水以
水循環 為載體存在於地球上,包括
大氣層 ,土壤含水,河流水,地下水,植物含水。
地球上的水含量(全部水)大約是1,360,000,000 km3 (326 000 000 mi3 )。包括了:
1,320, 000, 000 km3 (316 900 000 mi3 即 97.2%)在海洋中。
25, 000, 000 km
3 (6 000 000 mi
3 即1.8%) 在冰川,
冰蓋 ,
冰原 中。
13 ,000, 000 km3 (3,000,000 mi3 即0.9%) 是地下水。
250 ,000 km3 (60,000 mi3 即0.02%)是淡水,包括河湖,內陸海。
13, 000 km3 (3,100 mi3 即0.001%)存在於大氣層中。
結構分析 一個水分子的質量為:
18g/
mol ÷ 6.022 141 29 *10^23mol^-1 ≈ 3*10^-23 g
水分子的書寫:H2O
是由2個氫原子一個氧原子構成的
儘管水的行為複雜又獨特,它卻是又小又簡單的分子。它由兩個氫原子分別和一個
氧原子 鍵合而成(見圖1)。
水分子的三個
原子 形成104.5度角。每個
氫原子 和氧原子之間的鍵,叫共價鍵,通過分享一對電子形成。應當指出,一對電子的共享程度並不均衡。氧比氫更需要電子(這種特性稱為
電 負性)。換言之,氫原子和氧原子鍵合時,在這個過程中共
價電子 主要在
負電 的氧原子周圍運動。因此,
共價鍵 氧的一側帶負電(-),氫的一側帶
正電 (+)(
高中物理 課本就介紹過-e。註:亦有+e)。
水分子 如果水是線性分子,這些電荷就無關緊要。這種分子應該對稱(見圖2)。
(為了檢驗水分子是由三個
原子 組成的具有
對稱性 性質的分子,畫一條橫線與一條豎線穿過分子中部。如果分子對稱,上下、左右看上去都應該一樣。)正電荷均勻地分布在負電荷周圍,作用相互抵消。只有一個電荷中心;分子為無極性分子。
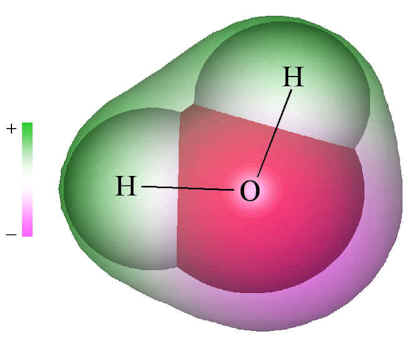
但是水分子為非線性,呈角分布,因而差異很大。
因為呈角分布,因而分子不對稱。在負電荷周圍,正電荷不均勻分布。作用不能相互抵消,兩者都有自己的電荷中心。分子有正負極。這是有極分子,化學家稱為
偶極子 。事實上,水分子是一種特殊的有極分子,其有極屬性比幾乎其他所有分子都明顯。
水分子 因而水分子呈非線性,且呈角分布。這方面哪怕稍有差池,生命就不會存在。
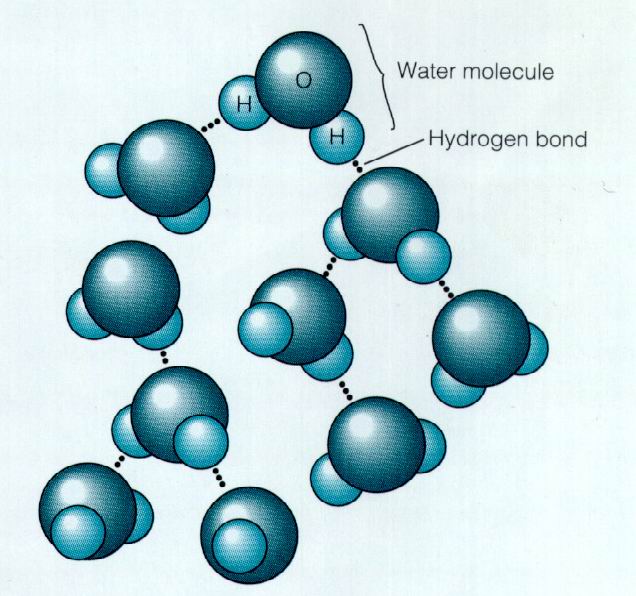
因為偶極子有正極與負極,活像小磁鐵。分子的正極吸引鄰近分子的負極,從而分子黏在一起。蜂蜜黏性大,就是這個原因。圖5為水分子相互吸引的示意圖。
用虛線表示吸引,因為偶極子間相互吸引涉及氫原子,故稱為
氫鍵 (氫鍵表示含氫的有極分子間的相互吸引。氫鍵比水分子內氧與氫兩種
原子 間的共價鍵弱)。水分子因其有明顯的
偶極子 屬件而由穩固的氫鍵結合在一起。它們趨於牢牢地粘在一起。牢固到什麼程度?用一個醫藥用的滴管,將水滴小心地滴到硬幣上。在水尚未從硬幣邊沿溢下來之前,數一下硬幣上的水滴數。
水分子 為了用別的方法演示水分子的黏性,在兩個玻璃杯或茶杯中分別裝上油和水,儘量將它們放平(和平面平行),分別在兩種液體上輕輕地放一個用密度比水和油大得多的鋼製成的小紙夾。紙夾本應沉入液體中,但事實是它漂浮在水面上,而不是在油上浮著。
其實,紙夾浮在水面上並非因為有浮力,或兩者存在密度差異,而是因為水有黏性,水面上的分子粘在一起構成透不過去的覆蓋層,叫
表面張力 。將紙夾往水面下壓,紙夾就會沉下去。
黏在一起的分子形成固體和液體。為了使分子不黏在一起而相互分開,並變成氣體,必須向水中增加大量的能量,通常都通過加熱。就是說,水的沸點高,往往呈液態。必須將水溫提高到212°F(100℃),分子才能有足夠能量克服氫鍵的強作用力而分開。溫度在32°F(0℃)和212°F之間時,水為液體。世界上幾乎所有地區的水全年多半為液體。
但是如果水不呈角分布,無極性,而不是有極性,就不會很黏,水的
沸點 將特別低。如果水無極性,估計在-85°F(-65℃)就會沸騰,那么在地球的所有溫度下水都應該是氣體。
水分子 微波爐之所以能烹調食物,是因為食物中含水。水是一種強
偶極子 。電學上的水是正、負極性很強的分子。微波像
無線電波 、光和X射線一樣是一種電磁輻射能,具有電和磁兩種特性。電磁能穿過食物時,導致水等極化分子振動。振動產生熱,這種熱煮熟放在微波爐中的食物。微波爐並不是常說的由里向外煮熟食物,煮熟食物的熱源來自食物內部而不是外部。水妙不可言,實際上是分子的妙不可言。
實際上水是液體,水分子呈角分布且有極性,而不是呈線性分布且無極性,因此水成為生命的源泉。
內部結構 北京大學 科學家在世界上首次拍到水分子的內部結構,並揭示了單個水分子和四分子水團簇的空間姿態。這一成果發表在《自然-材料》雜誌上。
上圖顯示了水分子在氯化鈉表面上的排列方式和單個水分子、四分子水團簇的內部結構
單個水分子的內部結構圖像。圖中花瓣部分是水分子的電子云,中間的暗縫是水分子內部化學鍵
水分子是地球表面上最多的分子,其內部結構非常基本,但是又具有很多奇妙的化學性質。水作為良好的溶劑為生命存在提供了基本條件,其獨特的氫鍵結構也一直讓科學家難以解釋。
北京大學量子材料中心、量子物質科學協同創新中心江穎課題組與王恩哥課題組合作,在水科學領域取得重大突破,在國際上首次實現了水分子的亞分子級分辨成像,使在實空間中直接解析水的氫鍵網路構型成為可能。相關研究成果於2014年1月5日以Article的形式線上發表在《自然-材料》[Nature Materials DIO: 10.1038/nmat3848]。江穎和王恩哥是文章的共同通訊作者,博士研究生郭靜、孟祥志和陳基是文章的共同第一作者,物理學院的李新征研究員和量子材料中心的施均仁教授在理論方面提供了重要的支持和幫助。這項工作得到了國家基金委、科技部、教育部和北京大學的資助。
功能特性 生命搖籃 地球上的生命經過了複雜的分子形成過程,這個過程叫
化學演變 (參見《地球生命的起源》)。這一過程涉及許多不同混合物的混合和反應。這時,液態水是任何物質無法與之相比的最好物質,它能溶解物質,提供相互碰撞和反應的介質。水被稱為萬能溶劑,尤其適合溶解
生命世界 中的許多物質。如果沒有液態水,生命肯定進化不了。生命在進入陸地之前在海洋中產生並生存了數億年,也充分地證明水的重要性。
生命茁壯成長的地球,有
水行星 之稱。液態水覆蓋地球表面的三分之二,重量約15×10
17 噸(共有28×10
24 滴)。
其他行星就沒有那么幸運了。火星上極其乾燥,沒有生命,儘管火星表面受侵蝕的溝渠表明水曾經在火星表面流動,也說明火星上可能有過生命。月球極其乾燥,並因為其他原因而沒有生命存在。水星也是如此。
金星 也因為溫度很高,不可能有液態水,也不存在生命。在金星上,鉛也會熔化。這是一顆名副其實的氣態巨星。冥王星則是個大冰球,不可能有生命存在。
液態水對生命的起源與維持都至關重要(只需喝一杯水,即可得到證實)。
有人一直有些似真非真地將生物說成“一袋酶”。這說明生物的機體極其複雜,井然有序。一次必須完成上千種不同的化學反應。酶協調並加速這些反應。要是沒有酶,很多反應會十分緩慢。水這種介質特別適合酶的工作,任何其他一種液體都不能像水那樣充分溶解許多物質,並促使它們反應。事實上任何其他液體都沒有類似的功能。水在
生命體 大量存在也許就是這個原因。在所有細胞中,水占70%~85%。在人體體重中,水占60%;在人體的大腦中,水占70%。在人體的骨頭中,水的重量占20%。人的體重正常為150磅(68公斤),其中水占40夸脫(38升)。
水很容易流動,這一點顯然有別於油和奶油凍等黏稠液體。水容易流動,而且溶解力很強,因而它是一種很好的運輸和循環流體。在血液中,水占93%,可溶解營養素、激素和代謝產物,在人體細胞中循環。
水蒸發時還帶走相當一部分熱。人發燒與出汗時,皮膚將汗水蒸發,帶走熱量,使人體降溫,水是人體的冷卻劑。
水還有比熱高的特點,能很好地穩定溫度,升溫與降溫都不很容易,因而人的體溫能穩定在98.6°F(37℃)。水的溫度穩定效應在生物界以外也有重要套用。
水與氣候 陸地的比熱較低,升溫和降溫都比水快得多。因此內陸地區四季的溫差比沿海地區大。例如,
冰島 首都雷克雅未克和
西伯利亞 維爾霍揚斯克的海拔和緯度相同,日常的陽光日吸收量與強度相同,因此它們的氣候,特別是溫度,理應相似。然而,事實並非如此。雷克雅未克位於冰島南海岸,臨近大西洋,年溫差只有20°F(11℃)。維爾霍揚斯克在亞洲大陸內陸,年溫差為120°F(67℃)。水的溫度調節效應在美國也很明顯,奧馬哈和內布拉斯加等內陸城市的年溫差比
加州 洛杉磯等海岸城市大。
水的性質 純水密度 大部分物質固態時的密度比液態時要高;因此,一塊固態純“物質”會沉入液態的純“物質”中。但是,一塊普通的冰卻會在水上浮,這是因為固態水的密度比液態水要“低”。這是水的一項非常重要的特性。在室溫時,液態水在溫度降低時密度會增加,這跟一般物質無異。但在接近冰點的3.98°C 時,水達到其最大密度,而且當水的溫度繼續向冰點下降,在標準狀態下液態水會膨脹,密度並因此會變“低”。這現象的物理原因跟普通凍的
晶體結構 有關,該結構又被稱為六角形冰I
h 。水、
鎵 、
鉍 、銻和
矽 都會在凝固時膨脹;其他大部份材料則收縮。但要注意的是,並不是所有種類的冰密度都比液態水低。例如高密度非結晶冰和超高密度非結晶凍的密度都比液態純水要高。因此,普通冰密度比水高的理由並不能容易地憑直覺所得,而且它跟
氫鍵 固有的不尋常特性有很大關係。
總的來說,水在凝固時的膨脹是由於其以氫鍵不尋常的彈性而排成的縱列
分子結構 ,以及能量特別低的六角形晶體形態(也就是標準狀態下所採用的形態)。那就是當水冷卻的時候,它嘗試在
晶格 形態下成堆,而該晶格會把鍵的
旋轉 及振動分量拉長,所以一個水分子會被鄰近的幾個分子推擠,這實際上就減少了當水在標準狀態下成冰時的水密度
ρ 。
這特性在地球
生態系統 中的重要性是不言而喻的。例如,“如果”水凝固的時候密度較高的話,極地環境中的湖泊和海洋最後都會結成冰(從上至下)。這是因為此時冰會沉到湖底及河床,而必要的升溫現象(見下文)在夏季時則因暖水層質量比底下的固態冰層低而發生不了。自然界的一個重要特徵就是上述並不會在環境中自然發生。
然而,冷水(在相關生物系統中的一般自然設定下)因
氫鍵 而在從冰點以上的3.98°C所開始產生的不尋常膨脹,為淡水生物在冬季提供了一重要的好處。在表面上被冷凍的水沉下,形成提供對流的水流並冷卻整個水體,但當湖水到達4°C 時,若繼續冷卻則表面水密度降低,形成一表面層,該層水最後會凝固成冰。由於向下的冷水流被密度的轉變擋住,冬季任何由淡水所成的大水體最冷的水都會在表面附近,離開湖底及
河床 。這說明了多種不為人知的冰性質,它們跟湖中的冰相關及像二十世紀早期科學家卡夫特(Horatio D. Craft)所描述的“跌出湖的冰”。
以下是水在不同溫度下的密度(g/cm3 ):
溫度 (°C) 密度 (g/cm3 ) 30
0.9957
20
0.9982
10
0.9997
3.98
1.0000
0
0.9998
−10
0.9982
−20
0.9935
−30
0.9839
熱冰 熱冰是水的另一個驚人現象,即水在室溫下,加以10伏特的電場,也能變成冰。
這個現象被用來解釋雲的形成,雲層里的冰晶初次形成時需要−10 °C的低溫,而後來再次結冰只需要−5 °C,這意味著晶體的結構發生了改變。
顏色密度 誰都知道:水是無色、
無味 的液體。 可是,著名詩人
白居易 在描繪江南水鄉美好春色時卻說:“日出江花紅勝火,春來江水綠如藍。”是詩人的藝術誇張和豐富想像嗎?碧波蕩漾的海洋為什麼又是蔚藍色的呢?
原來這是由
太陽光 所引起的,當太陽光照射在淺薄的水層時,光線幾乎毫無阻擋地全部透過,因此,水看上去是無色透明的。而當太陽光照射在深水層時,情況發生了變化。不同波長的光的特徵就表露出來,產生不同效果。波長長的光線穿透力強,容易被水吸收;波長短的光穿透力弱,易發生散射和反射。紅、橙和黃色一類波長較長的光,進入水體,在不同的深度被相繼吸收,並利用它們自己儲蓄的能量將海水加熱;
藍光 、紫光波長較短,經散射和反射後映入我們的眼帘,因此,浩渺海水便顯得蔚藍一片。
如果水體中含有大量粗而帶色的
懸浮物 ,或有為數眾多的浮游生物繁殖,水也會出現某種特殊的顏色。例如,
紅海 中生長了大量的藍綠藻,其體內藻紅素將紅海變成名副其實的紅色海洋;黃海則由於黃河帶來大量黃色泥沙而呈黃色;
黑海 的命名應該歸功於其深水中含有的硫化氫;而
白海 則完全是由於周圍環境的皚皚冰雪所致,也難怪古人云“
近朱者赤,近墨者黑 ”。
大家知道,一切物質受熱時都增大自己的體積,即
熱脹冷縮 ,同時減小密度。水也具有這種性質,但是在 0℃和 4℃之間例外,此時隨著溫度的升高,水的體積並不是增加,而是縮小。4℃時水的密度最大。因此,水的體積和溫度之間的關係不是直線關係,而是曲線關係,這和大多數物質不一樣。
多數物質受熱時密度減小(將物質的緊密度或將分子擠壓在一起的程度看作密度最為方便),以一塊銅幣為例。銅幣受熱時,銅
原子 運動加快且擴散。銅幣所占空間略有增加,密度減小。繼續加熱直到最後熔解。液態銅的密度肯定比固態小。液體銅受熱,其分子繼續擴散,密度越來越小。幾乎所有的純物質都按照這一規律,但水例外。
水在50°F(10℃)時為液體,我們將水冷卻,而不將其加熱。據推測,水冷卻時,分子運動減慢,相互靠近,水的密度增加。但在39°F(4℃)時出現了反常現象,將水進一步冷卻時,水分子開始擴散。32°F(0℃)時,水凝固,水分子進一步擴散,體積增加近10%(在溫度低於“
凝固點 ”的地區,必須往汽車水箱中加入
防凍液 ,就是這個原因。一旦水凝固,會將汽車的發動機組脹破)。也就是說,39°F水的
密度比 32°F時水的密度大。任何溫度下,液體水的密度都比凍的密度大。冰塊在水面上漂浮,就是這個原因。這一反常現象,歸因
於冰 中的水分子形成一種相當開放的晶體結構。溶解時,這種開放結構崩潰,分子進一步聚攏,加大了物質的密度。這種開放結構只有在水溫達到39°F時才完全崩潰。
水的反常現象對我們周圍的世界產生有趣的影響。例如,季節變化時,湖泊和深的池塘發生的變化。冬天來臨,氣溫下降,湖面的水受冷,密度加大而下沉,下面的溫度稍高的水上升又被冷卻。溫度在39°F以上時,水受冷會下沉。由39°F降到32°F時,水的密度減小,停留在表面,最後凝固成冰。水體自上而下凝固。而幾乎所有其他液體是自下而上凝固。
湖泊或池塘中的水,自上而下凝固,即使在氣溫低於32°F時仍能保持液態。水面的冰起了熱障的作用,將下面的液體同上面寒冷的空氣隔開。除了淺池塘外,水體底部通常保持液態。因此,
海洋生物能 在嚴冬中生存下來。
將冰逐漸加熱融化成0℃的水,這時結晶中的空隙由於水的侵入而被填充,使 0℃水的
密度比 凍的密度急速增大。但比較起來,此時水的分子空隙並不是完全填滿的,其密度應為0.99987g/cm3。可在 4℃時,水的空隙被依次填滿了,此時的密度最大,密度為0.9999720g/cm3,相對密度為1.0000000g/cm3。而大於4℃的水則發生熱膨脹,分子運動逐漸變得活躍起來,其密度又逐漸變小了。儘管水有上述異常,但它仍然是密度的標準,4℃時,1cm3的水的質量為1g。
冰點沸點 標準大氣壓 下,水的冰點為0℃,沸點為100℃。不難看出,這又是以水的物理特徵為標準,進行溫度的測定。
如果以氫和
化學元素周期表 中VIa族的一些化合物,如H2Te、 H2Se、 H2S、 H20相比較,計算一下它們的相對分子量,結果發現水的
冰點 和沸點不在其他3個化合物的普遍規律性之中,其他3個化合物的相對分子量越大,沸點和冰點就越高。假如水也符合此規律,那么水的冰點似乎應為一90℃--120℃,沸點大約為一75℃--100℃,而實際上則分別為全0℃和100℃,相差甚遠。
水的沸點隨壓力的增加而升高,很久以前,水的這一性質被用在山地高程的確定上。沸騰時的溫度也隨水中溶解物質含量的增加而升高。
壓力和水的
冰點 之間存在著另一種奇異的關係:在 2200 個
大氣壓 以下,隨著壓力的增加冰點降低;越過 2200 個大氣壓以後,水的冰點隨壓力增加而升高。3530 個大氣壓力下,水於 -17℃結冰;6380 個大氣壓下為 0℃;16500 個大氣壓力下為 60℃,而20670 個大氣壓力下,水在76℃時才結冰。如果後兩種情況存在,那么我們便可以得到
熱冰 。但事實是在地球
岩石圈 和
上地幔 並不存在著這樣溫度和壓力的組合。
汽化熔化 為了保證液體能在恆溫下蒸發,必須向它提供足夠的熱量以補償由於高能分子的逃逸所造成的損失,這份熱量稱為汽化熱。汽化熱不是水所特有的,任何液體蒸發時都需要吸收這份熱量,只是水的汽化熱特別高,才是它的突出之處。
水具有超乎尋常的
汽化熱 ,在日常生活和生產上得到了套用。比如,大的食堂利用鍋爐蒸汽來蒸飯;手扶拖拉機則利用它來散熱。汽化熱在恆溫下是一個常數。溫度變了,汽化熱將隨之發生變化。
液態水變成氣態的水蒸氣,水分子本身的大小依然如故,保持不變,但是,分子間的距離卻大大增加了,體積發生了驚人的變化。如1
摩爾 水,在1個
大氣壓 下,100℃時,體積約為18.8mL;當變成水汽後,在同樣條件下,體積增大到301000mL。也就是說,體積增大了16000倍。我們可以想像,利用蒸汽做功時,發揮的力量該是多大啊!
水的
熔化 潛熱(融解熱)很高,在0℃和一個標準大氣壓下,大約為333.69J/g。這是指水凝結成冰時放出的熱量,或冰熔化成水時需要吸收的熱量。
水的
熔化潛熱 與一般
物質 相比,除了其值較高(例如,純鐵的熔化"潛"熱為 25J/g,硫的是39.8SJ/g,鉛的是 23J/g)外,還有一個異常的特點:冰在一個大氣壓力下的溫度,可以為 -1~-7℃之間,看來好像是凍的溫度越低,需要熔化它的熱就越多,這個結論似乎是理所當然的,我們普通讀者--作為熱物理學的門外漢--對這個問題大概不會有太多的異議。然而,事實卻並非如此,-70℃時,熔化潛熱並不是333.69J/g,而是301.45J/g!這真是一個不容爭辯,而且相當難以置信、出乎意料的異常特性。凍的溫度每降低1度,其
熔化熱 大約減少2J,因為凍的單位熱容量比水小。
熱容量 把1克物質的溫度升高(或下降)1℃時所需要(釋放)的熱量稱作比熱容,在數量上等於此物質的熱容量。在 15℃時,水的熱容量為41868J/(g·0℃)也就是說,1g水,若要使其溫度上升1℃,需要41868J的熱量。這又是以水的物理特徵作為標準的一個例子。
水的
熱容量 比大多數物質的熱容量都大(只有氧、鋁等的熱容量比水大)。例如,土和砂之類的物質,熱容量為0.84J/(g·℃),鐵和銅等金屬僅為 0.42J/(g·℃),酒精和甘油為 1.26J/(g·℃),鉑為 0.12J/(g·℃),木料為0.6J/(g·℃)。這種水與土之間熱容量的巨大的差異,反映在氣候學上,就是海洋性氣候比大陸性氣候升溫慢,降溫亦慢,變幅較小的現象。
除汞和液態水外,一切物質的單位熱容量都隨溫度的升高而增加。在0~35℃,水的單位熱容量隨溫度升高而降低,在35℃以後,水的熱容量則隨溫度的升高而增加。水的熱容量和水的密度一樣,與溫度的關係不是直線,而是曲線關係。例如,25℃和 50℃時水的單位熱容量一樣,都是4.17843J/g·℃。
雪片 水也可以是藝術品。雪是固態水的一種,其形狀美麗迷人,是自然界最精美的圖案之一。但雪也常常令人想起鏟雪、汽車開不動和霜傷等諸多不便。下雪時,取一片雪花放在一張黑紙上用放大鏡仔細觀察。就會看到雪花呈六邊形,這是水分子相連的結果。如果降雪地區氣溫較高(仍然低於凝固點),雪花會又大又複雜。如果氣溫很低,雪花小且簡單。因為溫度較高的空氣一般都較潮濕,雪晶體生成時有較多的水分子。
這些不尋常的晶體形狀差異很大。有的內部扁平像繡出的六邊形,或六邊圓柱體,或是星形,六邊支叉從中心向外不同的方向輻射。雪晶體的形狀很大程度上取決於溫度,也受到雪花落到地面的
速率 等其他因素的影響。
雪片的結構完全開放,就是說,雪晶體有許多大孔。因此,雪的
密度比 普通的冰低得多(眾所周知,凍的密度又比液體水低)。實際上,厚50英寸的乾粉末狀的雪溶化後只有約一英寸厚的雨水。
水蒸氣 在
塵埃 周圍聚集凝固,在
高層大氣 中形成雪。雪通常不是由液體水凝固而成,這倒挺有意思的。
常言道找不到兩片完全一樣的雪花。這種說法是否站得住?從某種意義說,是正確的。普通的雪晶體約有1019個水分子。它們的三維組成幾乎是無窮的。任何兩片雪花的分子結構都不一樣。乍一看,雪片的外形和大小都相似。《
今日美國 》的氣象學家
傑克·威廉士 在《天氣》一書中說到:“許多小的雪晶體結構簡單,為六面形雪片,形狀上沒有明顯的不同。即使再複雜的晶體也可能相似”。
表面張力 表面張力是水以及固體的邊界分子聯結、"集合"、縮小體積(
內聚力 )的一種能力。水的表面分子凝聚形成張力膜,若要破壞張力膜需要相當大的力,也就是說,水的表面張力比較大。比水重8倍多的東西,比如保險刀片和針等能夠平放在水面上而不會沉入水下。 18℃時水的表面張力是 72X10-5J/cm2,應該說這個數值是很高的,因為,
酒精 的表面
張力為 22 X 10-5J/cm2,丙酮為24 X 10-5J/cm2,汽油為29 X10-5J/cm2。事實上,水的表面張力在所有液體中僅次於水銀(其表面張力約為 500X10-5J/cm2)而名列第二。水所具有的較強的表面張力控制著土壤和植物中的水分存在狀況,影響著
地球表層 的自然地理現象。
水還有一個奇怪的性質,就是在細玻璃管(
毛細管 )中可以觀察到"粘著性"(附著性)。毛細管中的水向上升,與引力(重力)相反。在與空氣接觸的
邊界層 里,水分子的凝聚力,同水使管壁濕潤對管壁"粘著"力相配合,結果,毛細管中便形成高於自然水面的凹形面。具有更大表面張力的汞沒有粘著力,所以汞在毛細管中不是凹形面,而是凸形面。必須注意,水對
油質 管壁不粘著,比如水在內壁塗以石蠟的毛細管中的液面,如同汞一樣是凸形,而不是凹形。
毛細常數的概念是指液體的上升高度與毛細管半徑的乘積。純水的毛細常數隨溫度的升高而呈
線性 減小,而在達到
極限 時等於零。15℃時水的極限
毛細上升高度 ,粗砂為0.2m,細砂為1.2m,而純粘土則為12m。上升持續的時間是:粗毛管為5~10天,細毛管16個月,這在
土壤物理學 上有著重大的實際意義。
動力粘滯性 水的這個性質在通過孔隙介質(比如沙)的滲透過程中有很大意義。
礦化水 ,尤其是鹽水,在相同溫度下透過孔隙介質時,其
粘滯性 大大提高。0℃條件下,純水的動力
粘滯係數 為1.789 X 102Pa·s,而100℃時只是0.282X102Pa·s,少了約5/6。為比較起見,我們以汞的粘滯係數為例,0℃時等於 1.69X102Pa· s,100℃時為 l.22X102Pa· s,僅僅減少了 7%。水蒸氣的粘滯係數,15℃時只有 0 98Pa· s,即比同溫度下水的粘滯係數小得多,差了180倍。
水的
粘滯性 高和
表面張力 大,合起來的作用使農田水分流失較慢,無需經常灌溉;反之,如果水分流失較快,就需要經常灌溉。
介電常數 電容器的電容C,由於電極板之間存在的物質種類不同而有很大的變化。這種變化的程度,可用下式定義的介電常數。來表示,其數值為該物質及其狀態所固有:C=εC0 式中,和εC0分別為在電極板間有物質存在時和
真空 時電容器的電容。的值,在空氣中是1.0006,在雲母中為604,在CS2中為2.6左右,水的值特別大,一定條件下為80左右。水的介電常數高是由於分子極性強造成的,這個性質使水成為一種優良溶劑。
其他性質 水除了具有上述較為奇異的物理性質外,還有一些其他異常的
物理 特性,例如,水的
導熱性 較其他液體小,在20℃時水的
熱導率 為 0.00599 J/(s· cm·℃),凍的熱導率為 0.0226 J/(s·cm·℃),雪的熱導率與雪的密度有關,當
密度 為 0.1kg/L時,其熱導率為 0.00029 J/(s·cm·℃)。水的
壓縮率 很小,體積
壓縮係數 為 4.74X10-10m2/N,一般認為不可
壓縮 。光在水中的
傳播 速度為空氣中的75%。水的折射率為1.33,所以在以空氣為界面的情況下,光在水中可以產生
全反射 。純水幾乎是不導電的,
天然水 有微弱的
導電性 ,含有離子雜質(
鹽類 )的水則是良好的
導體 .
 水分子
水分子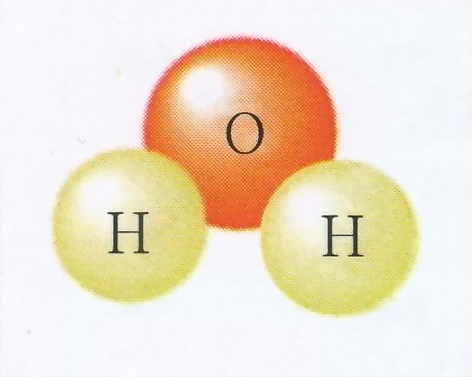 水分子
水分子 水分子
水分子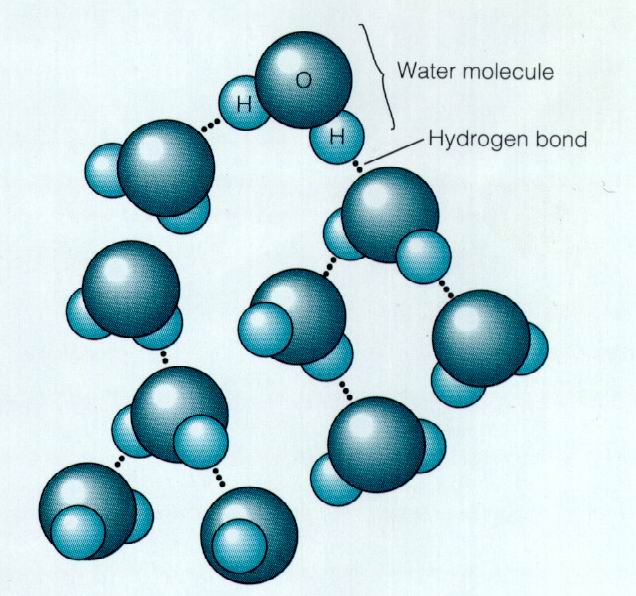 水分子
水分子 水分子
水分子