基本介紹
分類
同核雙原子分子
異核雙原子分子
準雙原子分子
分子軌道能級圖
同核雙原子分子的分子軌道能級圖
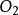
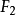

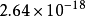

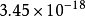
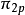

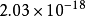
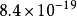

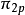


異核雙原子分子的分子軌道能級圖

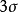
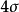
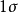
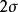
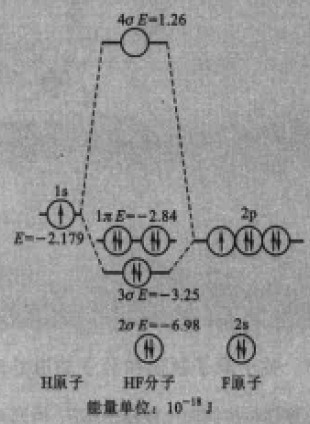 圖3HF的分子軌道能級圖
圖3HF的分子軌道能級圖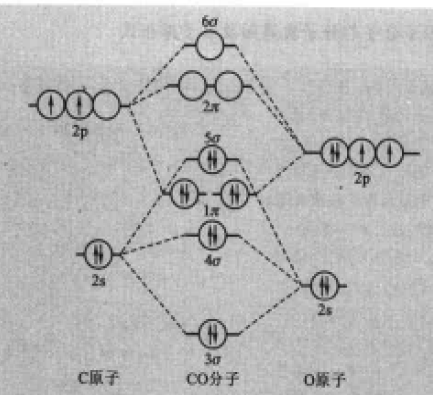 圖4CO的分子軌道能級圖
圖4CO的分子軌道能級圖分子軌道電子排布式
同核雙原子分子分子軌道電子排布式
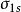

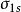

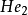
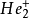
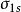

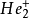
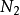
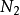
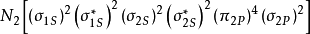
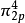
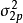
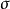
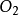
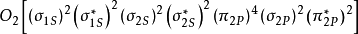
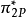
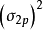
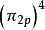
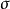
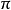
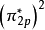
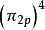
異核雙原子分子分子軌道電子排布式
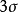
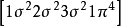
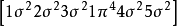

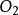


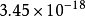
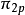

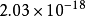
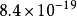

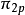



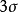
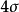
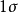
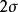
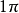
 圖3HF的分子軌道能級圖
圖3HF的分子軌道能級圖 圖4CO的分子軌道能級圖
圖4CO的分子軌道能級圖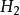

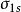

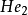
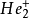
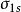

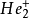
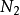
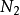
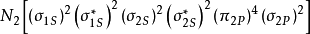
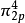
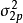
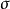
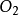
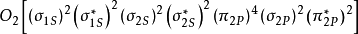
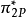
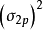
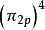
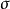
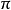
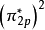
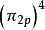
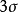
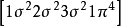
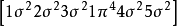

雙原子分子指所有由兩個原子組成的分子。雙原子分子內的化學鍵通常是共價鍵,分子間存在色散力和部分誘導力。...
雙原子分子電子態是按照雙原子分子電子的總角動量量子數和波函式的空間對稱性來分類的分子狀態。...
雙原子分子純轉動光譜,通常是指分子最低電子態和振動態內的轉動能級間電偶極躍遷產生的光譜,譜線的波長範圍一般在微波或遠紅外區。不等電荷核的雙原子分子具有固有...
雙原子碳,是高溫下碳單質的一種雙原子分子存在形式。...... 雙原子碳簡介 編輯 雙原子碳,是高溫下碳單質的一種雙原子分子存在形式,分子式為C2。...
分子自由度是物體運動方程中可以寫成的獨立坐標數,單原子分子有3個自由度,雙原子,三原子不考慮振動相當於剛體,分別有5個(3平2轉)、6個自由度(3平3轉),考慮...
分子是由組成的原子按照一定的鍵合順序和空間排列而結合在一起的整體,這種鍵合順序和空間排列關係稱為分子結構。由於分子內原子間的相互作用,分子的物理和化學性質...
分子可以由同種原子構成,也可以由不同種類的原子構成。最簡單的分子只含有一個原子,如稀有氣體的分子。大多數非金屬構成的分子為雙原子分子,如氮、氧等分子。化合...
它的要點是:從分子的整體性來討論分子的結構,認為原子形成分子後,電子不再屬於個別的原子軌道,而是屬於整個分子的分子軌道,分子軌道是多中心的;分子軌道由原子軌道...
有的分子僅由一個原子構成,稱單原子分子,如氦和氬等分子屬此類,這種單原子分子既是原子又是分子。由兩個原子構成的分子稱雙原子分子,例如氧分子(O2)和一氧化碳...
分子中正負電荷中心不重合,從整個分子來看,電荷的分布是不均勻的,不對稱的,這樣的分子為極性分子,以極性鍵結合的雙原子分子一定為極性分子,極性鍵結合的多原子分子...
分子的存在形式可以為氣態、液態或固態。分子除具有平移運動外,還存在著分子的轉動和分子內原子的各種類型的振動。固態分子內部的振動和轉動的幅度,比氣體和液體中...
《高等原子分子物理學》是2011年科學出版社出版的圖書,作者是徐克尊。...... 《普通高等教育"十一五"國家級規劃教材·中國科學技術大學精品教材:高等原子分子物理學》...
自由度是物體運動方程中可以寫成的獨立坐標數,單原子分子有3個自由度,雙原子、非線性三原子、線性三原子不考慮振動相當於剛體,分別有5個(3平2轉)、6個(3平3...
鹵族元素的單質都是雙原子分子,它們的物理性質的改變都是很有規律的,隨著分子量的增大,鹵素分子間的色散力逐漸增強,顏色變深,它們的熔點、沸點、密度、原子體積也...
安徽省高校中青年學術帶頭人培養對象,安徽師範大學碩士學位評定委員會委員,現任物理與電子信息學院教授,碩士生導師,物理與電子信息學院原子與分子物理實驗室和近代物理...
氫是一種化學元素,在元素周期表中位於第一位。氫通常的單質形態是氫氣。它是無色無味無臭,極易燃燒的由雙原子分子組成的氣體,氫氣是最輕的氣體。醫學上用氫氣...
