研究歷史,含量分布,物理性質,基本信息,超流動性,超導現象,化學性質,氟化物製取猜想,離子化合物,中性分子,氦鈉化合物,同位素,製取方法,作用用途,危險性,引起窒息,安全事項-氦氣瓶,氦氣對人體的不良反應,
研究歷史 1868年8月18日,法國天文學家讓桑赴印度觀察
日全食 ,利用分光鏡觀察
日珥 ,從黑色月盤背面突出的紅色火焰,看見有彩色的彩條,是太陽噴射出來的熾熱的光譜。他發現一條黃色譜線,接近鈉光譜總的D1和D2線。日蝕後,他同樣在
太陽光譜 中觀察到這條黃線,稱為D3線。1868年10月20日,英國天文學家
洛克耶 也發現了這樣的一條黃線。
威廉·拉姆塞 經過進一步研究,認識到是一條不屬於任何已知元素的新線,是因一種新的元素產生的,把這個新元素命名為 helium,來自希臘文helios(太陽),元素符號定為He。這是第一個在地球以外,在宇宙中發現的元素。為了紀念這件事,當時鑄造一塊金質紀念牌,一面雕刻著駕著四匹馬戰車的傳說中的太陽神
阿波羅 (Apollo)像,另一面雕刻著詹森和洛克耶的頭像,下面寫著:1868年8月18日太陽突出物分析。在詹遜從太陽光譜中發現氦時,英人J. N. Lockyer和E. F. Frankland認為這種物質在地球上還沒有發現,因此定名為“氦”(法文為hélium,英文為helium),源自希臘語ήλιος,意為“太陽”。
過了20多年後,
拉姆賽 在研究釔鈾礦時發現了一種神秘的氣體。由於他研究了這種氣體的光譜,發現可能是詹森和洛克耶發現的那條黃線D3線。但由於他沒有儀器測定譜線在光譜中的位置,他只有求助於當時最優秀的光譜學家之一的倫敦物理學家克魯克斯。克魯克斯證明了,這種氣體就是氦。這樣氦在地球上也被發現了。
在二十世紀初的幾十年里,世界各國都在尋找氦氣資源,在當時主要是為了充飛艇。但是到了二十一世紀,氦不僅用在飛行上,尖端科學研究,現代化工業技術,都離不開氦,而且用的常常是液態的氦,而不是
氣態 的氦。液態氦把人們引到一個新的領域——低溫世界。
英國物理學家
杜瓦 (Dewar)在1898年首先得到了液態氫。就在同一年,荷蘭的物理學家卡美林·奧涅斯也得到了液態氫。液態氫的沸點是零下253℃,在這樣低的溫度下,其他各種氣體不僅變成液體,而且都變成了固體。只有氦是最後一個不肯變成液體的氣體。包括杜瓦和卡美林·奧涅斯在內的科學家們和決心把氦氣也變成液體。
1908年7月13日晚,荷蘭物理學家卡美林·奧涅斯(Heike Kamerlingh Onnes
昂納斯 )和他的助手們在著名的萊頓實驗室取得成功,氦氣變成了
液體 。他第一次得到了320立方厘米的液態氦。
要得到液態氦,必須先把氦氣壓縮並且冷卻到液態空氣的溫度,然後讓它膨脹,使溫度進一步下降,氦氣就變成了液體。液態氦是一種與眾不同的液體,其沸點為零下269℃。在這樣低的溫度下,氫也變成了固體,與空氣接觸時,空氣會立刻在液態氦的表面上凍結成一層堅硬的蓋子。
1934年,在英國
盧瑟福 那裡學習的前蘇聯科學家卡比查發明了新型的
液氦 機,每小時可以製造4升液態氦。以後,液態氦才在各國的實驗室中得到廣泛的研究和套用。
含量分布 氦存在於整個宇宙中,按質量計占23%,僅次於
氫 。但在自然界中主要存在於天然氣體或放射性礦石中。在地球的
大氣層 中,氦的濃度十分低,只有5.2萬分之一。在地球上的放射性礦物中所含有的氦是
α衰變 的產物。氦在某些天然氣中含有在經濟上值得提取的量,最高可以含有7%,在美國的天然氣中氦大約有1%,在地表的空氣中每立方米含有4.6立方厘米的氦,大約占整個體積的0.0005%,密度只有空氣的7.2分之一,是除了氫以外密度最小的氣體。
地殼中含量
0.008(ppm)
元素在太陽中的含量
230000(ppm)
元素在海水中的含量
0.000006(ppm)
物理性質 基本信息 氦的原子光譜 元素符號 He,
原子序數 2,
原子量 4.002602(氦4),為稀有氣體的一種。元素名來源於希臘文,原意是“太陽”。
氦有兩種天然
同位素 :
氦3 、氦4,自然界中存在的氦基本上是氦4。
相對原子質量 為4.003。1868年有人利用分光鏡觀察太陽表面,發現一條新的黃色譜線,並認為是屬於太陽上的某個未知元素,故名氦。氦在空氣中的含量為0.0005%。
通電發光後的氦氣 氦在通常情況下為無色、無味的氣體;熔點-272.2℃(25個大氣壓),沸點-268.9℃;密度0.1785克/升,臨界溫度-267.8℃,臨界壓力2.26大氣壓;水中溶解度8.61厘米3 /千克水。
氦是
惰性元素 之一,分子式為He,是一種
稀有氣體 ,無色、無臭、無味。它在水中的溶解度是已知氣體中最小的,也是除氫氣以外密度最小的氣體。密度0.17847克/升,熔點-272.2℃(25個
大氣壓 )。沸點-268.9℃。它是最難
液化 的一種氣體,其臨界溫度為-267.9℃。
臨界壓力 為2.25大氣壓。當液化後溫度降到-270.98℃以下時,具有
表面張力 很小,
導熱性 很強,幾乎不呈現任何粘滯性。液體氦可以用來得到接近
絕對零度 (-273.15℃)的低溫。
化學性質 十分不活潑,既不能燃燒,也不能助燃。氦也是最難液化的氣體。
氦在通常情況下為無色、無味的氣體。是唯一不能在標準大氣壓下固化的物質。
液態氦 在溫度下降至2.18K時,性質發生突變,成為一種
超流體 ,能沿容器壁向上流動,熱傳導性為銅的800倍,並變成超導體;其
比熱容 、表面張力、壓縮性都是反常的。
由於液氦的超低溫,在此溫度下出現了許多奇妙的物理現象。許多重要的物理實驗,都要在低溫下進行。世界各國的物理學家都在研究液態氦,希望通過液態氦達到更低的溫度,研究各種物質在低溫下會發生什麼變化,會有什麼我們還不知道的性質。這就產生了物理學的一個新的分支——低溫物理學。
熔點
-272.2℃(25個大氣壓);
沸點
-268.9℃;
密度
0.1785克/升
臨界溫度
-267.8℃
臨界壓力
2.26大氣壓
水中溶解度
8.61立方厘米/千克水
熱導率
151.3W/(m·K)
晶體結構
晶胞為六方晶胞
氦-4
下表為液氦(氦4)的一些基本
物理性質 (某些參數測定時的狀態不詳):
正常沸點/K
4.224
密度/kg/m3
124 96
蒸發熱/kJ/kg
20.73
比熱/kJ/(kg·K)
4.56
粘度/MPa·s
3.57
熱導率/mW/(m·K)
2.72
介電常數
1.0492
臨界溫度/K
5.201
臨界壓力/MPa
0.227
氦-3
氦3是自然界中氦的
穩定同位素 ,原子量為3.016,原子核由2個質子和一個中子組成。通常情況下,氦3為無色、無味、無毒、不燃燒的惰性氣體,在0℃及0.101325MPa下密度是0.1345kg/m
3 。
氦-3 下表為液氦(氦3)的一些基本物理性質:
正常沸點/K
3.191
密度/kg/m3
82.3
蒸發熱/J/mol
20.56
1.0K時的比熱/J/(mol·K)
4.222
3.2K時的粘度/mPa·s
3.57
3.2K時的熱導率/mW/(m·K)
20
臨界溫度/K
3.324
臨界壓力/MPa
0.115
超流動性 卡美林·奧涅斯是第一個得到液氦的科學家。他又將溫度進一步降低,試圖得到固態氦,卻並沒有成功(固態氦是1926年基索姆用降低溫度和增大壓力的方法首先得到的)。
對於一般液體來說,隨著溫度降低,密度會逐漸增加。卡美林·奧涅斯使液態氦的溫度下降,液氦的密度增大了。但是,當溫度下降到零下271℃的時候,液態氦突然停止起泡,同時密度也突然減小了。
這是另一種液態氦。卡美林·奧涅斯把前一種冒泡的液態氦叫做氦Ⅰ,而把後一種靜止的液態氦叫做
氦Ⅱ 。
把一個小玻璃杯按在氦Ⅱ中。玻璃杯由空的漸漸裝滿了。把這個盛著液態氦的小玻璃杯提出來,掛在半空時,玻璃杯底下出現了液氦,不一會,杯中的液態氦就“漏”光了。
氦Ⅱ能夠倒流,它會沿著玻璃杯的壁向高處倒流。此現象只能在低溫狀態下才會發生,名為“
超流動性 ”,具有“超流動性”的
氦Ⅱ 叫做
超流體 。
後來,許多科學家研究了這種怪現象,又有了許多新的發現。比如1938年阿蘭等人發現的氦刀噴泉。在一根玻璃管里,裝著很細的金剛砂,上端接出來一根細的噴嘴。將這玻璃管浸到氦Ⅱ中,用光照玻璃管粗的下部,細噴嘴就會噴出氦Ⅱ的噴泉,光越強噴得越高,可以高達數厘米。
氦Ⅱ噴泉也是超流體的特殊性質。在這個實驗中,光能直接變成了
機械能 。
超導現象 在液氦的溫度下,在一個鉛環上放置一個鉛球。鉛球會好像失重而飄浮在環上,與環保持一定距離。在同樣的溫度下,用細鏈子繫著磁鐵,慢慢放到一個金屬盤子裡去。當磁鐵快要碰到盤子的時候,可以觀察到,鏈子鬆了,磁鐵浮在盤子上,若此時輕輕拍打磁鐵,它會自行旋轉。這種現象只能在低溫觀察到,高溫下不會產生。
這是低溫下的超導現象。有些金屬在液態氦的溫度下,原子核的運動幾乎停止,對電子的阻礙變得極小,因此電阻會消失,成為超導體;由於磁力線不可能穿過超導體,於是在超導體與磁體中間形成了較大的磁場,磁場的斥力托住了鉛球和磁鐵,使它們浮在半空中。這就是
邁斯納效應 (Meissner Effect),這一效應可以被利用來製造
磁懸浮列車 。
化學性質 元素周期性質 氦是所有元素中最不活潑的元素,極難形成化合物,這是因為氦的
原子核 到電子層距離很小,並且達到了穩定結構。它的性質便決定了用途,氦的套用主要是作為保護氣體、氣冷式核反應堆的工作流體和超低溫冷凍劑等等。
2017年2月6日,中國南開大學的
王慧田 、
周向鋒 團隊及其合作者在《
Nature Chemistry 》上發表了有關在高壓條件下合成氦鈉化合物——Na2He的論文,結束了氦元素無化合物的歷史,標誌著我國在稀有氣體化學領域走到了最前沿。
氟化物製取猜想 Pimental等根據HeF2 的電子排布同穩定的HF2 - 相似,提出了利用核轉變製備HeF2 的三種方法。
1.氚的β衰變法
氚經過β衰變後應變成氦。這樣,氚的化合物經β衰變後,就有可能成為氦化合物。為了便於進行反應,首先通過氘和氫的同位素交還,將氘固定在KHF2 的固體晶格中。俘集在晶格中的TF2 - 發生核反應後,便會生成HeF2 。
TF2 - → HeF2 +β-
氘在衰變過程中的反衝能量,不致使新生成的二氟化氦斷鏈。氘衰變的半衰期為12.25年,估計1 0 Ci的氚,經4~5個月,僅能生成10μmol的HeF2 .
2.熱中子輻照法
用熱中子輻照LiF來產生核反應
3 6 Li + 0 1 n → 2 4 He + 1 3 T
Li(n,α)反應後,生成的氦核同母體晶格中的F- 相結合而生成HeF2 .
3.直接用α粒子轟擊固態氟來製備HeF2
由此看來,這三種方法中,以第一種方法製成HeF2 的可能性最大,但至今還沒有見到已製成的報告。Malm等認為HeF2 和HF2 - 的電子排布雖然相似,但HF2 - 是H- 同兩個F原子相作用而生成化合物,H- 的電離勢僅為0.7eV,而氦的電離勢高達25eV,因此對HeF2 是否存在是值得懷疑的。
離子化合物 氦合氫離子 ,
化學式 為HeH
+ ,是一個帶正電的離子。它首次發現於1925年,通過
質子 和氦原子在
氣相 中反應製得。它是已知最強的酸,
質子親和能 為177.8 kJ/mol。這種離子也被稱為
氦氫分子離子 。有人認為,這種物質可以存在於自然
星際物質 中。這是最簡單的異核離子,可以與同核的氫分子離子H
2 相比較。與H
2 不同的是,它有一個永久的鍵偶極矩,使它更容易表現出光譜特徵。
電離過程-360 kJ/mol的
自由能 變化相當於
pK a 為-63。
其他氦氫離子已經知道或者在理論上研究。HeH2 ,已經被微波光譜觀測到,科學家計算出它的親和能為6 kcal/mol,而HeH3 為0.1 kcal/mol。
中性分子 不同於
氦合氫離子 ,氫和氦構成的中性分子在一般情況下是很不穩定的。但是,它作為一個
準分子 在
激發態 是穩定的,於20世紀80年代中期首次在光譜中觀測到。
HHe(g )
→
H(g )
+ He(g )
+178 kJ/mol
HHe(aq )
→
HHe(g )
+973 kJ/mol
H(g )
→
H(aq )
– 1530 kJ/mol
He(g )
→
He(aq )
+19 kJ/mol
HHe(aq )
→
H(aq )
+ He(aq )
– 360 kJ/mol
即便如此,這些離子或分子僅出現於“瞬間”,或者僅通過計算得出,故它們尚且難以認為是存在的“化合物”。
氦鈉化合物 2017年2月6日,中國南開大學的
王慧田 、
周向鋒 團隊及其合作者在《
Nature Chemistry 》上發表了有關在高壓條件下合成氦鈉化合物——Na
2 He的論文,結束了氦元素無化合物的歷史,標誌著我國在稀有氣體化學領域走到了最前沿。
此前,研究人員已經找到其他元素與氦進行配對的方法。但一直以來,都沒有形成什麼能夠穩定存在的物質。最常見的例子就是氦與其他元素的范德華力,無需共價鍵或者離子鍵就可以存在。在極低的溫度下,氦確實可以形成范德華力,但極其微弱,無法長久保持。
氦元素堅固的穩定力源於其閉殼層
電子組態 :其外殼層是完滿的狀態,沒有空間和其他原子通過共用電子進行結合。不過這是地球表面環境中的情況。
作為宇宙中第二豐富的元素,氦在恆星和巨型氣體行星的構成中起著重要作用。在外太空或者地球深處的極端條件下,它可能遵循著不同尋常的規律。如今,研究人員剛剛驗證這種奇異的現象。
猶他州立大學 的文章共同作者Alex Boldyrev說:“極高的壓力,比如在地球的核心或者其他巨型星體中,能夠完全改變氦的化學特性。”
研究人員通過“晶體結構預測”模型進行演算發現,在極度的壓力之下,一種穩定的氦鈉化合物能夠形成。然後他們在金剛石壓腔實驗中真的創造出了前所未見的化合物:Na2 He。實驗可以為氦和鈉原子提供相當於110萬倍地球大氣壓的條件。
這一結果太出人意料,因此發表的時候遇到了巨大的困難,研究人員花了兩年多的時間去說服審稿人和編輯。
基於這些結果,研究團隊預測,如果壓力達到他們實驗水平的一千萬倍,那么鈉將可以很容易地和氦氣反應生成穩定的Na2 He。更為奇妙的是,這種化合物的構成並不需要任何化學鍵。
南開大學
王慧田 教授是本次研究的共同通訊作者,據他介紹:“所發現的化合物非常奇特:氦原子通常不會形成任何化學鍵,而新物質的存在從根本上改變了鈉原子間的化學相互作用,迫使電子集中在該結構的立方空間內,同時具有絕緣能力。”
Na
2 He的晶體結構,由鈉原子(紫色)和氦原子(綠色)交替,共用電子(紅色)存在於其間的區域。
“這並不是真的化學鍵,”Popov說,“但是氦能夠使這一結構穩定存在。如果你把氦原子挪走,該結構將無法保持穩定。”
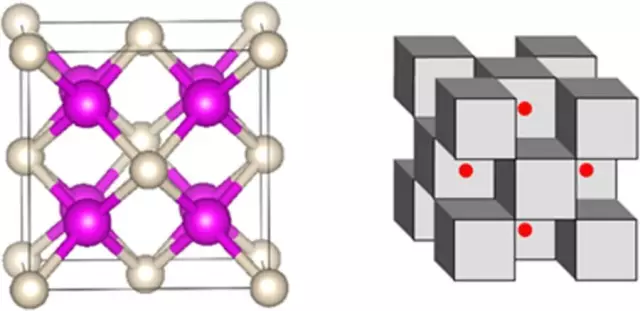
下面是該化合物的其他表現形式,左圖中粉色為鈉,白色為氦;右圖中鈉和氦成立方體狀,紅色的點則是電子。
亞晶格分析表明,He的占位導致電子被局域到了原子縫隙中並在Na原子核的引力下形成多中心鍵,從而整個體系變成了電子鹽體系。該過程中,孤立電子,Na的內層電子與He的內層1s電子和外層的2s,2p軌道產生強烈的交疊。受泡利不相容原理的影響,He的1s電子密度和外層電子軌道的分布被迫發生變化導致在Na2 He形成過程中He得到了0.15個電子。該工作證實了高壓下He會具有弱的化學活性能夠與在高壓下還原性顯著增強的Na形成化合物。
雖然最近關於金屬氫的突破研究遇到很大的質疑,但這篇文章的數據要紮實很多。來自倫敦帝國學院的物理學家Henry Rzepa在把這項研究和金屬氫的發現對比時表示:“這是更為可靠的科學,氦化合物是一項重大突破。”
這一研究涉及中、美、俄、意、德五國學者。參與的中國研究單位還有
北京高壓科學研究中心 、
西北工業大學 、中科院固態物理研究所和
南京大學 。特別值得一提的是,這一研究開始於南開大學研究生Xiao Dong在美國交換訪問期間,根據作者貢獻介紹,Xiao Dong設計了研究工作、並展開了相關計算。Xiao Dong目前已經在上海高壓科學研究中心工作。
據了解,這一工作2013年就投稿Nature,但作者與評審人就Na2 He成健性質無法達成一致,最後改投Nature Chemistry發表。當然,並不是所有人都被說服。愛丁堡大學Eugene Gregoryanz就認為XRD數據有待提高,最終還要看這一工作是否能被其他團隊所重複。不過,具備條件的實驗室全世界沒有幾家。
同位素 已知的氦同位素有八種,包括氦3、氦4、氦5、氦6、氦8等,但只有氦3和氦4是穩定的,其餘的均帶有放射性。在自然界中,氦同位素中以氦4占最多,多是從其他放射性物質的
α衰變 ,放出氦4原子核而來。而在地球上,氦3的含量極少,它們均是由超重氫(
氚 )的β衰變所產生。
氦-2 :它的原子核只有2個
質子 ,到目前為止只是
假想粒子 ,但如果
強核力 增強2%,它就有可能存在。
氦-5 ,是氦的
同位素 之一,元素符號為He。它的原子核由二顆質子和三顆
中子 所組成。並帶有放射性,會放出中子,其
半衰期 為0.6 MeV。
氦-6: 原子核 包含2個質子和4箇中子,非常不穩定。
氦-7: 原子核包含2個質子和5箇中子,會衰變成氦-6,非常不穩定。
氦-8: 原子核包含2個質子和6箇中子,非常不穩定。
氦-9: 原子核包含2個質子和7個
中子 ,非常不穩定。
氦-10: 原子核包含2個質子和8箇中子,非常不穩定。
符號 Z(p) N(n) 同位素質量(u) 半衰期 原子核自旋 相對豐度 相對豐度 的變化量 2 He
2
0
2.02946 #
0+ #(推測)
0
未知
3 He
2
1
3.0160293191(26)
穩定
1/2+
0.00000134(3)
4.6×10-10 -0.000041
4 He
2
2
4.002,603,254,15(6)
穩定
0+
0.99999866(3)
0.999959-1
5 He
2
3
5.01222(5)
700(30)E-24 s [0.60(2) MeV]
3/2-
6 He
2
4
6.0188891(8)
806.7(15) ms
0+
7 He
2
5
7.028021(18)
2.9(5)E-21 s [159(28) keV]
(3/2)-
8 He
2
6
8.033922(7)
119.0(15) ms
0+
9 He
2
7
9.04395(3)
7(4)E-21 s [100(60) keV]
1/2(-#)
10 He
2
8
10.05240(8)
2.7(18)E-21 s [0.17(11) MeV]
0+
備註: 畫上#號的數據代表沒有經過實驗的證明,只是理論推測而已,而用括弧括起來的代表數據不確定性。
製取方法 天然氣分離法:工業上,主要以含有氦的天然氣為原料,反覆進行液化
分餾 ,然後利用活性炭進行吸附提純,得到
純氦 。
合成氨 法:在合成
氨 中,從尾氣經
分離提純 可得氦。
空氣分餾法:從液態空氣中用
分餾法 從氖氦混合氣中提出。
鈾礦石 法:將含氦的鈾礦石經過焙燒,分離出氣體,再經過化學方法,除去
水蒸氣 、氫氣和二氧化碳等雜質提純出氦。
作用用途 由於氦很輕,而且不易燃,因此它可用於填充
飛艇 、氣球、
溫度計 、
電子管 、潛水服等。也可用於原子反應堆和加速器、雷射器、火箭、冶煉和焊接時的
保護氣體 ,還可用來填充燈泡和霓虹燈管,也用來製造泡沫塑膠。
氦氖雷射治療儀 用途 由於氦在血液中的溶解度很低,因此可以加到氧氣中防止
減壓病 ,作為
潛水員 的呼吸用氣體,或用於治療氣喘和窒息。
液體氦的溫度(-268.93 ℃)接近
絕對零度 (-273℃),因此它在超導研究中用作
超流體 ,製造超導材料。液態氦還常用做冷卻劑和製冷劑。在醫學中,用於
氬氦刀 以治療癌症。它還可以用作人造大氣層和鐳射媒體的組成部分。
危險性 引起窒息 如果大量吸入氦氣,會造成體內氧氣被氦取代,因而發生缺氧(呼吸反射是受體內過量二氧化碳驅動,而對缺氧並不敏感),嚴重的甚至會死亡。 另外,如果是由高壓氣瓶中直接吸入氦氣,那么其高流速就會嚴重地破壞肺部組織。大量而高壓的氦和氧會造成高壓緊張症狀High pressure nervous syndrome (HPNS),不過少量的氮就能夠處理這個問題。而空氣中百分之七十八都是氮氣,所以不用擔心。據介紹,大量及長時間吸入氦氣可導致腦損傷甚至死亡。在大部分薯條類包裝袋裡也含有少量氦氣,不過不必擔心,沒有危害。
安全事項-氦氣瓶 壓力通常有15MPa,使用時套用YQY-12或152IN-125等減壓器減壓後使用,使用前套用肥皂水檢漏氣體管道,確保氣體管道不漏氣。
確保氦氣不泄露、工作場所保持通風。
包裝的氣瓶上均應記上生產日期、包括使用年限,凡到期的氣瓶必須送往有部門進行安全檢驗,方能繼續使用。
每瓶氦氣在使用到尾氣時,應保留瓶內余壓在0.5MPa,最小不得低於0.25MPa余壓,應將瓶閥關閉,以保證氣體質量和使用安全。
瓶裝氦氣在運輸儲存、使用時都應分類堆放。
不準靠近明火和熱源,應做到勿近火、勿沾油臘、勿爆曬、勿重拋、勿撞擊,嚴禁在氣瓶身上進行引弧或電弧。
嚴禁野蠻裝卸,短距離移動氦氣鋼瓶應使用鋼瓶專用手推車,長距離移動鋼瓶套用危險品運輸車輛運輸。
液氦的溫度為-268.9℃,與皮膚接觸能引起嚴重凍傷。
氦氣對人體的不良反應 當身體內的氦氣含量增加導致氧氣含量低於19.5%時,患者先出現呼吸加快、注意力不集中、共濟失調;繼之出現疲倦無力、煩躁不安、噁心、嘔吐、昏迷、抽搐,以致死亡。
 威廉·拉姆塞
威廉·拉姆塞 氦的原子光譜
氦的原子光譜 通電發光後的氦氣
通電發光後的氦氣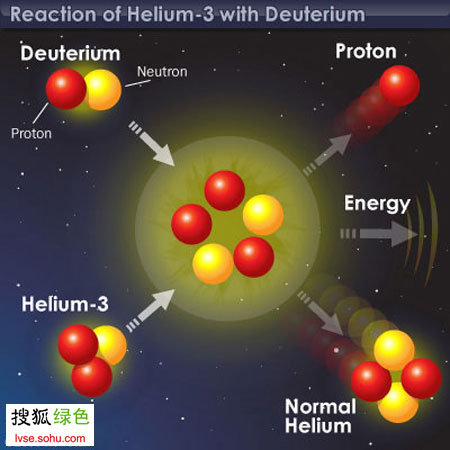 氦-3
氦-3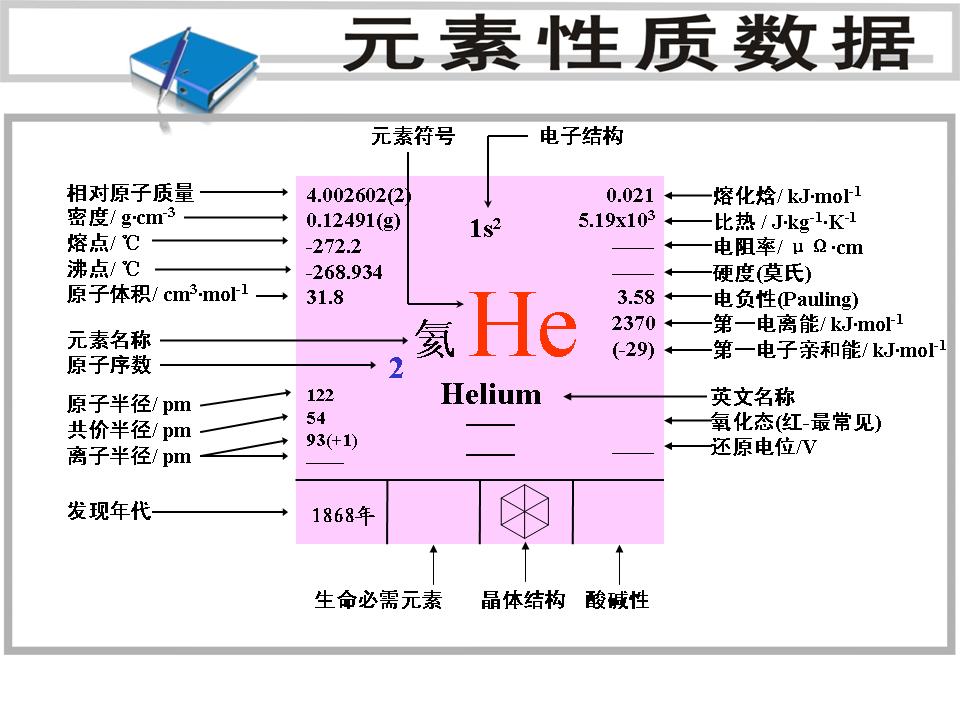 元素周期性質
元素周期性質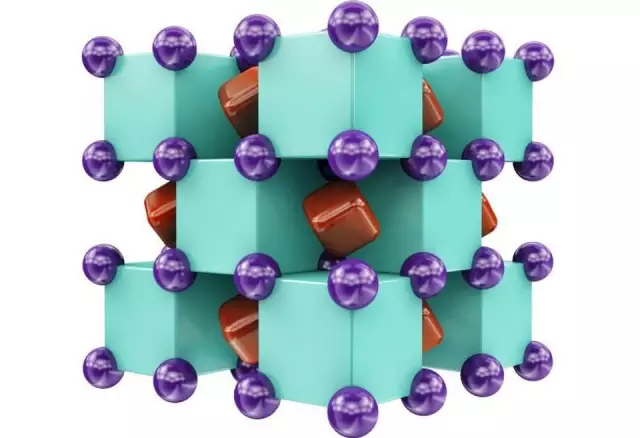
 氦氖雷射治療儀
氦氖雷射治療儀 用途
用途
