研究歷史,物理性質,化學性質,共價化合物,離子型氫化物,質子與質子酸,可燃性,同素異形體,安全性,套用領域,氫氣生物學效應,工業用途,醫學用途,燃料套用,行業套用,製取方法,實驗室製取,工業製作法,原始製作法,新型制氫,其他制氫反應,檢測方法,儀器,測定條件,測定步驟,純氫測定,參考選項,純度參考,產品原料,包裝運輸,注意事項,常見謠言,
研究歷史
1766年由卡文迪許(H.Cavendish)在英國發現。
 發光的超級氫
發光的超級氫在
化學史上,人們把氫元素的發現與“發現和證明了水是氫和
氧的
化合物而非元素”這兩項重大成就,主要歸功於英國
化學家和
物理學家卡文迪許(Cavendish,H.1731-1810)。
在化學史上,有一個與這些論文稿有關的有趣的故事。卡文迪許1785年做過一個實驗,他將電火花通過尋常
空氣和
氧氣的混合體,想把其中的
氮全部氧化掉,產生的
二氧化氮用苛性鉀吸收。實驗做了三個星期,最後殘留下一小氣泡不能被氧化。他的實驗記錄保存在留下的文稿中,後面寫道:“空氣中的濁氣不是單一的物質(
氮氣),還有一種不與脫
燃素空氣(氧)化合的濁氣,總量不超過全部空氣的1/12.一百多年後,1892年,英國劍橋大學的物理學家
瑞利(Ragleigh,L.1842-1919)測定
氮的密度時,發現從空氣得來的氮比從氨
氧化分解產生的氮每升重0.0064克,百思不得其解。化學家萊姆塞(Ramsay,W.1852-1916)認為來自空氣的氮氣裡面能含有一種較重的未知氣體。這時,化學教授
杜瓦(Duvel,J.1842-1923)向他們提到劍橋大學的老前輩卡文迪許的上述實驗和小氣泡之謎。他們立即把卡文迪許的科學資料借來閱讀,
瑞利重複了卡文迪許當年的實驗,很快得到了小氣泡。萊姆塞設計了一個新的實驗,除去空氣中的
水蒸氣、二氧化碳、
氧氣和
氮氣後,也得到了這種氣體,密度比氮氣大,用
分光鏡檢查後,肯定這是一種新的元素,取名氬。這樣,卡文迪許當年的工作在1894年元素氬的發現中起了重要作用。從這個故事可看出卡文迪許嚴謹的科研作風和他對化學的重大貢獻。1871年,劍橋大學建立了一座物理實驗室,以卡文迪許的名字命名,這就是著名的卡文迪許實驗室,它在幾十年內,一直是世界現代物理學的一個重要研究中心。
在18世紀末以前,曾經有不少人做過製取氫氣的實驗,所以實際上很難說是誰發現了氫,即使公認對氫的發現和研究有過很大貢獻的卡文迪許本人也認為氫的發現不只是他的功勞。早在16世紀,瑞士著名醫生帕拉塞斯就描述過
鐵屑與酸接觸時有一種氣體產生;17世紀時,比利時著名的醫療化學派學者
海爾蒙特(van Helmont,J.B.1579-1644)曾偶然接觸過這種氣體,但沒有把它
離析、收集起來;
波義耳雖偶然收集過這種氣體,但並未進行研究。他們只知道它可燃,此外就很少了解;1700年,法國藥劑師勒梅里(Lemery,N.1645-1715)在巴黎科學院的《報告》上也提到過它。
但是,最早把氫氣收集起來,並對它的性質仔細加以研究的是卡文迪許。
1766年卡文迪許向英國皇家學會提交了一篇研究報告《人造空氣實驗》,講了他用鐵、鋅等與
稀硫酸、
稀鹽酸作用製得“易燃空氣”(即氫氣),並用
普利斯特里發明的排水集氣法把它收集起來,進行研究。他發現一定量的某種金屬分別與足量的各種酸作用,所產生的這種氣體的量是固定的,與酸的種類、濃度都無關。他還發現氫氣與空氣混合後點燃會發生爆炸;又發現氫氣與
氧氣化合生成水,從而認識到這種氣體和其它已知的各種氣體都不同。但是,由於他是
燃素說的虔誠信徒,按照他的理解:這種氣體燃燒起來這么猛烈,一定富含燃素;硫磺燃燒後成為硫酸,那么硫酸中是沒有燃素的;而按照燃素說金屬也是含燃素的。所以他認為這種氣體是從金屬中分解出來的,而不是來自酸中。他構想金屬在酸中溶解時,“它們所含的燃素便釋放出來,形成了這種可燃空氣”。他甚至曾一度構想氫氣就是
燃素,這種推測很快就得以當時的一些傑出化學家舍勒、基爾萬(Kirwan,R.1735-1812)等的贊同。由於把氫氣充到氣球中,氣球便會徐徐上升,這種現象當時曾被一些
燃素學說的信奉者們用來作為他們“論證”燃素具有負重量的根據。但卡文迪許究竟是一位非凡的科學家,後來他弄清楚了氣球在空氣中所受浮力問題,通過精確研究,證明氫氣是有重量的,只是比空氣輕很多。他是這樣做實驗的:先把金屬和裝有酸的燒瓶稱重,然後將金屬投入酸中,用
排水集氣法收集氫氣並測體積,再稱量反應後燒瓶及內裝物的總量。這樣他確定了氫氣的比重只是空氣的9%.但這些化學家仍不肯輕易放棄舊說,鑒於氫氣燃燒後會產生水,於是他們改說氫氣是
燃素和水的化合物。
水的合成否定了水是元素的錯誤觀念,在古希臘:
恩培多克勒提出,
宇宙間只存在
火、氣、
水、土四種元素,它們組成萬物。從那時起直到18世紀70年代,人們一直認為水是一種元素。1781年,普利斯特里將氫氣和空氣放在閉口玻璃瓶中,用電火花引爆,發現瓶的內壁有露珠出現。同年卡文迪許也用不同比例的氫氣與空氣的混合物反覆進行這項實驗,確認這種露滴是純淨的水,表明氫是水的一種成分。這時
氧氣也已發現,卡文迪許又用純氧代替空氣進行試驗,不僅證明氫和氧化合成水,而且確認大約2份體積的氫與1份體積的氧恰好化合成水(發表於1784年)。這些實驗結果本已毫無異議地證明了水是氫和氧的化合物,而不是一種元素,但卡文迪許卻和普利斯特里一樣,仍堅持認為水是一種元素,氧是失去
燃素的水,氫則是含有過多燃素的水。他用下式表示“易燃空氣”(氫)的燃燒:
(水+燃素)+ (水-燃素)→水
易燃空氣(氫) 失燃素空氣(氧)
1782年,
拉瓦錫重複了他們的實驗,並用紅熱的槍筒分解了
水蒸氣,明確提出正確的結論:水不是元素而是氫和氧的化合物,糾正了兩千多年來把水當做元素的錯誤概念。1787年,他把過去稱作“易燃空氣”的這種氣體命名為“Hydrogen”(氫),意思是“產生水的”,並確認它是一種
元素。
物理性質
氫氣是無色並且密度比空氣小的氣體(在各種氣體中,氫氣的密度最小。標準狀況下,1升氫氣的質量是0.0899克,相同體積比空氣輕得多)。因為氫氣難溶於水,所以可以用
排水集氣法收集氫氣。另外,在101千帕壓強下,溫度-252.87 ℃時,氫氣可轉變成淡藍色的液體;-259.1 ℃時,變成雪狀固體。
常溫下,氫氣的性質很穩定,不容易跟其它物質發生
化學反應。但當條件改變時(如點燃、加熱、使用催化劑等),情況就不同了。如氫氣被鈀或鉑等金屬吸附後具有較強的活性(特別是被鈀吸附)。金屬鈀對氫氣的吸附作用最強。當空氣中的
體積分數為4%-75%時,遇到火源,可引起爆炸。
氫氣是無色無味的氣體,標準狀況下密度是0.09克/升(最輕的氣體),難溶於水。在-252 ℃,變成無色液體,-259 ℃時變為雪花狀固體。
| -252.77 ℃(20.38 K) | | -259.2 ℃ |
| 0.0899 g/L | 氣液容積比 | 974 L/L(15℃,100kPa) |
| 2.0157 | | -234.8 ℃ |
生產方法 | 電解水、裂解、煤制氣等 | | 1664.8 kPa |
| -254.4 ℃ | 空氣中的燃燒界限 | 5%~75%(體積) |
熔化熱 | 48.84 kJ/kg(-254.5℃,平衡態) | | 3.72 mN/m(平衡態,-252。8℃) |
熱值 | 1.4*10^8 J/kg(2.82*10^5 J/mol) | | 1.0001265(101.325kPa,25℃) |
比熱比 | Cp/Cv=1.40(101.325kPa,25℃,氣體) | 易燃性級別 | 4 |
易爆性級別 | 1 | 毒性級別 | 0 |
汽化熱:305 kJ/kg(△Hv ,-249.5℃)
臨界密度:66.8 kg/m3
氣體密度:0.0899 kg/m3(101.325kPa,0℃)
比容:11.12 m3/kg(101.325kPa,21.2℃)
導熱係數:
0.1289 w/(m·K)(氣體101.325 kPa,0 ℃)、1264 W/(m·K)(液體,-252.8 ℃)
比熱容:
Cp=14.30 kJ/(kg·K),
Cv=10.21 kJ/(kg·K)(101.325kPa,25℃,氣體)
蒸氣壓力:
10.67 kPa(正常態,17.703)
53.33 kPa(正常態,21.621)
119.99 kPa(正常態,24.249 K)
粘度:
0.010 lmPa·S(氣體,正常態)
101.325 kPa (0 ℃)
0.040 mPa·s(液體,平衡態,-252.8 ℃)
重氫在常溫常壓下為無色無嗅無毒可燃性氣體,是普通氫的一種穩定同位素。它在通常水的氫中含0.0139%~0.0157%。其化學性質與普通氫完全相同。但質量大些,
反應速度小一些。
化學性質
氫氣常溫下性質穩定,在點燃或加熱的條件下能多跟許多物質發生化學反應。
①可燃性(可在氧氣中或氯氣中燃燒):2H2+O2=點燃=2H2O(化合反應)
(點燃不純的氫氣要發生爆炸,點燃氫氣前必須驗純,相似的,氘(重氫)在氧氣中點燃可以生成重水(D2O))
H2+Cl2=點燃=2HCl(化合反應)
H2+F2=2HF(氫氣與氟氣混合立刻爆炸,生成氟化氫氣體)
②還原性(使某些金屬氧化物還原)
3H2+Fe2O3=高溫=2Fe+3H2O(置換反應)
共價化合物
雖然氫氣在通常狀態下不是非常活潑,但氫元素與絕大多數元素能組成化合物。
碳氫化合物已知有數以百萬種,但它們無法由氫氣和碳直接
化合得到。氫氣與電負性較強的元素(如
鹵素)反應,在這些化合物中氫的氧化態為+1。
氫與
氟、
氧、
氮成鍵時,可生成一種較強的非
共價的鍵,稱為
氫鍵。氫鍵對許多生物分子具有重要意義。 氫也與電負性較低的元素(如活潑金屬)生成化合物,這時氫的氧化態通常為 -1,這樣的化合物稱為
氫化物。
氫與碳形成的化合物,由於其與生物的關係,通常被稱為
有機物,研究有機物的學科稱為
有機化學,而研究有機物在生物中所起的作用的科學稱為
生物化學。按某些定義,“有機”只要求含有碳。但大多數含碳的化合物通常都含有氫。這些化合物的獨特性質主要是由碳氫鍵決定的。故有時有機物的定義要求物質含有碳氫鍵。
無機化學中,H
- 可以作為橋接配體,連線配合物中的兩個金屬原子。這樣的特性通常在13族元素中體現,尤以
硼烷、鋁配合物和碳硼烷中。
離子型氫化物
含有氫元素的離子化合物稱離子型氫化物。“氫化物”一詞暗含氫顯負價,且其氧化態為-1的意思。氫負離子記做H-,其存在是1916年由吉爾伯特·路易斯預言的。1920年Moers用電解氫化鋰,在陽極產生氫氣,從而證明了離子型氫化物的存在。
質子與質子酸
對氫原子的氧化,也即讓氫原子失去其電子,即可得到H+(氫離子)。氫離子不含電子,由於氫原子通常不含中子,故氫離子通常只含1個質子。這也就是為什麼常將H+直接稱為質子的原因。H+是酸鹼理論的重要離子。
裸露的質子H+不能直接在溶液或離子晶體中存在,這是由氫離子和其他原子、分子不可抗拒的吸引力造成的。除非在等離子態物質中,氫離子不會脫離分子或原子的電子云。但是,“質子”或“氫離子”這個概念有時也指帶有一個質子的其他粒子,通常也記做“H+”。
為了避免認為溶液中存在孤立的氫離子,一般在水溶液中將水和氫離子構成的離子稱為水合氫離子(H3O+)。但這也只是一種理想化的情形。氫離子在水溶液中事實上以類似於H9O4+的形式存在。
儘管在地球上少見,H3+離子(質子化分子氫)卻是宇宙中最常見的離子之一。
可燃性
 氫氣燃燒
氫氣燃燒氫氣是一種極易燃的氣體,燃點只有574℃,在空氣中的體積分數為4%至75%時都能燃燒。氫氣燃燒的焓變為−286 kJ/mol:
2 H2(g) + O2(g) → 2 H2O(l); ΔH = -572 kJ/mol
氫氣占4.1%至74.8%的濃度時與空氣混合,或占18.3%至59激下易引爆。氫氣的著火點為500 °C。純淨的氫氣與氧氣的混合物燃燒時放出紫外線。
因為氫氣比空氣輕,所以氫氣的火焰傾向於快速上升,故其造成的危害小於碳氫化合物燃燒的危害。氫氣與所有的氧化性元素單質反應。氫氣在常溫下可自發的和氯氣(需要光照)反應 ,氫氣和氟氣在冷暗處混合就可爆炸,生成具有潛在危險性的酸氯化氫或氟化氫。
在帶尖嘴的導管口點燃純淨的氫氣,觀察火焰的顏色。然後在火焰上方罩一個冷而乾燥的燒杯,過一會兒,我們可以看到,純淨的氫氣在空氣里安靜地燃燒,產生淡藍色的火焰(氫氣在玻璃導管口燃燒時,火焰常略帶黃色)。用燒杯罩在火焰的上方時,燒杯壁上有水珠生成,接觸燒杯的手能感到發燙。
氫氣在空氣里燃燒,實際上是氫氣跟空氣里的氧氣發生了化合反應,生成了水並放出大量的熱。這個反應的化學方程式是:
2H2+O2=點燃=2H2O
反過來,氫氣可以用電解水的方式製備。這個反應的化學方程式是:
H2O=H++OH-
H++e-=H
2H=H2
OH--e-=OH
2OH=H2O2
2H2O2=2H2O+O2
總的化學方程式是:2H2O=通電=2H2↑+O2↑
取一個一端開口,另一端鑽有小孔的紙筒(或塑膠筒等),用紙團堵住小孔,用向下排空氣法收集氫氣,使紙筒內充滿氫氣。把氫氣發生裝置移開,拿掉堵小孔的紙團,用燃著的木條在小孔處點火,注意有什麼現象發生。(做這個實驗時,人要離得遠些,注意安全。)
我們可以看到,剛點燃時,氫氣在小孔處安靜地燃燒,過一小會兒,突然聽到“砰”的一聲響,爆炸的氣浪把紙筒頂部高高炸起。
實驗測定,空氣里如果混入氫氣的體積達到總體積的4%~74.2%,點燃時就會發生爆炸。這個範圍叫做氫氣的爆炸極限。實際上,任何可燃氣體或可燃的粉塵如果跟空氣充分混合,遇火時都有可能發生爆炸。因此,當可燃性氣體(如氫氣、液化石油氣、煤氣等)發生泄漏時,應杜絕一切火源、火星,禁止產生電火花,以防發生爆炸。
正是由於這個原因,我們在使用氫氣時,要特別注意安全。點燃氫氣前,一定要檢驗氫氣的純度。
用排水法收集一試管氫氣,管口朝下,用拇指堵住,試管口移近火焰,移開拇指點火,如果聽到尖銳的爆鳴聲,就表明氫氣不純,需要再收集,再檢驗,直到響聲很小,只有“撲”的一聲或幾乎無聲才表明氫氣已較為純淨,可以安全進行實驗。如果用向下排空氣法收集氫氣,經檢驗不純而需要再檢驗時,應該用拇指堵住試管口一會兒,然後再收集氫氣檢驗純度,否則會發生爆炸的危險。因為剛檢驗過純度的試管內,氫氣火焰可能還沒有熄滅,如果立刻就用這個試管去收集氫氣,氫氣火焰可能會點燃氫氣發生器里尚混有空氣的氫氣,使氫氣發生器發生爆炸。用拇指堵住試管口一會兒,就使試管內未熄滅的氫氣火焰因缺氧氣而熄滅。
另外氫氣在氧氣過量和低溫有催化劑的條件下點燃可生成過氧化氫(H2O2)(過氧化物中氧元素的化合價為-1)
同素異形體
氫3:H3分子是由H2結合一個氫原子(H)而形成,和臭氧O3一樣,由O2和一個氧原子結合構成,可寫為(O2.O),H3分子亦可寫為(H2.H),有三中心三電子鍵.它非常不穩定,存在時間為微秒級,很快轉化為氫氣.其分子構型為V型.是一種由三個氫原子構成的不穩定分子.這種中性的分子可以在低壓放電管中製備.這種分子只能以激發態存在.激發態的壽命為700納秒.如果分子失去能量並回到低能級,它將迅速自動分解能量最低的介穩態,能量為-3.777
eV,比H3+和e-狀態低,但是只能存在大約1皮秒.最穩定的狀態可能是三氫陽離子獲得一個離域電子.
金屬態氫:2016年1月英國科學家在愛丁堡大學成功制出金屬態氫。
安全性
若燃燒時有尖銳的爆鳴聲,則說明氫氣不純;極易發生爆炸,所以對此須引起足夠的重視。
如果發生氫氣泄露,處理辦法是:迅速撤離泄漏污染區人員至上風處,並進行隔離,嚴格限制出入。切斷火源。建議應急處理人員戴自給正壓式呼吸器,穿消防防護服。儘可能切斷泄漏源。合理通風,加速擴散。如有可能,將漏出氣用排風機送至空曠地方或裝設適當噴頭燒掉。漏氣容器要妥善處理,修復、檢驗後再用。滅火方法:切斷氣源。若不能立即切斷氣源,則不允許熄滅正在燃燒的氣體。噴水冷卻容器,可能的話將容器從火場移至空曠處。滅火劑:霧狀水、泡沫、二氧化碳、乾粉。
套用領域
氫氣生物學效應
早在1975年就有人開展了氫氣治療腫瘤的研究,後來2001年才有法國學者將高壓氫用於治療肝臟寄生蟲感染的研究。早期的研究只能簡單地觀察氫氣被動物呼吸後的反應,顯然觀察結果證明氫氣對動物沒有產生顯著的影響。關於氫氣的生物學效應,最熱鬧地當然屬於潛水醫學,因為氫氣作為人類潛水呼吸的氣體被國際許多重要的潛水醫學研究單位深入研究,作為呼吸氣體的最重要前提是該氣體的安全性,就是不能對人體產生明顯的影響,包括在極端高壓下呼吸這種氣體。許多年的潛水醫學研究證明呼吸氫氣是非常安全的,但也同時給人們一種深刻印象,呼吸氫氣對人體是沒有明顯生物學效應的。2007年日本學者報導,動物呼吸2%的氫可有效清除強毒性自由基,顯著改善腦缺血再灌注損傷,採用化學反應、細胞學手段證明,氫溶解在液體中可選擇性中和羥自由基和亞硝酸陰離子。而後兩者是氧化損傷的最重要介質,體內缺乏他們的清除機制,是多種疾病發生的重要基礎。隨後他們又用肝缺血和心肌缺血動物模型,證明呼吸2%的氫可以治療肝和心肌缺血再灌注損傷。採用飲用飽和氫水可治療應激引起的神經損傷和基因缺陷氧化應激動物的慢性氧化損傷。美國匹茲堡大學器官移植中心學者Nakao等隨後證明,呼吸2%的氫可以治療小腸移植引起的炎症損傷,飲用飽和氫水可治療心臟移植後心肌損傷、腎臟移植後慢性腎病。國內第四軍醫大學謝克亮等的研究證明,呼吸氫氣能治療動物系統炎症、多器官功能衰竭和急性顱腦損傷。孫學軍等的研究也證明,呼吸2%的氫可以治療新生兒腦缺血缺氧損傷。隨後,孫學軍等成功製備了飽和氫注射液,並與國內40多家實驗室開展合作,先後發現該注射液對疼痛、關節炎、急性胰腺炎、老年性痴呆、慢性氧中毒、一氧化碳中毒遲發性腦病、肝硬化、脂肪肝、脊髓創傷、慢性低氧、腹膜炎、結腸炎、新生兒腦缺血缺氧損傷、心肌缺血再灌注損傷、腎缺血再灌注損傷和小腸缺血再灌注損傷等具有良好的治療作用。這些研究說明,氫是一種理想的自由基、特別是毒性自由基的良好清除劑,具有潛在的臨床套用前景。
工業用途
1.氫是主要的工業原料,也是最重要的工業氣體和特種氣體,在石油化工、電子工業、冶金工業、食品加工、浮法玻璃、精細有機合成、航空航天等方面有著廣泛的套用。同時,氫也是一種理想的二次能源( 二次能源是指必須由一種初級能源如太陽能、煤炭等來製取的能源)。在一般情況下,氫極易與氧結合。這種特性使其成為天然的還原劑使用於防止出現氧化的生產中。在玻璃製造的高溫加工過程及電子微晶片的製造中,在氮氣保護氣中加入氫以去除殘餘的氧。在石化工業中,需加氫通過去硫和氫化裂解來提煉原油。氫的另一個重要的用途是對人造黃油、食用油、洗髮精、潤滑劑、家庭清潔劑及其它產品中的脂肪氫化。由於氫的高燃料性,航天工業使用液氫作為燃料。
2.用作合成氨、合成甲醇、合成鹽酸的原料,冶金用還原劑,石油煉製中加氫脫硫劑等
醫學用途
一、氫氣治療疾病的概況
2007年,Ohsawa的關於氫氣選擇性抗氧化和對大鼠腦缺血治療作用的報導是該領域具有開創意義的工作。雖然早在1975年和2001年就有關於氫氣抗氧化的報導,但2001年是研究呼吸800 kpa氫氣14天的效應,而2007年報導是呼吸2kpa氫氣不足1小時的效應,兩者分壓相差400倍,呼吸時間相差600倍,所以這絕對是完全不同性質的工作。該研究將大鼠中動脈臨時阻斷90分鐘(將一根縫合線插到大腦中動脈起始段),然後再灌流,這是經典的腦中風動物模型,類似腦缺血後再恢復血流的情況。在恢復血液供應前5分鐘開始給動物呼吸含氫氣1、2、4%的混合氣體35分鐘,結果發現動物腦組織壞死體積非常顯著地減少。日本學者將這種作用歸因於氫氣可以選擇性中和羥基自由基(羥基自由基是生物體毒性最強的自由基),儘管氫氣也可以中和亞硝酸陰離子,但作用比較弱。該文章發表後,迅速引起國際上的廣泛關注,大批臨床和基礎醫學學者迅速跟進,至2014年已經有63個疾病類型被證明可以被氫氣有效治療。每年氫氣生物學文章數量,如2007年3篇、2008年15篇、2009年26篇、2010年50篇、2011年63篇、2012年95篇,呈現爆發式增長。氫氣的分子效應可在多種組織和疾病存在,例如大腦、脊髓、眼、耳、肺、心、肝、腎、胰腺、小腸、血管、肌肉、軟骨、代謝系統、圍產期疾病和炎症等。在上述這些器官、組織和疾病狀態中,氫氣對器官缺血再灌注損傷和炎症相關疾病的治療效果最顯著,有4篇文章涉及到惡性腫瘤。
二、氫氣治療疾病的病理生理學機制
關於氫氣治療疾病病理生理學機制主流觀點仍是氫氣的選擇性抗氧化,在選擇性抗氧化基礎上,人們相繼證明氫氣對各類疾病過程中的氧化損傷,炎症反應、細胞凋亡和血管異常增生等具有治療作用。活性氧在各類心腦血管疾病如中風和心肌梗死、代謝性疾病如糖尿病動脈硬化等人類重要急性和慢性疾病的病理生理進程中扮演了重要角色,它是分子氧在還原過程中的中間產物,包括以氧自由基形式存在和非氧自由基形式存在的兩大類物質,其中氧自由基又包括羥自由基、超氧陰離子、一氧化氮、亞硝酸陰離子等物質。生理情況下,活性氧在體內不斷產生,也不斷被清除,處於動態平衡。但在缺血、炎症等病理狀態下,機體將產生大量的活性氧。其中,羥自由基和過氧亞硝基陰離子毒性較強,是細胞氧化損傷的主要介質。而一氧化氮、超氧陰離子和過氧化氫等物質毒性較弱,具有重要的信號轉導作用。既往在抗氧化損傷的治療中,還原性過強的藥物可能導致機體氧化- 還原狀態出現新的失衡。2007 年Ohsawa等人研究證實,氫氣能夠選擇性清除毒性較強的羥自由基和亞硝酸陰離子,而對其它具有重要生物學功能、毒性較低的活性氧影響不大,此即氫氣的選擇性抗氧化作用。該作用為抗氧化治療提供了新的思路。早在2001 年,Gharib等人報導吸入8 個大氣壓的氫氣對肝臟血吸蟲感染引起的炎症反應具有治療作用,他們認為氫氣與羥自由基直接反應是氫氣抗炎作用的基礎。2009 年Kajiya等人報導氫氣能明顯抑制葡聚糖硫酸鈉誘發的結腸炎症反應,減少受損結腸的炎症因子水平,減輕炎症的病理損傷,改善預後。氫氣的抗炎作用與其抑制活性氧產生、中和羥自由基、抑制促炎因子釋放有關。另外,巨噬細胞在炎症反應和免疫調節中起重要作用,氫氣對巨噬細胞的調節為其抗炎作用奠定了基礎。孫學軍等2008 年的研究發現,氫氣能減少大鼠缺血缺氧模型的組織損傷,呼吸低濃度的氫氣可時間依賴性地減少凋亡酶Caspase-3和Caspase-12 的活性,減少凋亡陽性細胞數量,研究提示氫氣的作用與減少Caspase 依賴性凋亡有關。Kubota等報導使用含氫氣的水滴眼具有抗角膜血管增生的作用。
三、氫氣對中樞神經系統疾病的治療作用
氫氣生物學效應發現以來,氫氣對以腦血管疾病為代表和以老年性痴呆為代表的中樞神經系統疾功能紊亂都具有明顯的保護作用。
氫氣對腦血管病的治療作用
Ohsawa等2007年報導的呼吸氫氣對大鼠左大腦中動脈阻斷模型的治療作用後。孫學軍等很快證明呼吸氫氣對新生兒窒息引起的缺血缺氧性腦損傷具有理想的治療作用,發現氫氣對缺血缺氧性腦損傷後神經細胞凋亡酶活性有抑制作用,凋亡酶活性下降導致神經細胞凋亡減少,使神經細胞壞死減少。從而減輕了腦損傷,保護了成年後的腦功能。氫氣對心臟停跳引起的腦損傷具有保護作用,這進一步肯定了氫氣對缺血缺氧性腦損傷的保護作用。衣達拉奉是被批准用於中風治療的抗氧化藥物,和單純使用衣達拉奉相比,氫氣聯合使用衣達拉奉上述核磁共振檢測指標均獲得更好的改善。美國Loma Linda神經外科研究所和南京醫科大學、浙江大學附屬醫院神經外科等三家實驗室先後報導氫氣呼吸和注射氫氣生理鹽水對腦出血和珠網膜下腔出血引起的早期腦損傷、神經細胞壞死、腦水腫和血管痙攣等具有理想的保護作用。
氫氣對神經退行性疾病的治療作用
巴金森病是腦幹神經核黑質內多巴胺神經元死亡引起的疾病,經常是許多其他神經退行性疾病如老年性痴呆的繼發表現。孫學軍等在模型製備前1周開始給動物隨意飲用氫氣飽和水,結果發現該治療可完全消除單側巴金森病症狀的發生。非治療組動物注射側多巴胺神經元數量比對照側減少到40.2%,而治療組僅減少到83%。即使在模型製備後3天開始給氫氣水治療,單側巴金森病症狀仍可以被抑制,但治療效果低於預先治療,神經元數量比對照側減少到76.3%。預先治療組動物在模型製備後48小時,紋狀體內代表多巴胺神經元末梢的酪氨酸羥化酶活性在模型對照組和治療組均顯著下降。Fujita等用MPTP誘導的小鼠巴金森病模型證明氫氣具有類似效應。研究結果表明,和其他如銀杏葉比較,氫氣具有更理想的治療效果。
四、氫氣對肝臟病的治療作用
氫氣在肝臟領域的套用研究十分突出,是早在2001年,法國潛水醫學領域就有學者希望證明氫氣的抗氧化作用,在馬賽法國著名飽和潛水設備公司COMEX SA的設備、技術和人員幫助下,他們開展了這一研究。讓感染了肝日本曼氏血吸蟲病的小鼠連續14天呼吸氫氧混合氣(氫氣濃度為87.5%,分壓為0.7 Mpa),觀察對小鼠肝臟功能、肝組織氧化損傷、纖維化和血液炎症反應等方面的影響,研究結果證明,連續呼吸高壓氫氣對肝臟血吸蟲病動物的肝組織損傷、炎症反應和後期的肝纖維化均有非常顯著的保護作用。Fukuda 等在2007 年製作了大鼠肝臟缺血再灌注的模型,通過對組織標本的HE 染色加MDA 加肝功能酶學檢測,發現氫氣療法對肝臟的缺血損傷有非常明顯的治療效果。2009 年時,哈佛大學口腔醫院的學者Kajiya 等在實驗中讓大老鼠喝下能產生氫氣的細菌,發現對伴刀豆球蛋白誘導的肝炎具有預防作用,如果用抗生素殺滅這些細菌,則抗肝炎的作用消失,這顯示了氫氣對肝炎的預防與治療作用。他們還證明,飲用氫氣飽和水對伴刀豆球蛋白誘導的肝炎具有類似的治療效果。同年,Tsai 等發現飲用富氫電解水可以保護小鼠四氯化碳誘導的肝臟損傷。中國學者孫漢勇等採用GalN/LPS,CCl4 和DEN 3 種肝損傷動物模型,通過檢測氫氣、活性氧水平,評價氧化損傷、細胞凋亡和炎性反應程度,發現腹腔注射氫氣生理鹽水對急性肝臟損傷、肝纖維化和肝臟細胞增生均具有顯著的抑制作用,同時細胞碉亡相關分子如JNK和caspase-3 活性下降,研究結果證明氫氣不僅能治療急性肝臟損傷,而且能治療肝硬化。劉渠等研究認為,腹腔注射氫氣生理鹽水通過提高肝臟抗氧化能力,抑制肝臟炎性反應能治療膽管阻塞後黃疸和肝損傷,這對臨床上的指導意義很大。對非酒精性脂肪肝的研究證明,長時間飲用氫氣水可以對抗高脂飲食引起的脂肪肝,不僅對肝臟功能、肝形態學如纖維化,而且對脂肪肝相關細胞內信號通路均有明顯的阻斷效應,該效果可以和傳統的治療脂肪肝的藥物吡格列酮(促進胰島素受體敏感性,降血脂)治療效果相嫣美。長期飲用氫氣水不僅可以對抗脂肪肝,而且可以顯著減少這種脂肪肝晚期轉化成肝癌的比例,也就是說可以減少脂肪肝發生肝癌的可能性。氫氣可以通過促進一種重要的信號分子FGF 21發揮減肥和治療脂肪肝的效果。氫氣在肝臟疾病的臨床研究十分缺乏,2012年韓國學者Kang 等對49例接受放射治療的惡性肝癌病人,採用隨機安慰劑對照方法,給病人在放射治療期間飲用一定量的金屬鎂製備的氫氣水,通過對生活質量進行評價,發現該氫氣水可顯著提高肝癌病人放射治療後的生活量,同時可以降低血液中氧化應激指標。氫氣作為一種選擇性抗氧化物質,氫對肝臟缺血、藥物性肝炎、膽管阻塞引起的肝硬化、脂肪肝等多種類型的肝臟疾病具有有效和明顯的治療作用。
五、氫氣的臨床研究進展
到2013年四月為至,先後有7個疾病臨床研究報導,分別是二型糖尿病、代謝綜合症、血液透析、炎症/線粒體肌肉病、腦幹缺血和放射治療副作用和系統性紅斑狼瘡。從世界衛生組織註冊的信息中可以發現,也有一些沒有發表論文的臨床研究。這些研究報告顯示氫氣在人體脂代謝和糖代謝中的關鍵的調節作用。
燃料套用
氫氣可以用作燃料,具有下列特點:
優點
一、資源豐富。以水為原料,電解便可獲得。水資源在地球上相對主要燃料石油,煤也較豐富。
二、熱值高。氫燃燒的熱值高居各種燃料之冠,據測定,每千克氫燃燒放出的熱量為1.4*10^8J,為石油熱值的3倍多。因此,它貯存體積小,攜帶量大,行程遠。
三、氫為燃料最潔淨。氫的燃燒產物是水,對環境不產生任何污染。相反,以汽油,柴油為燃料的車輛,排放大量氮氧化物、
四乙基鉛[Pb(C
2H
5)
4],會導致酸雨,酸霧和嚴重的鉛中毒。更重要的是,廢氣中還含有3,4-苯並芘的強致癌物質,污染大氣,危害健康。現世界各國對以氫為新型能源的研究頗為重視。日本於1984年5月24日在富士高速公路以每小時200千米速度首次試車(以氫為燃料)成功。
缺點
氫氣要安全儲藏和運輸並不容易,它重量輕、難捉摸、擴散速度快,需低溫液化,會導致閥門堵塞並形成不必要的壓力
行業套用
核研究、氘核加速器的轟擊
粒子、
示蹤劑、可以做氣相色譜氫焰化驗原料、密度小充探空氣球、新型的高能燃料(驅動火箭)、冶鍊金屬鎢、鉬等,還有石油精煉、浮法玻璃、電子、食品、飲水、化工生產、航天、汽車業等行業
製取方法
實驗室製取
用鋅與稀硫酸反應:
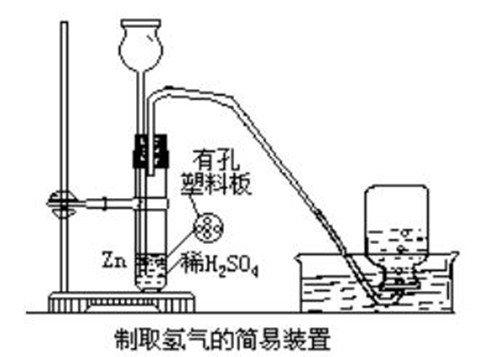 製取氫氣的簡易方法
製取氫氣的簡易方法注意:
1、這裡最好不用鹽酸,是因為該反應放熱,鹽酸會揮發出氯化氫氣體,使製得的氣體含有氯化氫雜質。Zn+2HCl===ZnCl2+H2↑
2、鉀、鈣、鈉等金屬與稀酸反應時,會優先置換出水中的氫並生成相應的鹼,且反應過於劇烈
4、不能使用
硝酸或濃硫酸,因為這兩種酸具有強氧化性,反應將會生成NO
2或SO
2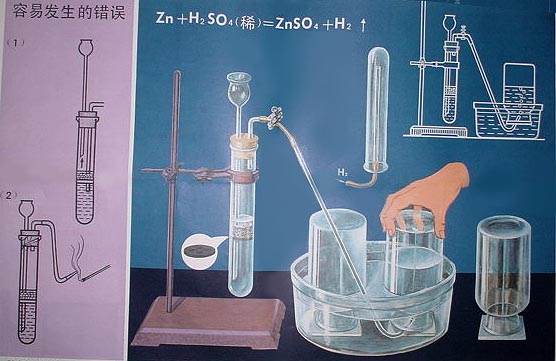 氫氣的實驗室製取
氫氣的實驗室製取2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
註:市場上零壓氫氣機就是根據鋁和氫氧化鈉反應制氫充球。因為是開放性,是一邊放料一邊充球,所以機內是無氣壓的,安全係數較高。
電解水實驗
電解就是將兩根金屬或碳棒(即電極)放在要分解的物質(電解質)中, 然後接上電源,使電流通過液 體。化合物的陽離子移到帶負電的電極(陰極),陰離子移到帶正電的電極(陽極),化合物分為二極。
H2O=H++OH-
H++e-=H
2H=H2
OH--e-=OH
2OH=H2O2
2H2O2=2H2O+O2
總的化學方程式是:2H2O=通電=2H2↑+O2↑
收集
1.排水集氣法(用於收集難溶於水的氣體)
優點:可以收集到較純淨的氣體 缺點:收集到的氣體較濕潤
2.向下排空氣法(用於收集密度比空氣小,不與空氣中成分反應的氣體),
優點:過程簡潔 缺點:收集到的氣體不純
工業製作法
①水煤氣法(主要成分CO和H2,C+H2O==高溫==CO+H2)
②電解水的方法制氫氣(2H2O==通電==O2↑+2H2↑)
③電解飽和食鹽水(2NaCl+2H2O==通電==2NaOH+H2↑+Cl2↑)
原始製作法
原始氫氣是宇宙大爆炸由原始粒子形成的氫氣,大部分分布在宇宙空間內和大的星球中,是恆星的核燃料,是組成宇宙中各種元素及物質的初始物質。地球上沒有原始氫氣因為地球的引力束縛不了它。只有它的化合物。
人造氫氣生產方法
可分為以下幾種⒈ 工業氫氣生產方法:
 啟普發生器制氫氣
啟普發生器制氫氣⑴由煤和水生產氫氣(生產設備煤氣發生設備,變壓吸附設備)
將水蒸氣通過熾熱的炭層:C+H2O(g)=高溫=CO+H2(水煤氣),再低溫分離
⑵由裂化石油氣生產(生產設備裂化設備,變壓吸附設備,脫碳設備)
CH4=高溫催化劑=C+2H2
⑶電解水生產(生產設備電解槽設備)
⑷工業廢氣。
⒉民用氫氣生產方法:
⑴氨分解(生產設備汽化爐,分解爐,變壓吸附設備)
⑵由活潑金屬與酸(生產設備不鏽鋼或玻璃容器設備)
(3)強鹼與鋁或矽(生產設備充氫氣球機設備)一般生產氫氣球都用此方法。
Si+2NaOH+H2O=加熱=Na2SiO3+2H2↑
(4)甲醇裂解(生產設備導熱油爐,甲醇汽化裂解設備,變壓吸附裝置)一般用氫氣量較大化工廠均用此方法。
CH3OH=高溫催化=2H2↑+CO↑,低溫分離
⒊試驗室氫氣生產方法:
硫酸與鋅粒(生產設備:啟普發生器)
4.其他
(1)由重水電解。
(2)由液氫低溫精鎦。
工業製法
一、電解水制氫 多採用鐵為陰極面,鎳為陽極面的串聯電解槽(外形似壓濾機)來電解苛性鉀或苛性鈉的水溶液。陽極出氧氣,陰極出氫氣。該方法成本較高,但產品純度大,可直接生產99.7%以上純度的氫氣。這種純度的氫氣常供:①電子、儀器、儀表工業中用的還原劑、保護氣和對坡莫合金的熱處理等,②粉末冶金工業中制鎢、鉬、硬質合金等用的還原劑,③製取多晶矽、鍺等半導體原材料,④油脂氫化,⑤雙氫內冷發電機中的冷卻氣等。像北京電子管廠和科學院氣體廠就用水電解法制氫。利用電解飽和食鹽水產生氫氣
如2NaCl+2H2O==通電==2NaOH+Cl2↑+H2↑
二、
水煤氣法制氫 氣用無煙煤或焦炭為原料與水蒸氣在高溫時反應而得水煤氣(C+H
2O====CO+H
2—熱)。淨化後再使它與水蒸氣一起通過觸媒令其中的CO轉化成CO
2(CO+H
2O→CO
2+H
2)可得含氫量在80%以上的氣體,再壓入水中以溶去CO
2,再通過含氨蟻酸亞銅(或含氨乙酸亞銅)溶液中除去殘存的CO而得較純氫氣,這種方法制氫成本較低產量很大,設備較多,在合成氨廠多用此法。有的還把CO與H
2合成甲醇,還有少數地方用80%氫的不太純的氣體供人造液體燃料用。像北京化工實驗廠和許多地方的小氮肥廠多用此法。
三、由石油熱裂的合成氣和天然氣制氫 石油熱裂副產的氫氣產量很大,常用於汽油加氫,石油化工和化肥廠所需的氫氣,這種制氫方法在世界上很多國家都採用,在中國的石油化工基地如在慶化肥廠,
渤海油田的石油化工基地等都用這方法制氫氣 也在有些地方採用(如美國的Bay、way和Batan Rougo加氫工廠等)。
四、焦爐煤氣冷凍制氫 把經初步提淨的焦爐氣冷凍加壓,使其他氣體液化而剩下氫氣。此法在少數地方採用(如
蘇聯的Ke Mepobo工廠)。
五、電解食鹽水的副產氫 在氯鹼工業中副產多量較純氫氣,除供合成鹽酸外還有剩餘,也可經提純生產普氫或純氫。像化工二廠用的氫氣就是電解鹽水的副產。
利用電解飽和食鹽水產生氫氣:如2NaCl+2H2O=電解=2NaOH+Cl2↑+H2↑
六、釀造工業副產
用玉米發酵丙酮、丁醇時,發酵罐的廢氣中有1/3以上的氫氣,經多次提純後可生產普氫(97%以上),把普氫通過用液氮冷卻到—100℃以下的矽膠列管中則進一步除去雜質(如少量N2)可製取純氫(99.99%以上),像北京釀酒廠就生產這種副產氫,用來燒制石英製品和供外單位用。
七、鐵與水蒸氣反應制氫
3Fe+4H2O=高溫=Fe3O4+4H2
但品質較差,此系較陳舊的方法現已基本淘汰
八、金屬鎂和水的反應制氫

通過某些礦物質的參與,鎂會在冷水中緩慢均衡地反應,並生成豐富的氫氣。
其他
工業上用水和紅熱的碳反應
C+H2O=高溫=CO+H2
製取氫氣的新方法
1.用
氧化亞銅作催化劑並用紫外線照射從水中製取氫氣。
 盛有氫氣的集氣瓶的放置方法
盛有氫氣的集氣瓶的放置方法2.用新型的鉬的化合物做催化劑從水中製取氫氣。
3.用光催化劑反應和超音波照射把水完全分解的方法。
4.陶瓷跟水反應製取氫氣。
5.生物質快速裂解油製取氫氣。
6.從微生物中提取的酶制氫氣。
7.用細菌製取氫氣。8.用綠藻生產氫氣。
9.有機廢水發酵法生物制氫氣。
10.利用太陽能從生物質和水中製取氫氣。
利用太陽能從生物質和水中製取氫氣是最佳的製取氫氣的方法。理由是太陽能能量巨大、取之不盡、用之不竭、而且清潔、無污染、不需要開採、運輸。怎樣製取氫氣的成本就大大降低。
11.用二氧化鈦作催化劑,在雷射的照射下,讓水分解成氫氣和氧氣.
12.硼和水蒸氣在高溫下反應製取氫氣,化學方程式為2B+6H2O=高溫=2H3BO3+3H2
新型制氫
氫作為一種清潔能源已被廣泛重視,並普遍作為燃料電池的動力源,然而製取氫的傳統方法成本高,技術複雜。美國研究人員日前開發出一種利用木屑或農業廢棄物的纖維素製取氫的技術,有望解決氫製取費用高的難題。
來自美國
維吉尼亞理工大學、橡樹嶺國家實驗室等機構的研究人員發表報告說,他們把14種酶、1種輔酶、纖維素原料和加熱到32攝氏度左右的水混合,製造出純度足以驅動燃料電池的氫氣。
研究人員說,他們的“一鍋燴”過程有不少進步,比如採用與眾不同的酶混合物,還提高了氫氣的生成速度。此外,除了把纖維素中分解出的糖轉化為化學能量外,這一過程還可產出高質量的氫。
研究人員說,他們主要使用從木屑中分解的纖維素原料製取氫,不過也可以使用稻草、廢棄的莊稼稈等。木屑或農業廢棄物資源非常豐富,利用它們製取氫,不僅可降低製造成本,而且將大大擴大生產氫的原料資源。製法
2018年2月,中國實現氫氣的低溫製備和存儲,榮獲科技部2017年度中國科學十大進展。
其他制氫反應
此外,還包括一些金屬(活動性比氫強)和酸的反應同樣會生成氫氣。
檢測方法
中華人民共和國國家標準 GB 7445-87
 氫氣的檢驗
氫氣的檢驗本標準適用於氫氣的檢驗,規定了氫氣含量及氧、氮、一氧化碳、二氧化碳、甲烷、水分等雜質含量的測定方法。
1 氫含量的測定
氫氣的體積百分含量(c)用差減法計算求得,按式(1)計算:
式中:
c1--氧氣的體積含量,ppm;
c2--氮氣的體積含量;ppm;
c3--一氧化碳的體積含量,ppm;
c4--二氧化碳的體積含量,ppm;
c5--甲烷的體積含量,ppm。
2 氧和氮含量的測定
採用變溫濃縮色譜技術,以熱導檢測器檢測。首先使被測組分在液氮溫度下的濃縮柱上定量吸附,然後升溫定量脫附,再經色譜柱分離後檢測。被測組分進入熱導檢測器引起橋路阻值的變化與氧、氮含量成比例,由此可定氧、氮含量。
儀器
氣相色譜儀及配套的濃縮進樣裝置,其示意流程圖如圖所示。要求儀器對氧、氮的最低檢測濃度分別不高於4ppm、8ppm。色譜儀的安裝和調試及濃縮操作按規定要求進行。
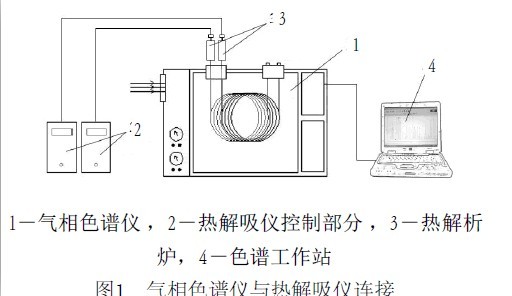 氣相色譜儀與熱解吸儀連線
氣相色譜儀與熱解吸儀連線1、攜帶型氫氣檢測儀
攜帶型氫氣泄漏檢測儀可連續檢測作業環境中氫氣濃度。氫氣泄漏檢測儀為自然擴散方式檢測氣體濃度,採用電化學感測器,具有較好的靈敏度和出色的重複性;氫氣檢測儀採用嵌入式微控制技術,選單操作簡單,功能齊全,可靠性高,整機性能優良。檢測儀外殼採用高強度工程材料、複合彈性橡膠材料精製而成,強度高、手感好。
2、泵吸式氫氣檢測儀
泵吸式氫氣檢測儀採用內置吸氣泵,可快速檢測工作環境中氫氣濃度。泵吸式氫氣檢測儀採用電化學感測器,具有非常清晰的大液晶顯示屏,聲光報警提示,保證在非常不利的工作環境下也可以檢測危險氣體並及時提示操作人員預防。
3、線上式氫氣檢測報警器
線上式氫氣檢測報警器由氣體檢測報警控制器和固定式氫氣檢測器組成,氣體檢測報警控制器可放置於值班室內,對各監測點進行監測控制,氫氣檢測器安裝於氣體最易泄露的地點,其核心部件為氣體感測器。氫氣檢測器將感測器檢測到的氫氣濃度轉換成電信號,通過線纜傳輸到氣體檢測報警控制器,氣體濃度越高,電信號越強,當氣體濃度達到或超過報警控制器設定的報警點時,氣體檢測報警控制器發出報警信號,並可啟動電磁閥、排氣扇等外聯設備,自動排除隱患。線上式氫氣檢測報警器廣泛套用於石油、化工、冶金、電力、煤礦、水廠等環境,有效防止爆炸事故的發生。
測定條件
a. 檢測器:熱導池;
b. 橋路電流:150~200 mA;
c. 載氣純度:不低於99.999%的高純氫,應符合GB 7445-87《氫氣》要求;
d. 載氣流速:40~60 ml/min
e. 濃縮時樣品流速:1.0~1.5 ml/min;
f. 色譜柱:長2500px,內徑3 mm,內裝活化後的40~60目5分子篩,柱溫為室溫;
g. 濃縮柱:長750px,內徑4 mm,內裝活化後的40~60目5分子篩,吸附溫度為-196 ℃(液氮浴),脫附溫度為室溫(水浴)。
測定步驟
1.色普儀啟動
按氣相色譜儀使用說明書啟動儀器。開啟載氣,充分置換色譜系統,純化載氣,調整流速至規定值,接通熱導池電源,調整儀器各部位達測定條件,待儀器工作穩定。
2.測定
空白:關閉濃縮柱,套上液氮浴5min後,取下液氨浴,在室溫下浴下令載氣通過濃縮柱,以記錄儀上無色譜峰出現為正常:再令載氣通過濃縮,在小心嚴防空氣倒吸的情況下,濃縮載氣5min,測定色譜系統空白值符合2.3條c項要求為正常。
置換:將樣品氣鋼瓶經採樣閥及管道與儀器相連,然後3次升降壓並用約20倍以上管道體積的樣品氣充分置換進入濃縮柱前的連線管和閥體,使所取樣品具有代表性。
濃縮:令樣品氣以1.0~1.5L/min流速通過濃縮柱,置換2~3min後關閉濃縮柱出口,然後將濃縮柱緩慢套上液氮浴,待墊氣結束後打開濃縮柱出口,樣品氣流經濕式流量計後放空。
樣品氣的濃縮體積數積數由被測組分含量和儀器靈敏度決定。
進樣:濃縮完畢,關閉濃縮柱入口,取下液氨浴後在室溫下浴下放掉解吸的氫,關閉濃縮柱出口,迅速轉動六通閥。令載氣通過濃縮柱將被測組分帶入色譜柱,在濕式流量計上讀到樣品體積數。
測量:記錄各被測組分的色譜流出曲線,分別測量各組分峰面積A1。
定標
用指數稀釋法配製的標準氣定標。定標方法見GB4815-84《氦氣檢驗方法》附錄C。
將標準氣直接進樣測定出標準氣中氧和氮的色譜峰面積A2。
標準氣是以99.999%的氫為底氣,用空氣經稀釋配製而成的,定標時各組分的已知濃度應與樣品氣濃縮後各相尖組分濃度相近。
純氫測定
純氫中氮的測定,無需進行濃縮操作,其他步驟同上。採用1~5ml定體積量管接進樣即可計算方法式(2)中的V1和V2分別代表樣品氣和標準氣的進樣體積,氧的測定按GB 6285-86《氣體中微量氧的測定電化學法》進行。
結果處理
以兩次平行測定的算術平均值為測定結果,平行測定的相對偏差:超純氫、高純氫、純氫分別不大於50%、20%、10%。
氫中被測組分的含量按式(2)計算:
式中:C1--樣品氣中被測組分的含量,ppm;
C2--標準氣中被測組分的含量,ppm;
A1--樣品氣中被測組分的峰面積,mm2;
A2--標準氣中被測組分的峰面積,mm2;
V1--樣品氣濃縮體積,ml;
V2--標準氣進樣體積,ml。
參考選項
純度參考
GBT 3634.2-2011氫氣 第2部分:純氫、高純氫和超純氫
純氫、高純氫、超純氫(GB/T7445-1995)(已作廢)
項目名稱 | 指標 |
超純氫 | 高純氫 | 純氫 |
氫氣的體積分數/10 ≥ | 99.9999 | 99.999 | 99.99 |
氧氣(氬氣)的體積分數/10 ≤ | 0.2 | 1 | 5 |
氮氣的體積分數/10 ≤ | 0.4 | 5 | 60 |
一氧化碳含量/10 ≤ | 0.1 | 1 | 5 |
二氧化碳含量/10 ≤ | 0.1 | 1 | 5 |
甲烷含量/10 ≤ | 0.2 | 1 | 10 |
水分/10 ≤ | 1.0 | 3 | 30 |
註:表中純度和含量均以體積分數表示(V/V)。 |
產品原料
上游原料:甲醇、氯化鈉、煤、氫氧化鉀、燒鹼、鹽酸、重油
下游產品:氫溴酸、鹽酸、鹽酸(食用)、鹽酸(精製)、氯磺酸、工業氨水、硼氫化鈉、硼氫化鉀、氫化鈉、油浸氫化鈉、過氧化氫、多晶矽、鉬、壓縮氫氣、液氬
包裝運輸
1.包裝方式:氫氣拖車/瓶組/鋼瓶
2.運輸方式:氫的貯運有四種方式可供選擇,即氣態貯運、液態貯運、金屬氫化物貯運和微球貯運。現實際套用的只有前三種,微球貯運方式尚在研究中。
注意事項
氫氣是一種無色、無嗅、無毒、易燃易爆的氣體,和氟氣、氯氣、氧氣、一氧化碳以及空氣混合均有爆炸的危險,其中,氫氣與氟氣的混合物在低溫和黑暗環境就能發生自發性爆炸,與氯氣的混合體積比為1:1時,在光照下也可爆炸。氫氣由於無色無味,燃燒時火焰是透明的,因此其存在不易被感官發現,在許多情況下向氫氣中加入有臭味的
乙硫醇,以便使嗅覺察覺,並可同時賦予火焰以顏色。
氫氣雖無毒,在生理上對人體是惰性的,但若空氣中氫氣含量增高,將引起缺氧性
窒息。與所有低溫液體一樣,直接接觸液氫將引起凍傷。液氫外溢並突然大面積蒸發還會造成環境缺氧,並有可能和空氣一起形成爆炸混合物,引發燃燒爆炸事故。與空氣混合能形成爆炸性混合物,遇熱或明火即會發生爆炸。氣體比空氣輕,在室內使用和儲存時,漏氣上升滯留屋頂不易排出,遇火星會引起爆炸。氫氣與氟、氯、溴等鹵素會劇烈反應。
氫氣因為是易燃壓縮氣體,故應儲存於陰涼、通風的倉間內。倉內溫度不宜超過30℃。遠離火種、熱源。防止陽光直射。應與氧氣、壓縮空氣、鹵素(氟氣、氯氣、溴)、氧化劑等分開存放。切忌混儲混運。儲存間內的照明、通風等設施應採用防爆型,開關設在倉外,配備相應品種和數量的消防器材。禁止使用易產生火花的機械設備工具。驗收時要注意品名,注意驗瓶日期,先進倉的先發用。搬運時輕裝輕卸,防止鋼瓶及附屬檔案破損。
常見謠言
謠言一:氫氣(H2 )還原氧化銅吸熱
闢謠:判斷反應熱效應的兩個標準是實驗實測以及通過熱力學進行計算
計算過程:
反應:CuO(s)+H2(g)=Cu(cr)+H2O(g)
計算化學反應熱效應可以直接使用ΔH(例題見高等教育出版社《無機化學》上冊216頁),此處忽略溫度對ΔH的影響。
相應物質標準生成焓:(單位:kJ/mol)(數據出自高等教育出版社《無機化學》上冊427頁起的附表)
據查,H2O(g)標準生成焓-241.82,CuO(cr)標準生成焓-157.30,H2(g)、Cu(cr)均為0
ΔH=0+(-241.818)-(-157.3)-(0)=-84.518<0,即反應放熱
綜上可知氫氣還原氧化銅是典型的放熱反應而非吸熱。
謠言二:氫氣(H2)具有還原性,所以不能被濃硫酸乾燥
闢謠:氫氣的還原性一般在加熱時才體現,在常溫下不體現,只作為中性氣體,所以氫氣可以用濃硫酸乾燥。一氧化碳氣體亦同理。
 發光的超級氫
發光的超級氫
 氫氣燃燒
氫氣燃燒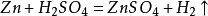
 製取氫氣的簡易方法
製取氫氣的簡易方法 氫氣的實驗室製取
氫氣的實驗室製取 啟普發生器制氫氣
啟普發生器制氫氣
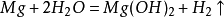
 盛有氫氣的集氣瓶的放置方法
盛有氫氣的集氣瓶的放置方法
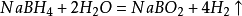
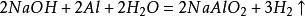
 氫氣的檢驗
氫氣的檢驗 氣相色譜儀與熱解吸儀連線
氣相色譜儀與熱解吸儀連線
