簡介
有機酸可與
醇反應生成
酯。
羧基是羧酸的
官能團,除
甲酸(H一COOH)外,羧酸可看做是烴分子中的氫原子被羧基取代後的
衍生物。可用通式(Ar)R-COOH表示。羧酸在
自然界中常以游離狀態或以鹽、酯的形式廣泛存在。羧酸分子中烴基上的氫原子被其他原子或
原子團取代的
衍生物叫取代羧酸。重要的取代羧酸有
鹵代酸、
羥基酸、
酮酸和
胺基酸等。這些化合物中的一部分參與動植物代謝的生命過羥,有些是代謝的中間產物,有些具有顯著的生物活性,能防病、治病,有些是有機合成、工農業生產和醫藥工業原料。
分布
在中草藥的葉、根、特別是果實中廣泛分布,如
烏梅、
五味子,
覆盆子等。常見的植物中的
有機酸有
脂肪族的一元、二元、多元羧酸如
酒石酸、
草酸、
蘋果酸、
枸椽酸、抗壞血酸(即維生素C)等,芳香族有機酸如苯甲酸、水楊酸、
咖啡酸(Caffelc acid)等。除少數以
游離狀態存在外,一般都與鉀、鈉、鈣等結合成鹽,有些與生物鹼類結合成鹽。脂肪酸多與甘油結合成酯或與高級醇結合成蠟。有的有機酸是揮髮油與樹脂的組成成分。
特點
有機酸多溶於水或
乙醇呈顯著的酸性反應,難溶於其他有機溶劑。有
揮發性或無。在有機酸的水溶液中加入氯化鈣或醋酸鉛或氫氧化鋇溶液時,能生成不溶於水的
鈣鹽、鉛鹽或
鋇鹽的沉澱。如需自中草藥提取液中除去有機酸常可用這些方法。
價值
一般認為脂肪族有機酸無特殊生物活性,但有些有機酸如酒石酸、枸椽酸作藥用。又報告認為蘋果酸、枸椽酸、酒石酸、抗壞血酸等綜合作用於中樞神經。有些特殊的酸是某些中草藥的有效成分,如土槿皮中的土槿皮酸有抗真菌作用。咖啡酸的
衍生物有一定的生物活性,如綠原酸(Chlorogenic acid)為許多中草藥的有效成分。有抗菌、利膽、升高白血球等作用。
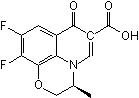 有機酸
有機酸羧酸
分類
羧酸的官能團是羧基,除甲酸外,都是由烴基和羧基兩部分組成。根據
烴基的結構不同,分為脂肪酸和芳香酸。羧基與脂肪
烴基相連結者,稱為脂肪酸;脂肪酸又根據烴基的不飽和度分為飽和酯肪酸和
不飽和脂肪酸。若脂肪烴基中不含有不飽和鍵,則稱為飽和脂肪酸;若脂肪烴基中含有不飽和鍵,則稱為不飽和脂肪酸。羧基與芳香烴基相連結者,稱為芳香酸。羧酸還可以根據其分子中所含羧基的數目不同分為一元羧酸、二元羧酸和多元羧酸。分子中含有一個羧基的稱為一元羧酸;分子中含有兩個羧基的稱為
二元羧酸:把分子中含有兩個以上羧基的羧酸統稱為多元羧酸。
命名
羧酸常用俗名和系統命名。常用俗名往往是由其來源而得,如乾餾螞蟻得到蟻酸(
甲酸),從制食用醋中得到醋酸(
乙酸)。油酯水解得到
高級脂肪酸,如
軟脂酸(
棕櫚酸)、硬脂酸、
油酸、亞油酸和亞麻酸等。
羧酸的系統命名原則與醛相似。
⒈飽和一元脂肪酸的命名
⑴選擇含羧基在內的最長碳鏈作為主鏈,根據主鏈碳原子的數目稱為某酸。
⑵從羧基碳原子開始用阿拉伯數字對主鏈碳原子依次編號,也常用希臘字母,把與羧基直接相連的碳原子的位置定為α位,依次為B、v等。
⑶有側鏈或取代基時,將其位次、數目和名稱寫於“某酸”之前。
⒉飽和多元脂肪酸的命名飽和二元酯肪酸的命名是選擇含有兩個羧基的最長碳鏈作為主鏈,稱為某二酸。例如:
HOOC-COOH乙二酸(草酸)HOOC一CH2CH2-COOH丁二酸(琥珀酸)
⒊不飽和脂肪酸的命名不飽和脂肪酸命名時,選擇含羧基和不飽和鍵在內的最長碳鏈為主鏈,稱為某烯酸,並把不飽和鍵的位置寫在“某烯酸”之前。當主鏈
碳原子的數目大於10時,則在中文數字後加個“碳”字。例如:
⒋芳香酸的命名芳香酸是以脂肪酸為母體,把芳香烴基作為取代基進行命名。
結構
羧酸的官能團是羧基,是由羰基和羥基(-OH)相連而成的。但羧酸的性質並不是羰基和羥基性質的加合,而是具有羧基自身的性質。
雜化軌道理論認為,羧基中的
碳原子是以Sp2雜化的。
碳原子的3個Sp2雜化軌道分別與2個
氧原子、1個羥基的碳原子或1個
氫原子形成3個
σ鍵,並處於同一平面上。羧基碳原子上未參與雜化的p軌道與羰基
氧原子上的p軌道從側面平行重疊形成∏鍵。羥基中的氧原子上有一對未
共用電子對,可與∏鍵形成p-∏
共軛體系。
在p-∏共軛體系中,電子的離域使羥基氧原子上的電子云向羰基轉移,導致羥基氧上的電子云密度有所降低,羰基碳上的電子云密度有所增加。因此,p-∏
共軛效應的結果,使氧氫間
電子云更偏向氧原子,增強了氧氫鍵的極性,有利於羥基中氫原子的解離,故羧酸表現出明顯的酸性;並且
羰基碳與其相連的兩個氧原子間的鍵長趨於平均化,其正電性減弱,所以羰基的性質不明顯,不易與
親核試劑(如HCN、NaHSO3等)發生加成反應。
物理性質
常溫下,在飽和一元酯肪酸中,甲酸、乙酸、丙酸為具有強烈刺激性氣味的無色液體,含4-9個碳原子的羧酸為具有腐敗氣味的油狀液體,癸酸以上為蠟狀固體。二元羧酸和芳香酸都是結晶性固體。羧酸的沸點隨著
相對分子質量的增加而升高。羧酸的沸點比相對分子質量相近的醇為高,如甲酸和乙醇的相對分子質量相同,甲酸的沸點為100.5℃,乙醇的沸點為78.5℃。這是由於羧酸分子間可以形成兩個
氫鍵,而且締合成雙分子二聚體,低級的羧酸甚至在
氣態下即締合成二聚體。
一元酯肪族羧酸隨碳原子數增加,水溶性降低。低級羧酸可與水混溶,高級一元羧酸不溶於水,但能溶於
有機溶劑。多元羧酸的水溶性大於相同碳原子的
一元酸。
化學性質
根據羧酸的結構特點,羧酸應具有下列主要的化學性質。
⒈羧酸顯酸性,是由於羧基中的p-π共軛效應的影響,使羥基氧原子上的電子云密度降低,從而增強了氫氧鍵的極性,易於解離出質子。解離後生成的羧基負離子,由於氧上的
負電荷通過p-π共軛而得到分散,使其穩定性增加。
羧酸一般都是弱酸,其酸性強弱可以用pKa來表示,通常羧酸的pKa在3-5之間,比強的無機酸弱,但比酚類(苯酚的pKa為9.96)、碳酸(pKa為6.38)要強,因此羧酸能與氫氧化鈉、碳酸鈉等反應生成羧酸鹽,也能與碳酸氫鈉反應,同時生成二氧化碳,而酚則不能發生此反應。
R-COOH+NaOH→R-COONa+NaCl
2R-COOH+Na2CO3一→2R-COONa+CO2↑+H2O
R-COOH+NaHCO3一→R-COONa+CO2↑+H2O
羧酸的鈉鹽、鉀鹽和銨鹽一般易溶於水,製藥工業中常利用此性質,將水溶性差的藥物轉變成易溶於水的羧酸鹽,以便製備注射劑使用。例如含有羧基的青黴素G的水溶性
極差,轉變成鉀鹽或鈉鹽後水溶性增大,便於臨床使用。
⒉羧基中
羥基的取代反應羧基中的羥基在一定條件下,可被羥氧基(一OR)、鹵素(-X)和醯氧基取代,分別生成酯、醯鹵和酸酐等羧酸衍生物。
⑴酯的生成:羧酸與醇在強酸(如硫酸等)催化下,生成酯和水的反應,稱為酯化反應。該反應是羧酸分子中羧基上的
羥基與醇分子中羥基上的氫原子結合生成水,其餘部分結合生成酯。
酯化反應是可逆反應,其逆反應是水解反應,即酯水解為羧酸和醇。酯化反應的速度很慢,在通常情況下,該
可逆反應需要很長時間才能達到平衡。為了加快
反應速率,縮短到達平衡的時間,常加入濃硫酸等作催化劑,並在加熱的條件下進行。例如:
羧酸與醇發生酯化反應,生成的酯稱為羧酸酯。一般所稱的酯,通常是指羧酸酯。從結構上分析,酯可以看做是由
醯基和羥氧基組成的化合物。
醯基是指羧酸分子中去掉羧基上的羰基後,剩餘的部分。例如:
羧酸酯根據分子中相應的羧酸和醇來命名,稱“某酸某酯”。
⑵醯滷的生成:羧酸和磷的鹵化物(如五氯化磷、三氯化磷和氯化亞碸等)發生反應生成醯鹵。
⑶酸酐的生成:一元羧酸除甲酸外與脫水劑(如五氧化二磷等)共熱,兩個分子羧酸間脫去1個分子水生成酸酐。
某些二元羧酸加熱,也發生分子內脫水,生成較穩定的具有五元或六元環的酸酐。
⒊α-氫的鹵代反應羧酸分子中的α-碳原子上的氫原子具有一定的活潑性。但因羧基中的羥基與
羰基形成p-∏
共軛體系,使羧基碳上的
電子云密度從羥基氧原子上得到部分補充。因而羧酸a-氫原子的活性較醛酮的α-氫原子弱,發生在該處的取代反應也較醛酮為慢。例如羧酸α氫原子的
鹵代反應常常需在
催化劑(如紅磷等)的存在下才能進行,生成α-鹵代酸,α-且氫原子是逐步被取代的。
⒋脫羧反應羧酸分子經加熱脫去羧基放出二氧化碳的反應稱為脫梭反應。通常一元酯肪羧酸比較穩定,不易發生脫羧反應。但在特殊的條件下,如
鹼石灰(NaOH+CaO)與
乙酸鈉共熱,則可脫羧生成
甲烷。
芳香羧酸比較容易脫羧,由於苯環與羧基之間的吸電子作用,有利於羧基與苯環之間的鍵斷裂,尤其是2,4,6-三硝基苯甲酸更容易脫羧而形成1,3,5-三硝基苯。
脫羧反應在生物體內的許多生化反應中占有重要地位,此反應在生物體內脫羧酶作用下進行的。
⒌二元羧酸的熱解反應二元羧酸除可以發生羧基的所有反應外,由於分子中兩個羧基的相互影響,具有某些特殊性質。二元羧酸對熱不穩定,當加熱這類羧酸時,隨著兩個羧基間
碳原子數的不同,可發生不同的反應。有的發生脫羧反應,有的發生
脫水反應,有的脫羧反應與脫水反應同時進行。
⑴脫羧反應:乙二酸、丙二酸受熱時,發生脫羧反應,生成少1個碳原子的一元羧酸。
⑵脫水反應:丁二酸、戊二酸加熱時分子內不發生脫羧反應而發生脫水反。應,生成環狀的
酸酐。
⑶同時脫羧脫水反應:己二酸、庚二酸在氫氧化鋇存在下加熱時,則分子內脫水和脫羧生成環酮。
例如:
含8個以上碳原子的酯肪二元酸受熱時,不能發生上述反應生成大於六元的環酮,而是分子間脫水,生成高分子鏈狀的縮合酸酐。這說明,在有可能形成
環狀化合物的條件下,都有一種形成張力較小的五元環或六元環的趨勢。
 有機酸
有機酸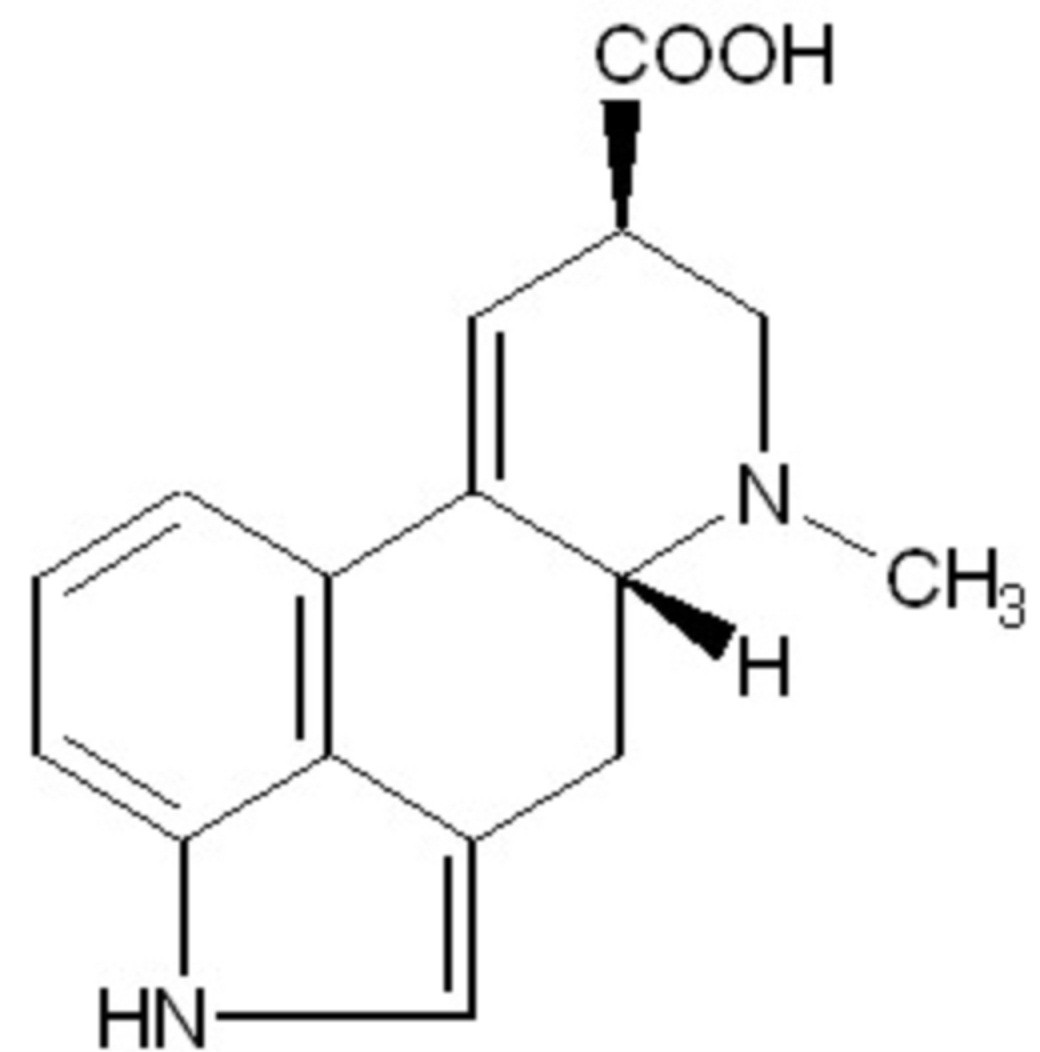
 有機酸
有機酸