基本介紹
相關問題
 共用電子對
共用電子對 共用電子對
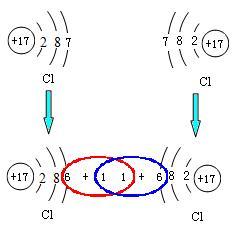
共用電子對在化學反應中元素的原子都有使最外層電子達到穩定結構的趨勢。在共價鍵理論中,成鍵的兩個原子的軌道發生重疊,一對電子位於兩個原子之間。例如氯元素的原子在化學...
共用電子對偏移...... 共用電子對.就是指當物質以共價鍵形成物質時,期間是通過相互共用電子以達到結合的目的.比如H2,2者共享彼此的2個電子形成穩定的物質. 電子對...
原子通過共用電子對而形成的化學鍵叫電子對鍵,又叫共價鍵(covalent bonding)。兩原子間共用一對電子的共價鍵叫共價單鍵(single covalent bonding),共用兩對、三對...
必須正確地表示出共用電子對數,並滿足每個原子的穩定結構。電子式離子 陽離子 簡單陽離子由於在形成過程中已失去最外層電子,所以其電子式書寫方式就是其離子符號...
價層電子對互斥模型是將共用電子對與孤對電子的概念,與原子軌道的概念相結合,且電子斥力達到最小。在這個模型中電子對相互排斥,成鍵電子與孤對電子距離越遠越好。...
共價鍵的成因較為複雜,路易斯理論認為,共價鍵是通過原子間共用一對或多對電子形成的,其他的解釋還有價鍵理論,價層電子互斥理論,分子軌道理論和雜化軌道理論等。金屬...
雙鍵是共價鍵的一種,共價鍵,就意味著共用電子對的存在。簡單的說,就是這一對電子,由鍵的兩方各出一個,彼此共用。因此,一個共價鍵就可以填補一個最外層電子的...
在分子中,同種原子形成共價鍵,兩個原子吸引電子的能力相同,共用電子對不偏向任何一個原子,因此成鍵的原子都不顯電性。這樣的共價鍵叫做非極性共價鍵,簡稱非極性...
共價鍵的共用電子對由成鍵的兩個原子各提供一個電子組成的, 稱為正常共價鍵。此外,還有一類共價鍵,其共用電子對完全是由一個成鍵原子單獨提供的。這種由一個...
路易斯認為,同種元素的原子之間以及電負性相近的元素的原子之間可以通過共用電子對形成分子,通過共用電子對形成的化學鍵稱為共價鍵(convalentbond),形成的分子稱為共價...
配位鍵,又稱配位共價鍵,或簡稱配鍵,是一種特殊的共價鍵。當共價鍵中共用的電子對是由其中一原子獨自供應,另一原子提供空軌道時,就形成配位鍵。配位鍵形成後...
親核試劑(nucleophile,意思為原子核的喜好物), 又叫親核基,指具有親核性的化學試劑,可用:Nu表示。一些帶有未共享電子對的分子或負離子,與正電性碳反應時稱為親核...
原子之間通過共用電子對所形成的相互作用叫共價鍵,可以是吸引力,也可是排斥力。而在化合物分子中,不同種原子形成共價鍵時,因為原子吸引電子的能力不同,共用電子對...
共價化合物的分子是原子間以共用電子對所形成的 [1] 。兩種非金屬元素原子(或不活潑金屬元素和非金屬元素)化合時,原子間各出一個或多個電子形成電子對,這個電子...
所以,了解和熟悉共價鍵,是研究和掌握有機化合物的結構與性質之間關係的關鍵。共價即電子對共用(或說電子配對)。中文名 共價鍵結合 外文名 covalent bond 類別 ...
原子間以共享電子對的方式形成分子,這種化學鍵稱為共價鍵;在通常情況下,共價鍵共享的電子對分別由兩個原子提供,有時共享的電子對則是由一個原子提供的,這樣的...
同時這些基團與芳環相連的原子(除R和Ph外)都有未共用電子對,可以芳環發生P-超共軛,使芳環上電子云密度增加。使得新的定位基容易進入該基團的鄰位和對位。...
和電子親合能,首先由萊納斯·卡爾·鮑林於1932年引入電負性的概念,用來表示兩個不同原子間形成化學鍵時吸引電子能力的相對強弱,是元素的原子在分子中吸引共用電子的...
如果親電試劑進攻鄰、對位,有比較穩定的極限式(c、e),這是由於氯原子的非共享電子對向苯環轉移,使(c、e)的每個原子均具有穩定的八隅體結構,由穩定極限式參與...
兩個或多個原子共同使用它們的外層電子,在理想情況下達到電子飽和的狀態,由此組成比較穩定的化學結構叫做共價鍵,或者說共價鍵是原子間通過共用電子對所形成的相互作用...
電子式:Ca2+[:C≡C:]2- 中間的“≡”代表三對共用電子對InChI: InChI=1/C2. Ca/c1-2;/q-2;+2理化性質:礦石為黃褐色或黑色的塊狀固體,純品為白色晶體...
配位原子指的是配位化合物中直接和中心原子(或離子)配位的配位體的原子。配位原子提供弧對電子被中心離子接受形成配位鍵。例F、I、Br等電負性較大的非金屬...
氧化-還原反應 (oxidation-reduction reaction, 也作redox reaction)是化學反應前後,元素的氧化數有變化的一類反應。氧化還原反應的實質是電子的得失或共用電子對的...
對於親電取代反應來說,雜原子都分別使環上碳原子的電子雲密度升高並使環活化,他們都比苯活潑,其活潑性同苯酚、苯胺相似。它們都可以進行通常的親電取代反應,如硝...
