信使介紹 Messenger RNA (mRNA)—— 信使 核糖核酸 原核生物和真核生物mRNA有不同的特點:
①原核生物mRNA常以
多順反子 的形式存在。真核生物mRNA一般以
單順反子 的形式存在。
③原核生物mRNA半壽期很短,一般為幾分鐘 ,最長只有數小時(RNA
噬菌體 中的RNA除外)。真核生物mRNA的半衰期較長, 如胚胎中的mRNA可達數日。
原核生物 mRNA一般5′端有一段不翻譯區,稱
前導區 ,3′端有一段不翻譯區,中間是蛋白質的
編碼區 ,一般編碼幾種蛋白質。真核生物mRNA(細胞質中的)一般由5′端
帽子結構 、5′端不翻譯區、翻譯區(編碼區)、3′端不翻譯區和3′端聚
腺苷酸 尾巴構成。分子中除m7G構成帽子外,常含有其他修飾
核苷酸 ,如m6A等。真核生物mRNA通常都有相應的前體。從DNA
轉錄 產生的原始轉錄產物可稱作原始前體(或mRNA前體)。一般認為原始前體要經過
hnRNA 核不均一RNA的階段,最終才被加工為成熟的mRNA。
通常mRNA(單鏈)分子自身回折產生許多雙鏈結構。
原核生物 ,經計算有66.4%的
核苷酸 以雙鏈結構的形式存在。
真核生物 mRNA也具有豐富的二級結構,摺疊起來的mRNA二級結構有利於蛋白質合成的啟動,以後mRNA處於伸展的狀態則有利於轉譯的繼續。
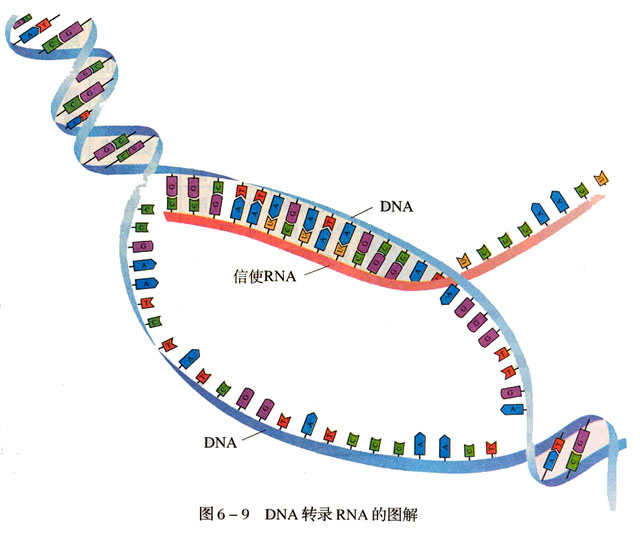
mRNA的複製,轉錄和翻譯:由一個DNA分子,邊
解旋 ,邊轉錄。利用細胞核內部的游離核糖核苷酸合成。合成規則遵循
鹼基互補配對原則 。註:因為mRNA沒有T(
胸腺嘧啶 ),所以模版中出現A(
腺嘌呤 )時,由U(
尿嘧啶 )代替。以上過程叫做
轉錄 ,在細胞核中完成。接著,mRNA穿過
核孔 。和細胞質中的
核糖體 結合。選擇
tRNA 運輸
胺基酸 ,和對應的三個
鹼基 排列好(如何排列請查詢:
密碼子 )。再與其它的胺基酸通過肽鍵連線在一起,形成
肽鏈 。以上過程叫做
翻譯 ,在細胞質中完成。
雖然人們已經破譯了決定
生命基礎 的蛋白質的
胺基酸合成 密碼,也知道了是DNA攜帶著這種密碼,但是,根據
細胞學 所掌握的事實:所有DNA都呆在細胞核內,而蛋白質卻存在於細胞質中,像DNA這樣的大分子是無法隨意進入細胞質的。然而密碼總是會被帶入細胞質的,這一來,人們不禁要問,是誰把鎖在細胞核內的DNA手裡的密碼帶入了細胞質的呢?科學家們從DNA那裡拷貝了一份密碼檔案,並帶入了細胞質中。經過試驗和觀察,發現這個信使就是RNA——
核糖核酸 。
發現 儲存在DNA分子中的這種
遺傳信息 能在複製中產生更多的拷貝,並翻譯成蛋白質。DNA的功能構成了信息的流動,遺傳信息如何轉變成蛋白質呢?
轉錄 就是其中的重要的一環。基因表達時以DNA的一條鏈為
模板合成 RNA,這一過程就是轉錄(transcription)。催化合成RNA的酶叫做RNA聚合酶(RNA polymerase)。RNA和DNA結構相似,所不同之處在於:⑴RNA一般以單鏈形式存在;⑵RNA中的核糖其C′-2不脫氧;⑶
尿苷 (U)取代了DNA中的
胸苷 。細胞中的RNA分成三種:mRNA(信使RNA),tRNA(
轉運RNA )和rRNA(核糖體RNA)。它們的功能各不相同。mRNA是合成蛋白質的模板,tRNA是轉運特異
胺基酸 的運載工具,rRNA是合成蛋白質的裝置。mRNA的鹼基序列,決定著蛋白質裝配時胺基酸的序列。
1955年Brachet用洋蔥
根尖 和
變形蟲 進行了實驗;若加入RNA酶降解細胞中的RNA,則蛋白質合成就停止,若再加入從酵母中提取的RNA,則又可以重新合成一些蛋白質,這就表明,蛋白質的合成是依賴於RNA。
同年Goldstein和Plaut用
同位素標記 變形蟲(Amoeba proteus)RNA前體,發現標記的RNA都在核內,表明RNA是在核內合成的。在標記追蹤(pulse-chase)實驗中,用短脈衝標記RNA前體,然後將細胞核轉移到未標記的
變形蟲 中。經過一段時間發現被標記的RNA分子已在細胞質中,這就表明RNA在核中合成,然後轉移到細胞質內,而蛋白質就在細胞質中合成,因此RNA就成為在DNA和蛋白質之間傳遞信息的信使的最佳候選者。
1956年Elliot Volkin和 Lawrence Astrachan作了一項很有意思的觀察:當E.coli被T2感染,迅速停止了RNA的合成,但噬菌的RNA卻開始迅速合成。用
同位素 脈衝一追蹤標記表明噬菌的RNA在很短的時間內就進行合成,但很快又消失了,表明RNA的半衰期是很短的。由於這種新合成的RNA的
鹼基比 和T2的DNA鹼基比相似,而和細菌的鹼基比不同,所以可以確定新合成的RNA是T2的RNA。由於T2感染細菌時注入的是DNA,而在細胞里合成的是RNA,可見DNA是合成RNA的模板。最令人信服的證據來自DNA-RNA的雜交實驗。Hall.B.D和Spiegeman,S,將T2噬菌體感染E.coli後立即產生的RNA分離出來,分別與T2和E.coli的DNA進行分子雜交,結果發現這種RNA只能和T2的DNA雜交形成“雜種”鏈,而不能和E.coli的DNA進行雜交。表明T2產生的這種RNA(即mRNA)至少和T2的DNA中的一條鏈是互補的。
Brenner,s. Jacob,F.和Meselson(1961)進行了一系列的的實驗(圖12-2),他們將E.coli培養在15N/13C的
培養基 中,因此合成的RNA和蛋白都被“重”同位素所標記。也就是說凡是“重”的
核糖體 ,RNA和蛋白都是細菌的,然後用T2感染E.coli,細菌的RNA停止合成,而開始合成T2的RNA此時用普通的“輕”培養基(14N/12C),但分別以32P來標記新合成的T2 RNA,以35S標記新合成的T2蛋白,因此任何重新合成的核糖體,RNA,及蛋白都是“輕”的但帶但有放射性同位素。經培養一段時間後破碎細胞,加入過量的輕的核糖體作對照,進行
密度梯度離心 ,結果“輕”的核糖體上不具有放射性,“重”的核糖體上具有32P和35S,表明⑴T2未合成核糖體,“輕”核糖體卻是後加放的。⑵T2翻譯時是借用了細菌原來合成的
核糖體 ,所以核糖體並無
特異性 ,核糖體上結合的mRNA,其序列的特異性才是指導合成蛋白質的
遺傳信息 ,從而提出了mRNA作為“信使”的證據。因此他們將這種能把遺傳信息從DNA傳遞到蛋白質上的物質稱為“信使”。他們預言⑴這種“信使”應是一個多核苷酸;⑵②其
平均分子量 不小於5´105(假定
密碼比 是3),足以攜帶一個
基因 的遺傳信息;⑶它們至少是暫時連在核糖體上;⑷其
鹼基組成 反映了DNA的序列;⑸它們能高速更新。Volkin和Astrachan發現高速更新的RNA似乎完全符合以上條件。Jacob和Monod將它定名為信使RNA(Messenger RNA)或mRNA。
合成與加工 第一節 DNA轉錄生成RNA 一、定義
一轉錄單位
二、RNA聚合酶
一
酶的特性 :以4種
NTP 為底物,需模板和
鎂離子 ,合成方向也是5’-3’,但不需要引物。
以DNA為模板形成信使RNA的過程 二酶的分類:
1.噬菌體的RNA聚合酶結構簡單,是單鏈蛋白,功能也簡單。
2.細菌則具有複雜的多
亞基 結構(450Kd),可識別並
轉錄 超過1000個
轉錄單位 。
3.
真核生物 的酶有多種,根據a-
鵝膏蕈鹼 (環狀8肽,阻斷RNA延伸)的抑制作用可分為三類:
聚合酶 A對它不敏感,分布於
核仁 ,轉錄
核糖體 RNA;聚合酶B對低濃度敏感,存在於
核質 ,轉錄信使RNA;聚合酶C位於核質,對高濃度敏感,轉錄小分子量RNA,如轉運RNA、5SRNA等。各種RNA聚合酶都是由10-15種不同亞基組成的多亞基複合物。
4.
線粒體 和
葉綠體 也有RNA聚合酶,結構簡單,能合成所有種類RNA。
三酶的構成:大腸桿菌的全酶有5個亞基(α2ββ’ωσ),含2個鋅。β催化形成
磷酸二酯鍵 ,β’結合模板,σ亞基稱為起始因子,可使RNA聚合酶穩定地結合到啟動子上。ββ’ωσ稱為
核心酶 。σ亞基在不同
菌種 間變動較大,而核心酶比較恆定。酶與不同啟動子的結合能力不同,不同啟動因子可識別不同的啟動子。σ70識別啟動子
共有序列 ,σ32識別熱休克
基因 ,σ60在氮飢餓時起作用。σ通過隨機移動起作用,不需解鏈。
四模板:以完整雙鏈DNA為模板,其中僅一條鏈可
轉錄 。轉錄時局部解鏈,轉錄後DNA重新形成雙螺旋結構,所以DNA是全保留的。
三、轉錄過程
分為起始、延長和終止三個階段。起始包括對雙鏈DNA特定部位的識別、局部(17bp)
解鏈 以及在最初兩個
核苷酸 間形成
磷酸二酯鍵 。第一個核苷酸摻入的位置稱為
轉錄起點 。
起始後
起始因子 離開,
核心酶 構象改變,沿模板移動,轉錄生成雜交雙鏈(12bp)。隨後DNA
互補鏈 取代RNA鏈,恢復DNA雙螺旋結構。延伸速度為50nt/s,酶移動17nm。錯誤幾率為10-5。
聚合酶 到達終點時,在終止輔助因子的幫助下停止反應,酶和RNA鏈脫落,
轉錄 結束。
一定義:酶識別、結合、開始轉錄的一段DNA序列。
強啟動子 2秒鐘啟動一次轉錄,弱啟動子10分鐘一次。
二
原核生物 :大腸桿菌在起點上游約-10鹼基對處有
保守序列 TATAAT,稱為pribnow box,有助於局部解鏈。在其上游還有TTGACA,稱為-35序列,提供RNA聚合酶識別的信號。
1.信使RNA的
啟動子 通常有三個保守區,-25到-30有TATA框,是解鏈位置,並決定
轉錄起點 ;-75位置有CAAT框,與RNA聚合酶的結合有關;更上游還有GC框,某些
轉錄因子 可結合。後兩個稱為上游因子,對
轉錄起始 頻率有較大影響;
2. 小RNA的啟動子在
轉錄 區內部,有一些輔助因子幫助RNA聚合酶識別。
一定義
二所有
原核生物 的終止子在終點之前都有一個
迴文結構 ,可使酶減慢移動或暫停合成。大腸桿菌有兩類終止子:
1. 簡單終止子,回文區有一段富含GC對的序列,回文後有寡聚
尿苷 。
2.依賴ρ的終止子,必須在有
ρ因子 時才能發揮作用,不含GC對,也無寡聚尿苷。ρ因子是蛋白質,可與酶作用,釋放RNA,並使酶脫離。
三某些因子可使酶越過終止子繼續轉錄,稱為通讀。常見於某些噬菌體的時序控制,
早期基因 與
晚期基因 以終止子相隔,早期基因產生
抗終止因子 ,使發生通讀以表達晚期基因。
一
遺傳信息 的表達有時序調控和適應調控,轉錄水平的調控是關鍵環節,因為這是表達的第一步。轉錄調控主要發生在起始和終止階段。
三
真核生物 不組成
操縱子 ,而是通過激素、生長因子等進行調控。某些DNA序列對轉錄起增強作用,稱為
增強子 。
第二節 轉錄後加工 一
核糖體 RNA:大腸桿菌共有7個核糖體RNA的
轉錄單位 ,每個
轉錄 單位由16S、23S、5SRNA和若干轉運RNA基因組成。16S和23S之間常由轉運RNA隔開。轉錄產物在RNA酶III的作用下裂解產生核糖體RNA的前體P16和P23,再由相應
成熟酶 加工切除附加序列。前體加工時還進行
甲基化 ,產生修飾成分,特別是a-甲基
核苷 。N4,2’-O二甲基胞苷(m4Cm)是16S核糖體RNA特有成分。5S核糖體RNA一般無修飾成分。
二轉運RNA:有60個基因,其加工包括:
1.
內切酶 在兩端切斷,大腸桿菌RNA酶P是5’成熟酶;
2.外切酶從3’修剪,除去附加順序。RNA酶D是3’成熟酶;
3.3’端加上CCAOH,由轉運RNA核苷醯
轉移酶 催化,某些轉運RNA已有,切除附加序列後即露出;
三信使RNA:細菌多數不用加工,
轉錄 與翻譯是
偶聯 的。也有少數
多順反子 信使RNA必須由
內切酶 切成較小的單位,然後翻譯。如核糖體大
亞基 蛋白與RNA
聚合酶 的b亞基
基因 組成混合操縱子,轉錄後需經RNA酶III切開,各自翻譯。因為RNA聚合酶的合成水平低得多,切開有利於各自的翻譯調控。較長的RNA會產生高級結構,不利於翻譯,切開可改變其結構,從而影響其功能。
一
核糖體 RNA:
基因拷貝 數多,在幾十到幾千之間。基因成簇排列在一起,由RNA聚合酶I轉錄生成一個較長的前體,哺乳動物為45S。
核仁 是rRNA合成與核糖體亞基生物合成的場所。RNA酶III等
核酸內切酶 在加工中起重要作用。5SRNA基因也是成簇排列的,由RNA聚合酶III
轉錄 ,經加工參與構成大亞基。核糖體RNA可被
甲基化 ,主要在
核苷 2’羥基,比
原核生物 甲基化程度高。多數核糖體RNA沒有
內含子 ,有些有內含子但不轉錄。
二轉運RNA:由RNA聚合酶III轉錄,加工與原核相似,但3’端的CCA都是後加的,還有2’-O-甲基核糖。
三信使RNA:
真核生物 編碼蛋白質的基因以單個基因為
轉錄單位 ,但有內含子,需切除。信使RNA的原初轉錄產物是分子量很大的前體,在核內加工時形成大小不等的中間物,稱為核內不均一RNA(hnRNA)。其加工過程包括:
1.5’端加帽子:在
轉錄 的早期或
轉錄終止 前已經形成。首先從5’端脫去一個磷酸,再與GTP生成5’,5’三磷酸相連的鍵,最後以S-腺苷甲硫氨酸進行
甲基化 ,形成
帽子結構 。帽子結構有多種,起識別和穩定作用。
2. 3’端
加尾 :在核內完成。先由RNA酶III在3’端切斷,再由多聚
腺苷酸 聚合酶加尾。尾與通過核膜有關,還可防止
核酸外切酶 降解。
3. 內部甲基化:主要是6-甲基腺嘌呤,在hnRNA中已經存在。可能對前體的加工起
識別作用 。
三、RNA的拼接
二四膜蟲
核糖體 RNA的拼接:某些四膜蟲26S核糖體RNA基因中有一個內含子,其拼接只需一價和二價
陽離子 及
鳥苷酸 或鳥苷存在即可自發進行。其實質是磷酸酯的轉移反應,鳥苷酸起輔助因子的作用,提供游離3’
羥基 。
三信使RNA:
真核生物 編碼蛋白質的
核基因 的內含子屬於第二類內含子,左端為GT,右端為AG。先在左端切開,產生的5’末端與3’端上游形成5’,2’-
磷酸二酯鍵 ,構成套索結構。然後
內含子 右端切開,兩個
外顯子 連線起來。通過不同的拼接方式,可形成不同的信使RNA。
第三節 RNA的複製 其RNA是單鏈,
正鏈 ,侵入大腸桿菌後立即翻譯,產生複製酶的b亞基,與宿主的三個亞基(α為
核糖體蛋白 ,γ、δ均為
肽鏈 延長因子 )構成複製酶,進行複製。先以正鏈為
模板合成 負鏈 ,再根據負鏈合成正鏈。合成負鏈時需要宿主的兩個蛋白因子,合成正鏈則不需要,所以可大量合成。病毒的蛋白質合成受RNA高級結構的調控。
二、病毒RNA複製的主要方式
一病毒含正鏈RNA,先合成
複製酶 ,複製後合成其他蛋白質進行裝配。如
噬菌體 Qb及灰質炎病毒。
二病毒含負鏈和複製酶,先合成正鏈,再合成病毒蛋白和複製病毒RNA。如
狂犬病毒 。
三病毒含雙鏈RNA和複製酶,如
呼腸孤病毒 。先複製
正鏈 ,再翻譯成病毒蛋白,最後合成負鏈,形成雙鏈RNA分子。
四致癌RNA病毒:如
白血病病毒 和
肉瘤病毒 ,先
逆轉錄 生成DNA前病毒,再轉錄、翻譯。
核糖體:多肽合成場所,能與信使RNA結合 第四節 RNA生物合成的抑制劑 有些人工合成的鹼基類似物能幹擾和抑制核酸的合成。作用方式有以下兩類:
一作為代謝
拮抗物 ,直接抑制
核苷酸 生物合成 有關酶類。如6-巰基嘌呤進入體內後可轉變為巰基
嘌呤核苷酸 ,抑制嘌呤核苷酸的合成。可作為抗癌藥物,治療急性白血病等。此類物質一般需轉變為相應的核苷酸才能表現出抑制作用。
二進入核酸分子,形成異常RNA或DNA,影響核酸的功能並導致突變。5-氟
尿嘧啶 類似尿嘧啶,可進入RNA,與
腺嘌呤 配對或異構成
烯醇 式與
鳥嘌呤 配對,使A-T對轉變為G-C對。因為正常細胞可將其分解,而癌細胞不能,所以可選擇性抑制癌細胞生長。
二、DNA模板功能抑制物
二
放線菌 素類:可與DNA形成非
共價 複合物,抑制其模板功能。包括一些抗癌抗生素。
三嵌入染料:含有扁平芳香族發色團,可插入雙鏈DNA相鄰鹼基對之間。常含丫啶或菲啶環,與鹼基大小類似,可在複製時增加一個核苷酸,導致
移碼突變 。如
溴乙啶 。
三、RNA聚合酶抑制劑
二利鏈菌素:與細菌RNA聚合酶b
亞基 結合,抑制RNA鏈的延長。
結構與功能 從 (DNA)
轉錄 合成的帶有
遺傳信息 的一類單鏈(RNA),他作為蛋白質合成的模板,決定了核糖體合成
肽鏈 的種類。1961年F.雅各布和根據大腸桿菌
誘導酶 生成的實驗結果提出:信息從DNA到蛋白質之間的轉移,必需有一種RNA起傳遞作用,由此提出了信使
核糖核酸 的名稱。
生物體內的每種多肽鏈都由特定的mRNA編碼,所以細胞內mRNA的種類很多,但通常每種mRNA的拷貝數極少(1~10個)。根據信息密碼學說,3個連續的
核苷酸 可以編碼一個
胺基酸 ,因此從已知mRNA(或DNA)核苷酸順序可以準確推導出蛋白質的
一級結構 。
存在範圍和性質 mRNA存在於
原核 和
真核生物 的細胞質及
真核細胞 的某些
細胞器 (如和)中。RNA病毒和RNA
噬菌體 中的 RNA既是
遺傳信息 的載體又具有mRNA的功能。生物體mRNA種類的多少與生物進化水平有關,高等生物所含的遺傳信息多,mRNA的種類也多。生物體內某種mRNA的含量根據需要而有不同,如5齡蠶後部絲腺體的主要任務是快速合成大量
絲心蛋白 ,因而編碼絲心蛋白的mRNA含量特別多。有些細菌需要不斷適應外部環境,其體內編碼某些
誘導酶 的mRNA的含量也較多。
原核和真核生物mRNA不同的特點 ①原核生物mRNA常以
多順反子 (見)的形式存在,即一條mRNA鏈編碼幾種功能相關聯的蛋白質。真核生物mRNA一般以單順反子的形式存在,即一種mRNA只編碼一種蛋白質。②原核生物mRNA的轉錄與翻譯一般是偶聯的,即轉錄尚未完畢,蛋白質的轉譯合成就已開始
真核生物 轉錄的mRNA前體則需經後加工,加工為成熟的mRNA與蛋白質結合生成信息體後才開始工作 信息體中蛋白質與RNA之比約為3。③原核生物mRNA半壽期很短,一般為幾分鐘,最長只有數小時(RNA噬菌體中的RNA除外)。真核生物mRNA的半壽期較長,如胚胎中的mRNA可達數日。④原核與真核生物mRNA的結構特點也不同。
一級結構與功能的關係 原核生物mRNA一般5'端有一段不翻譯區,稱前導順序,3'端有一段不翻譯區,中間是蛋白質的編碼區,一般編碼幾種蛋白質。如大腸桿菌
乳糖操縱子 mRNA編碼3條多
肽鏈 ;
色氨酸操縱子 mRNA編碼5條多肽鏈。也有
單順反子 形式的細菌mRNA,如大腸桿菌脂蛋白mRNA。原核生物mRNA分子中一般沒有修飾核苷酸,也沒有5'端
帽子結構 和3'端聚
腺苷酸 尾巴。在
原核生物 mRNA的
起始密碼子 (AUG)附近(5'方向上游)的一小段長短不等的順序,含有較多的
嘌呤核苷酸 ,被稱為SD順序。它能和
核糖體 小亞基 上的16SrRNA的3'端富含
嘧啶核苷酸 的區域配對結合,有助於帶有
甲醯甲硫氨酸 的起始tRNA識別mRNA上的起始密碼(AUG),使
肽鏈 合成從此開始。這段順序是1974年由J.夏因和L.達爾加諾發現的,所以稱為SD順序,也稱核糖體結合部位。原核生物mRNA的編碼區一般編碼幾種功能上相關聯的蛋白質,兩種蛋白質的編碼區之間常有一小段不翻譯的順序,叫做
間隔區 。有的
噬菌體 RNA中2個相鄰的
順反子 共用一段相同的編碼順序,例如,M 噬菌體RNA中的溶菌蛋白
編碼區 共225個核苷酸中有189個核苷酸是由相鄰兩個蛋白質共用的。原核mRNA與真核mRNA一樣使用同一套三聯體
密碼子 (
真核生物 線粒體 mRNA有例外)。原核生物合成
胺基酸 的操縱子mRNA的5' 端前導順序上有一段順序稱作
弱化子 。弱化子具有兩種可以互變的
構象 ,其中一種構象是
轉錄終止 的信號,能使轉錄中止(或衰減)。衰減調節是原核生物合成胺基酸的調控方式之一(見)。
真核生物 mRNA(細胞質中的)一般由5'端帽子結構、5'端不翻譯區、翻譯區(
編碼區 )、3'端不翻譯區和3'端聚
腺苷酸 尾巴構成(圖1a[
真核生物 mRNA結構示意圖 a
一級結構 示意圖])。分子中除 G構成帽子外,常含有其他修飾
核苷酸 ,如 A等。5'端帽子結構通常有3種類型,即:G(5')ppp(5')N; G(5')ppp(5') N和 G(5')ppp(5') N。圖1b[真核生物mRNA結構示意圖b 5'端帽子結構式,,表示
鹼基 ],表示鹼基" class=image>[] 是帽子的化學結構,N右邊的m代表
核糖 2'位羥基的
甲基化 。
真核細胞 線粒體 中的mRNA無帽子結構。一般認為帽子的功能與翻譯的啟動有關。許多
真核生物 mRNA(如珠蛋白mRNA)除去帽子後翻譯效率大大降低。5'端不翻譯區,也叫前導順序。不同的真核mRNA的前導順序長度不同,有的只有10個
核苷酸 ,有的則有200個核苷酸。與原核mRNA相似,真核mRNA5'端不翻譯區中常有一段順序與
核糖體 小亞基 上的18SrRNA的3'端的一段順序互補並結合,這種結合與真核mRNA的翻譯啟動有關。
翻譯區(
編碼區 )使用的密碼子除
線粒體 (如人、牛和酵母線粒體)外與
原核生物 mRNA是一樣的。真核生物mRNA的
起始密碼子 都是AUG。真核和原核生物mRNA使用的
密碼子 也都有“
簡併 現象”,即幾種不同的密碼子翻譯出同一種
胺基酸 ,但不同的mRNA中
簡併密碼子 的利用率是不同的,真核與原核生物之間的差別就更大。mRNA的
終止密碼子 有3個(UAG、UGA和UAA),其功能是停止翻譯,一般只用一個終止密碼子就能使翻譯停止。有的mRNA有2個連續的終止密碼子(見)。3'端不翻譯區的長短在不同的mRNA上有所不同,β
珠蛋白 mRNA只有39個核苷酸,而
卵白蛋白 mRNA則有637個核苷酸。真核生物mRNA3'端不翻譯區常有 AAUAA(A)或AUUUA(A)等順序,它們和識別多聚A
聚合酶 及裝配多聚A尾巴有關。除個別組蛋白mRNA外,
真核生物 mRNA3'端均有多聚A尾巴 3'端多聚A尾巴的長度隨來源不同而不同,且隨mRNA的老化而變短,通常有20~200個A。多聚A與
mRNA穩定性 及mRNA從細胞核轉到細胞漿中有關。
真核生物mRNA的前體 真核生物mRNA通常都有相應的前體。從DNA轉錄產生的原始轉錄產物可稱作原始前體(或mRNA前體)。一般認為原始前體要經過hnRNA核不均-RNA的階段,最終才被加工為成熟的 mRNA。hnRNA上的蛋白質
編碼區 被一些居間順序分隔成若干段;不同的
基因轉錄 產物所含的居間順序的數目不同,人胰島素只有兩個,而牛眼的
晶體蛋白 則含有數十個;居間順序的長短也各不相同,從數十個到上千個
核苷酸 (雞
卵白蛋白 有一個1550個核苷酸的居間順序)。居間順序將在剪接過程中去除。約有10~40%的hnRNA含有3′端多聚A尾巴。hnRNA經過進一步加工切除居間順序並把分隔的蛋白質
編碼區連線 起來,最終成為成熟的mRNA。
二級結構與功能的關係 通常mRNA(單鏈)分子自身回折產生許多雙鏈結構(圖2 [噬菌體M RNA中成熟蛋白] RNA中成熟蛋白" class=image>[編碼區的二級結構及外殼蛋白的
起始密碼子 AUG的位置])。
原核生物 ,例如M 噬菌體RNA外殼蛋白
編碼區 ,經計算有66.4%的核苷酸以雙鏈結構的形式存在。M RNA能翻譯4種蛋白質,但效率各不相同。在通常條件下翻譯外殼蛋白(其編碼區在成熟蛋白的下游)的效率高於成熟蛋白的效率。但用甲醛處理M RNA破壞
二級結構 後,則翻譯成熟蛋白的效率提高。圖2[噬菌體M RNA中成熟蛋] RNA中成熟蛋" class=image>[白編碼區的二級結構及外殼蛋白的
起始密碼子 AUG的位置] 中外殼蛋白的起始密碼子 AUG(1335~1337)通常處於環(Loop)的頂端,暴露在外面,因而易於與翻譯的啟動因子結合而進行翻譯。成熟蛋白的
編碼區 儘管處在外殼蛋白的前面,但其起始密碼子GUG(130~132)卻埋在二級結構之中,故翻譯效率低,只有將二級結構鬆開(如甲醛處理)之後才能被翻譯。可見mRNA分子的二級結構對翻譯蛋白質的效率有很大影響。
DNA表達的信息需轉給一種“信使RNA” 真核生物mRNA也具有豐富的
二級結構 ,如鴨
珠蛋白 mRNA和兔珠蛋白mRNA分別有45~60%和55~62%的
核苷酸殘基 處在
鹼基配對 之中。在
真核生物 蛋白質啟動複合物中,40S
核糖體 實際上覆蓋著mRNA上包括
帽子結構 在內的50~54個核苷酸,但是40S核糖體的大小比50個核苷酸的長度小得多 由於形成的
髮夾結構 (二級結構使帽子與起始密碼子之間的
空間距離 縮短)(圖3[真核生物mRNA ]),造成40S核糖體能夠覆蓋包括帽子結構和起始密碼子 AUG在內的50多個核苷酸,從而啟動
蛋白質合成 。不同的mRNA中髮夾結構的有無或多少各不相同。在蛋白質合成
肽鏈 繼續延伸時,不需要帽子結構參加,此時核糖體覆蓋的mRNA的區域約為25~35個核苷酸,mRNA的構象已不同於啟動階段而是處於一種伸展的狀態,從而有利於轉譯的延續。可見,摺疊起來的mRNA二級結構有利於蛋白質合成的啟動,以後mRNA處於伸展的狀態則有利於轉譯的繼續。
信使與密碼子 簡介 遺傳信息從DNA分子抄錄到RNA分子中的過程稱為
轉錄 (transcription)。在
真核生物 中,最初轉錄生成的RNA稱為核不均一RNA(heterogeneous nuclear RNA,hnRNA),然而在細胞漿中起作用,作為蛋白質的
胺基酸 序列合成模板的是mRNA(messenger RNA)。hnRNA是mRNA的未成熟前體。兩者之間的差別主要有兩點:一是hnRNA核苷酸鏈中的一些片段將不出現於相應的mRNA中,這些片段稱為
內含子 (intron),而那些保留於mRNA中的片段稱為
外顯子 (exon)。也就是說,hnRNA在轉變為mRNA的過程中經過剪接,被去掉了一些片段,餘下的片段被重新連線在一起;二是mRNA的5′末端被加上一個m7pGppp帽子,在mRNA3′末端多了一個多聚
腺苷酸 (polyA)尾巴。mRNA從5′末端到3′末端的結構依次是5′帽子結構,5′末端
非編碼區 ,決定多肽
胺基酸 序列的編碼區,3′末端非編碼區,和多聚腺苷酸尾巴。多聚腺苷酸尾一般由數十個至一百幾十個腺苷酸連線而成。隨著mRNA存在時間的延續,這段聚A尾巴慢慢變短。因此,目前認為這種3′末端結構可能與增加
轉錄 活性以及使mRNA趨於相對穩定有關。原核生物的mRNA沒有這種首、尾結構。
1961年,Jacob和Monod首先提出了mRNA的概念。在
真核細胞 中,由於蛋白質是在胞漿中而不是在核內合成,因此顯然要求有一個中間物將DNA上的
遺傳信息 傳遞至胞漿中。後來的研究證實,這種中間物即信使RNA.?mRNA的
核苷酸序列 與DNA序列相應,決定著合成蛋白質的胺基酸序列。它如何指導
胺基酸 以正確的順序連線起來呢?不同的mRNA
鹼基組成 和排列順序都不同,但都只有A,G,C,U4種鹼基。如果一個鹼基就可以決定一個胺基酸,則只有四種變化方式,如果兩個鹼基決定一個胺基酸,則只有16種變化方式,都不能滿足20種胺基酸的需要。1961年Crick和Brenner的實驗得出了三個
核苷酸 編碼一個胺基酸的結論,並將這種三位一體的核苷酸編碼稱做
遺傳密碼 (genetic code)或
三聯體密碼 ,這樣就可以有64種不同的密碼,但此情況下必須假定有一些胺基酸使用兩個以上的密碼。這一假定很快就被證明是對的。
遺傳密碼具有下列特徵: 1.三個核苷酸組成一個
密碼子 ,每個密碼子由三個前後相聯的核苷酸組成,一個密碼子只為一種
胺基酸 編碼。共有64個密碼子;
3.一種胺基酸可有多個密碼子,這個特點稱為密碼子的
簡併性 ;
4.密碼子的通用性,所有生物從最低等的病毒直至人類,蛋白質合成都使用同一套密碼子表(表15-8),僅有極少的例外,如特殊
細胞器 線粒體 ,
葉綠體 所用的密碼稍有不同。
通用遺傳密碼及相應的胺基酸 U C A G
苯丙氨酸 絲氨酸 酪氨酸 半胱氨酸 C
亮氨酸 脯氨酸 組氨酸 精氨酸 C
異亮氨酸 蘇氨酸 天冬醯胺 絲氨酸 C
異亮氨酸 蘇氨酸 賴氨酸 精氨酸 A
蛋氨酸 蘇氨酸 賴氨酸 精氨酸 G
纈氨酸 丙氨酸 天冬氨酸 甘氨酸 C
纈氨酸 丙氨酸 谷氨酸 甘氨酸 G
哺乳動物 果蠅 酵母菌 植物
AUA
異亮氨酸 蛋氨酸 蛋氨酸 蛋氨酸 異亮氨酸
註:下標橫線者為與通用編碼不同的編碼
究竟哪一個密碼子為哪一種
胺基酸 編碼,即密碼子與胺基酸之間的對應關係已在60年代研究解決了。1964年Nirenberg用一種RNA聚合酶體外合成了
多聚尿苷酸 、多聚
腺苷酸 等
多聚核苷酸 ,將這些多聚核苷酸分別用於蛋白質的體外合成。發現,當所用的多聚核苷酸為多聚尿苷酸時,只有多聚苯丙氨酸合成,這意味著UUU為苯丙氨酸編碼;用其它多聚核苷酸進行相應的實驗後發現,CCC為脯氨酸編碼,而AAA為賴氨酸編碼;其後,有人又用核苷酸比例為已知,但是
核苷酸序列 隨機的多聚核苷酸,以及用已知序列的含兩種或兩種以上核苷酸的多聚核苷酸進行相應的實驗,將結果加以數理統計處理,又解讀了一批
密碼子 ,其中包括三個終止碼,最後,還有一些密碼子是通過合成已知序列的三聚核苷酸與
核蛋白體 和載有放射性同位素標記的
胺基酸 的tRNA共沉澱原理予以解讀的。在所有密碼子中,AUG不僅為蛋氨酸編碼,而且又是翻譯(translation,以mRNA上的
遺傳信息 指導核蛋白體上多
肽鏈 合成的過程)的起始信號,UAA、UAG和UGA不為任何胺基酸編碼,而是作為翻譯的
終止信號 ,統稱為終止碼(stop codon),又常被叫作無意義碼(nonsense codon)。
大多數
胺基酸 是由一個以上的
密碼子 所編碼。這個事實提出了一個問題:編碼同一種胺基酸的一組密碼子的使用頻率是否都相同?細緻的分析表明,無論是
原核生物 ,還是高等
真核生物 ,密碼子的使用頻率並不是平均的,有些密碼子的使用率很高,有些則幾乎不使用,其使用頻率主要與細胞內tRNA含量呈正相關。
傳遞 簡介 在原核和
真核生物 中,轉錄過程是相似的。包括DNA變性,RNA聚合酶結合在單鏈DNA上以5′→3′方向合成RNA分子。雙鏈中只有一條鏈作為轉錄模板,合成單鏈RNA分子。
啟動子 和
終止子 序列決定轉錄的起始和終止。
在E.coli中RNA多聚酶轉錄各種RNA(mRNA,tRNA和rRNA)。在真核細胞中有三類不同的RNA多聚酶,它們的功能不同。RNA pol Ⅰ轉錄4種rRNA中的3種;RNA pol Ⅱ轉錄mRNA和一些snRNA;RNAⅢ轉錄第四種rRNA,tRNA以及其餘的snRNA。
3種
真核生物 的RNA pol,不像E.coli RNA pol,沒有一個直接地和啟動子區結合,而是通過
轉錄起始因子 的介導來起始RNA的合成。對於每一種RNA多聚酶來說,
轉錄因子 是特異的,它可以識別
啟動子 的特殊序列。
由RNA pol Ⅲ
轉錄 的啟動子,位於下游,在其基因
編碼序列 內部。這種啟動子,根據所轉錄的RNA的種類,由不同的功能區組合而構成。轉錄因子識別這些功能區,促進RNA聚合酶轉錄起始。
18S,5.8S和28S rRNA作為一個
轉錄單位 一道轉錄,產生前體RNA分子。大部分
真核生物 的18S,5-8S和28S rRNA都是以串聯
重複排列 ,每個重複單位被不轉錄的間隔序列(nontranscribed specer,NTs)所分隔。轉錄單位的
啟動子 位於NTS中,其功能是和特異的
轉錄因子 相結合,促進RNA pol Ⅰ的
轉錄起始 。
中心法則的提出 從孟德爾定律問世以後,人們就知道了生物的各種性狀是由
基因 控制的。一基因一酶學說的建立進一步地明確了基因是以酶的形式通過控制生化反應鏈來控制的。酶或蛋白和基因又是什麼樣的關係呢?也就是說
遺傳信息 怎樣傳遞,怎樣表達成性狀呢?就在Watson和Crick建立DNA雙螺旋模型後的第三年,1957年Crick提出了中心法測(central dogma),指出了遺傳信息的傳遞方向:
DNA → RNA→蛋白質
1970年H.Temin和D.Baltimore發現了
反轉錄酶 後,Crick對中心法測又作了部分修改:
DNA RNA →蛋白質
也就是說由DNA通過
轉錄 將
遺傳信息 傳遞給RNA,RNA通過翻譯把信息傳遞給蛋白。通過這種單向的傳遞,遺傳信息通過蛋白質的不同形式,如酶,結構蛋白,運載蛋白,調節蛋白等表達成一種性狀。
與轉運區別 區分mRNA和tRNA,可以從結構和功能這兩個方面去把握。
結構 mRNA的一級結構,tRNA的二級、三級結構是經常考察的內容,需要仔細區分。
⑴
真核生物 的mRNA的5' 端有帽子結構,3' 端為多聚
腺苷酸 (poly(A))尾巴。
⑵tRNA的二級結構呈三葉草形。三葉草形結構由
胺基酸臂 、
二氫尿嘧啶環 、反密碼環、額外環和TφC環等5個部分組成。其中,胺基酸臂末端為CCA;反密碼環中部為
反密碼子 ,由3個
鹼基組成 。反密碼子可識別mRNA的密碼子。
⑶tRNA摺疊形成
三級結構 。tRNA的三級結構呈倒L形,反密碼環和胺基酸臂分別位於倒L的兩端。
功能 ⑴mRNA是合成蛋白質的直接模板。每一種多
肽鏈 都有一種特定的mRNA做模板,因此細胞內mRNA的種類也是很多的。它將DNA上的
遺傳信息 轉錄 下來,攜帶到
核糖體 上,在那裡以密碼的方式控制蛋白質分子中
胺基酸 的排列順序,作為蛋白質合成的直接模板。
⑵tRNA的功能是轉運胺基酸。在
蛋白質合成 過程中,tRNA與合成蛋白質所需的單體——胺基酸形成複合物,將胺基酸轉運到核糖體中mRNA的特定位置上。
與反轉錄 簡介 1.概念
反轉錄 是以RNA為
模板合成 DNA的過程,也稱
逆轉錄 。這是DNA生物合成的一種特殊方式。
信使RNA 2.反轉錄酶與反轉錄過程
反轉錄過程由反轉錄酶催化,該酶也稱依賴RNA的DNA聚合酶(RDDP),即以RNA為模板催化DNA鏈的合成。合成的DNA鏈稱為與RNA
互補DNA (cDNA)。
反轉錄酶 存在於一些RNA病毒中,可能與病毒的惡性轉化有關。人類免疫缺陷病毒(HIV)也是一種RNA病毒,含有反轉錄酶。在小鼠及人的正常細胞和胚胎細胞中也有反轉錄酶,推測可能與
細胞分化 和
胚胎髮育 有關。
生物學意義 反轉錄的發現有重要的理論意義和實踐意義。
1.對分子生物學的
中心法則 進行了修正和補充,修正後的中心法則表示為:
2.在致癌病毒的研究中發現了
癌基因 ,在人類一些癌細胞如膀胱癌、小細胞肺癌等細胞中,也分離出與
病毒癌基因 相同的鹼基序列,稱為
細胞癌基因 或
原癌基因 。癌基因的發現為腫瘤發病機理的研究提供了很有前途的線索。
3.在實際工作中有助於基因工程的實施。由於
目的基因 的
轉錄 產物易於製備,可將mRNA
反向轉錄 形成DNA用以獲得目的基因。
可扼殺信使 microRNA雖然只有19-21個核苷長度,但能夠通過綁定和中和負責蛋白翻譯的信使RNA,沉默大片段基因。迄今發現的microRNA已達到幾百種,它們在基因組中的調節作用日益引起人們關注。
最近,Wistar研究所的研究人員發現microRNA會經歷一種生理學後果嚴重的分子編輯過程(molecular editing),序列的一個替換會改變這些microRNA的作用靶標,抑制非預期匹配物的表達,編輯過程出錯會導致嚴重的健康問題。詳細內容刊登於2月23日《Science》雜誌。
“我們發現,某些情況下已編輯的microRNA版本與未經編輯的版本只有一個
核苷 差異,”文章高級作者、Wistar研究所
基因表達 和校準程式教授 Kazuko Nishikura博士說,“這些已編輯的microRNA不是由DNA編碼的,意味著至少兩個版本來自於同一個基因,這是未曾料到的……進一步觀察,我們發現替換隻出現在分子的特定關鍵區域,總共19或21個核苷長度分子的第7或8位核苷,這兩個位點規定了靶標的特異性。提示替換可能會使已編輯的microRNA與未編輯的microRNA沉默完全不同的靶標。”
利用生物信息學工具將一種microRNA的已編輯版本和未編輯版本與已知的基因
序列資料庫 比對,研究人員鑑別出分別是兩種不同版本分子的靶標的兩組完全不同的基因,並從每組中分別挑選出三個基因,進一步觀察microRNA是否會改變這些基因的表達效果。
接下來,研究人員隨機挑選出一個預期的靶標
基因 ,探測microRNA的衍生物的潛能。所挑選的基因為PRPS1,其所編碼的酶在尿酸合成中發揮關鍵作用。如果調節此酶不當,多種健康問題會接踵而來。比如,表達量過高會引起血液中尿酸水平上升,引起風濕痛;大腦中尿酸水平過高會損傷感覺神經元,引起失聰。
在不能進行RNA編輯(RNA editing)的轉基因小鼠和正常小鼠身上的實驗顯示,完全缺乏已編輯版本microRNA的小鼠,PRPS1酶水平是對照組的2倍,尿酸水平也是對照組的2倍。
Nishikura 說這些證實,最初計算機所預測的同一基因編碼的未經編輯的、已編輯的microRNA的不同靶標是正確的。至少對於PRPS1來說是正確的,未經編輯的和已編輯的microRNA的差異的生理學效果在尿酸水平的上升程度上顯示出來。
即便說PRPS1基因是研究人員隨機挑選的,但研究結果提示一系列其它迄今原因未明的疾病很有可能是由新發現的microRNA編輯過程引起的。
提取分離純化 真核細胞的mRNA分子最顯著的結構特徵是具有5’端帽子結構(m7G)和3’端的Poly(A)尾巴。絕大多數哺乳類動物細胞mRNA的3’端存在20-30個腺苷酸組成的Poly(A)尾,通常用Poly(A+)表示。這種結構為真核mRNA的提取,提供了極為方便的選擇性標誌,寡聚(dT)纖維素或寡聚(U)瓊脂糖親合層析分離純化mRNA的理論基礎就在於此。mRNA的分離方法較多,其中以寡聚(dT)-纖維素柱層析法最為有效,已成為常規方法。此法利用mRNA 3’末端含有Poly(A+)的特點,在RNA流經寡聚(dT)纖維素柱時,在高鹽緩衝液的作用下,mRNA被特異地結合在柱上,當逐漸降低鹽的濃度時或在低鹽溶液和蒸餾水的情況下,mRNA被洗脫,經過兩次寡聚(dT)纖維柱後,即可得到較高純度的mRNA。寡聚(dT)纖維素柱純化mRNA
試劑準備 1.3M醋酸鈉(pH 5.2) 2.0.1M NaOH 3.1×上樣緩衝液:20mM Tris-HCl(pH 7.6);0.5M NaCl;1M EDTA(pH 8.0);0.1%SLS(十二烷基氨酸鈉。配製時可先配製Tris-HCl(pH 7.6)、NaCl、EDTA(pH 8.0)的母液,經高壓消毒後按各成分確切含量,經混合後再高壓消毒,冷卻至65℃時,加入經65℃溫育(30min)的10%SLS至終濃度為0.1%。4.洗脫緩衝液:10mM Tris-HCl(pH 7.6);1mM EDTA(pH 8.0);0.05% SDS 5.無水乙醇、70%乙醇 6.DEPC
操作步驟 1.將0.5-1.0g寡聚(dT)-纖維懸浮於0.1M的NaOH溶液中。2.用DEPC處理的1ml注射器或適當的吸管,將寡聚(dT)-纖維素裝柱0.5-1ml,用3倍柱床體積的DEPC H2O洗柱。3.使用1×上樣緩衝液洗柱,直至洗出液pH值小於8.0。4.將RNA溶解於DEPC H2O中,在65℃中溫育10min左右,冷卻至室溫後加入等體2×上樣緩衝液,混勻後上柱,立即收集流出液。當RNA上樣液全部進入柱床後,再用1×上樣緩衝液洗柱,繼續收集流出液。5.將所有流出液於65℃加熱5min,冷卻至室溫後再次上柱,收集流出液。6.用5-10倍柱床體積的1×上樣緩衝液洗柱,每管1ml分部收集,OD260測定RNA含量。前部分收集管中流出液的OD260值很高,其內含物為無Poly(A)尾的RNA。後部分收集管中流出液的OD260值很低或無吸收。7.用2-3倍柱容積的洗脫緩衝液洗脫Poly(A+)RNA,分部收集,每部分為1/3-1/2柱體積。8.OD260測定Poly(A+)RNA分布,合併含Poly(A+)RNA的收集管,加入1/10體積3M NaAc(pH5.2)、2.5倍體積的預冷無水乙醇,混勻,-20℃放置30min。9.4℃離心,10000g×15min,小心吸棄上清。用70%乙醇洗滌沉澱。[注意:此時Poly(A+)RNA的沉澱往往看不到]。4℃離心,10000g×5min,棄上清,室溫晾乾。10. 用適量的DEPC H2O溶解RNA。
注意事項 1.整個實驗過程必須防止Rnase的污染。2.步驟⑷中將RNA溶液置65℃中溫育然後冷卻至室溫再上樣的目的有兩個,一個是破壞RNA的二級結構,尤其是mRNA Poly(A+)尾處的二級結構,使Poly(A+)尾充分暴露,從而提高Poly(A+)RNA的回收率;另一個目的是能解離mRNA與rRNA的結合,否則會導致rRNA的污染。所以此步驟不能省略。3.十二烷基肌氨酸鈉鹽在18℃以下溶解度下降,會阻礙柱內液體流動,若室溫低於18℃最好用LiCl替代NaCl。4.寡聚(dT)-纖維素柱可在4℃貯存,反覆使用。每次使用前應該依次用NaOH、滅菌 ddH2O、上樣緩衝液洗柱。5.一般而言,107哺乳動物培養細胞能提取1-5μg Poly(A+)RNA,約相當於上柱總RNA量的1%-2%。
 信使RNA
信使RNA DNA表達的信息需轉給一種“信使RNA”
DNA表達的信息需轉給一種“信使RNA”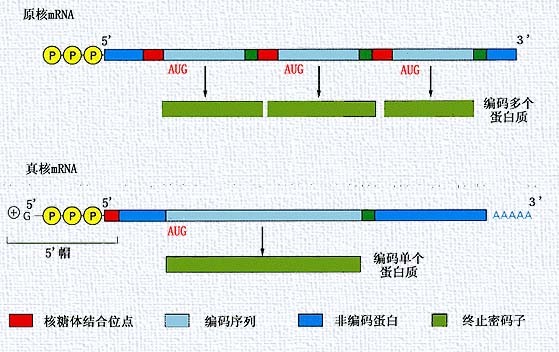
 信使RNA
信使RNA DNA表達的信息需轉給一種“信使RNA”
DNA表達的信息需轉給一種“信使RNA”