電離,就是指電解質(分子:如乙酸(醋酸)CH3COOH(C2H4O2)、一水合氨(氨水)NH3·H2O、氫硫酸(硫化氫)H2S、氫氯酸(鹽酸 氯化氫)HCl等;晶體,如NaCl、NH4NO3等)在水溶液中或熔融狀態下產生自由離子的一種過程。
電離(Ionization),或稱電離作用、離子化,是指在(物理性的)能量作用下,原子、分子形成離子的過程。是指原子或分子獲得一個負或正電荷的獲得或失去電子形成離子,通常與其他化學變化的結合。電離導致的電子的損失後的亞原子粒子碰撞,碰撞與其他原子,分子和離子,或通過與光的相互作用。異裂和雜原子取代反應可導致離子對的形成。電離能發生放射性衰變的內部轉換過程,並將其能量激發原子核的內層電子使其噴出。
電離大致可細分為兩種類型:一種連續電離(sequential ionization)和非連續電離(Non-sequential ionization)。在經典物理學中,只有連續電離可以發生。非連續電離則違返了若干物理定律,屬於量子電離。
例如:
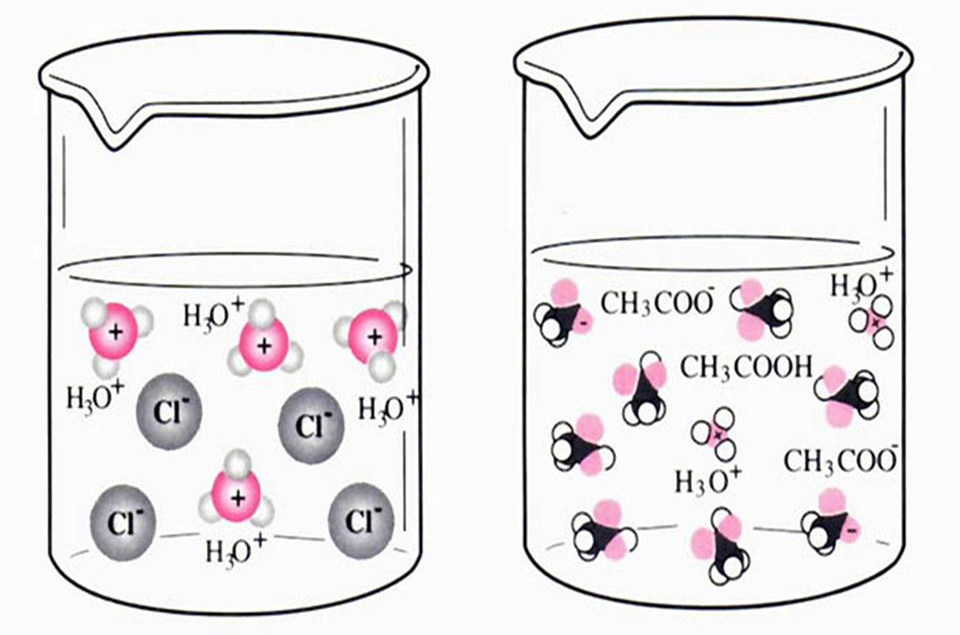
1、在水溶液中,由於水分子的作用,HCl全部離解成H+和Cl−,因此被定義為強酸
2、在水溶液中,由於水分子的作用,CH3COOH部分離解成H+和CH3COO−,因此被定義為弱酸
3、在光照或高能射線輻射下,氣態原子、分子失去電子變成離子
基本介紹
- 中文名:電離
- 外文名:Ionization
- 分類:化學過程
- 套用:廣泛套用於工業生產方面
簡介
電離的定義
陰陽離子
 原子
原子經典電離
日常使用
電離的產生
 1
1