元素呈氣態時,從它的一個原子或陽離子中將一個電子移至無窮遠處時所需做的功,稱為該元素的電離勢,單位為電子伏特(ev)。氣態電中性基態原子失去一個電子轉化為氣態基態正離子所需要的能量叫做第一電離能。簡言之,第一電離能就是原子失去電子所需要的最低能量。
基本介紹
- 中文名:電離勢
- 外文名:ionization potential
- 單位:電子伏特(ev)
- 計算公式:I1=E(A+)-E(A)
概述,基本原理,
概述
元素呈氣態時,從它的一個原子或陽離子中將一個電子移至無窮遠處時所需做的功,稱為該元素的電離勢,單位為電子伏特(ev)。當原子失去第一個電子成為一價陽離子時,所需的能量為元素的第一電離勢;當一價陽離子再失去一個電子成為二價陽離子時所需的能量為第二電離勢,余類推。第二電離勢高於第一電離勢,第三電離勢又高於第二電離勢,如此等等。通常所稱的電離勢一般都是指第一電離勢。電離勢愈小,表示愈易失去電子。金屬元素的電離勢比非金屬元素電離勢小。根據最新版本無機化學,電離勢即為電離能。
電離勢定義為:氣態電中性基態原子失去一個電子轉化為氣態基態正離子所需要的能量叫做第一電離能。簡言之,第一電離能就是原子失去電子所需要的最低能量。
基本原理
原子失去電子變成正離子時,電子必須消耗能量以克服原子核對電子的引力。1mol基態氣體原子失去1mol電子變成氣態正離子時消耗的能量稱為該元素的第一電離勢 (或電離能),常以
(或電離能),常以 為單位。
為單位。



元素原子的電離勢越小,說明元素越易失去電子,元素的金屬性、還原性越強。對於可失去多個電子的原子,按失去電子的先後次序,對應有第一電離勢( ),第二電離勢(
),第二電離勢( )等。由於價態越高的正電離子對核外電子的有效引力越大,且電子離核距離(相對於不同電子層的電子)越小,因此,總是
)等。由於價態越高的正電離子對核外電子的有效引力越大,且電子離核距離(相對於不同電子層的電子)越小,因此,總是



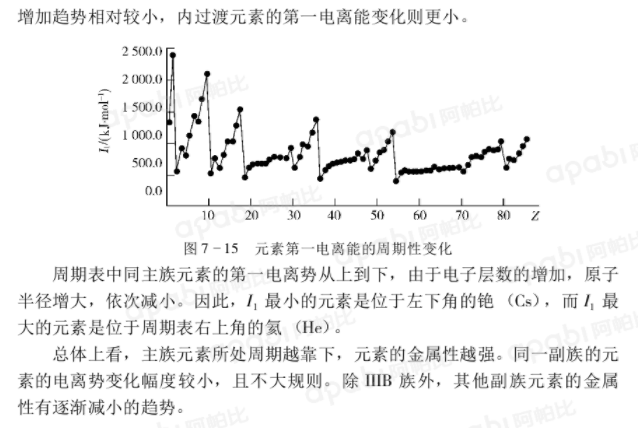
同一周期中元素的第一電離勢從左到右總體上呈增大趨勢,這主要是由於同一周期元素從左向右電子層數相同,但核電荷數依次增加,原子半徑依次減小,核外電子受到的引力也隨之加大。其中ⅡA,VA,ⅡB等出現的反常情況是由於這些元素具有洪特規則特例中描述的全充滿或半充滿的穩定結構。這些反常情況在第一電離勢圖中表現為兩個大峰之間出現的小峰。稀有氣體在同周期中第一電離勢最大。
同一周期過渡元素的第一電離能,由於受 軌道電子的禁止,從左向右的增加趨勢相對較小,內過渡元素的第一電離能變化則更小。
軌道電子的禁止,從左向右的增加趨勢相對較小,內過渡元素的第一電離能變化則更小。

周期表中同主族元素的第一電離勢從上到下,由於電子層數的增加,原子半徑增大,依次減小。因此, 最小的元素是位於左下角的銫(Cs),而
最小的元素是位於左下角的銫(Cs),而 最大的元素是位於周期表右上角的氦(He)。
最大的元素是位於周期表右上角的氦(He)。


總體上看,主族元素所處周期越靠下,元素的金屬性越強。同一副族的元素的電離勢變化幅度較小,且不大規則。除IIB族外,其他副族元素的金屬性有逐漸減小的趨勢。