基本介紹
- 中文名:電離度
- 外文名:ionization degree
- 套用領域:化學
- 表達式:a=n(已電離的電解質)/n總
定義和計算
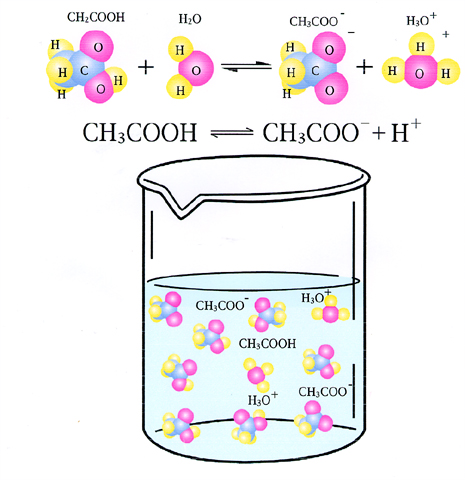 弱電解質的電離
弱電解質的電離





影響因素
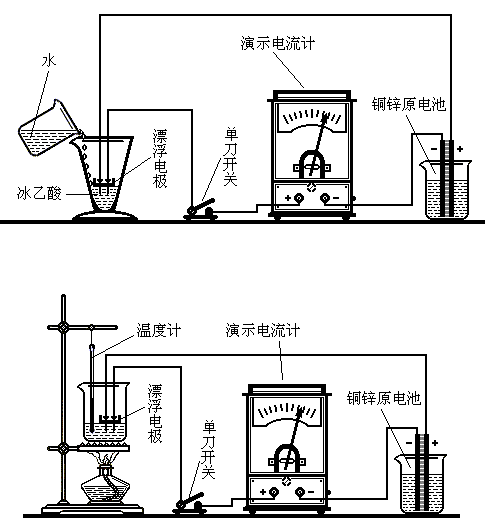 溫度和濃度對電離度影響的實驗探討
溫度和濃度對電離度影響的實驗探討
 弱電解質的電離
弱電解質的電離





 溫度和濃度對電離度影響的實驗探討
溫度和濃度對電離度影響的實驗探討不同的弱電解質在水中電離的程度是不同的,一般用電離度和電離常數來表示。電離度——弱電解質在溶液里達電離平衡時,已電離的電解質分子數占原來總分子數(包括已...
電離,就是指電解質(分子:如乙酸(醋酸)CH3COOH(C2H4O2)、一水合氨(氨水)NH3·H2O、氫硫酸(硫化氫)H2S、氫氯酸(鹽酸 氯化氫)HCl等;晶體,如NaCl、NH4NO3等)...
弱電解質在一定條件下電離達到平衡時,溶液中電離所生成的各種離子濃度以其在電離方程式中的計量數為冪的乘積,跟溶液中未電離分子的濃度以其在化學方程式中的計量數...
具有極性共價鍵的弱電解質(例如部分弱酸、弱鹼。水也是弱電解質)溶於水時,其分子可以微弱電離出離子;同時,溶液中的相應離子也可以結合成分子。一般地,自上述反應...
再電離是在大爆炸宇宙學的黑暗期(見宇宙黑暗時代)之後,宇宙中物質再電離的過程,並且是宇宙中氣體的兩次主要相變中的第二次。當主要的重子物質成為氫的形式,再...
電離層(Ionosphere)是地球大氣的一個電離區域。電離層(ionosphere) 受太陽高能輻射以及宇宙線的激勵而電離的大氣高層。60千米以上的整個地球大氣層都處於部分電離或...
電離學說,由瑞典物理學家阿倫尼烏斯創建,電離學說指電解質溶於水能不同程度地離解成正負離子;離解程度決定於物質的本性以及它們在溶液中的濃度,溶液越稀電離度...
阿倫尼烏斯電離理論(Arrhenius ionization theory)。瑞典化學家S.A.阿倫尼烏斯提出的電解質在溶液中自動離解成正、負離子的理論。...
電離時每個分子能電離出2個以上(包括2個)氫離子,且不完全電離的酸,我們稱為多元弱酸。多元弱酸的氫原子的分步電離(即先電離一個氫離子,再電離其他的氫離子)我們...
濃硫酸電離 性質 物理過程,化學過程 物質 濃硫酸 反應 吸熱當硫酸溶解於水時,一方面是硫酸分子擴散在水裡,在這個物理過程里,要吸收一定的熱量;另一方面又發生...
弱電解質在水溶液中只部分電離,絕大部分以分子形式存在,因此在弱電解質溶液中,弱電解質解離和生成始終在進行,並最終達到平衡,這種平衡稱為離解平衡。電解質達到...
1 Α α /'ælfə/ alpha 阿爾法 角度、係數、角加速度、第一個、電離度、轉化率 2 Β β /'bi:tə/ 或 /'beɪtə/ beta 貝塔 磁通係數...
加入含相同離子的電解質時,有鹽效應也有同離子效應,而後者的影響比前者大,故只能觀察到難溶物質的溶解度降低了。鹽效應使弱電解質電離度增大 ...
通常認為地面空氣是絕緣的,這是由於空氣中電離度較弱,帶電離子濃度低。但是在大尺度範圍,空氣中客觀存在的電離度引起的導電性引起了大氣電流,形成全球大氣電迴路。...
