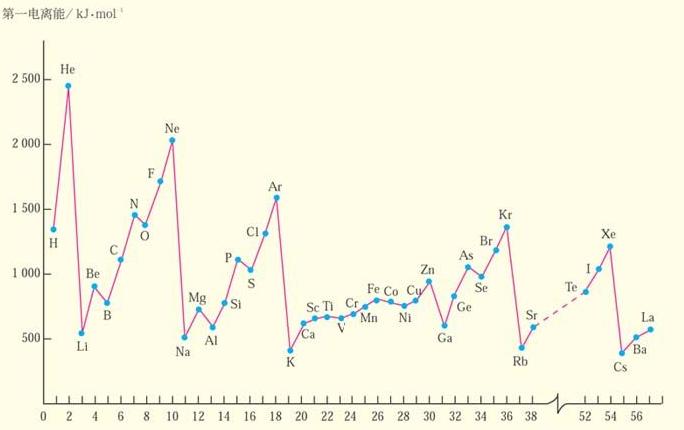
電離能是基態的氣態原子失去電子變為氣態陽離子(即電離),必須克服核電荷對電子的引力而所需要的能量。單位為kJ·mol-1(SI單位為J· mol-1)。對於多電子原子 , 處於基態的氣態原子生成 H +氣態陽離子所需要的能量, 稱為第一電離勢 ,常用符號 I1 表示 :M (g)——— M +(g)+e。第一電離勢 =I 1(1 可省去)。電離勢應該為正值因為從原子取走電子需要消耗能量。
基本介紹
- 中文名:電離能
- 外文名:Ionization Energy
- 定義:原子失去電子變為離子所需的能量
- 所屬類別:化學
- 拼音:diàn lí néng
- 涉及領域:化學 物理
形成原因
原子性質
重要概念
區別聯繫
基本關係
原子軌道能
軌道能
電離電子
實例計算
電離能列表
第1到10電離能
| 序號 | 符號 | 名稱 | 第一電離能 | 第二電離能 | 第三電離能 | 第四電離能 | 第五電離能 | 第六電離能 | 第七電離能 | 第八電離能 | 第九電離能 | 第十電離能 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
0 | Nu | 無電子 | ||||||||||
1 | H | 1312.0 | ||||||||||
2 | He | 2372.3 | 5250.5 | |||||||||
3 | Li | 520.2 | 7298.1 | 11,815.0 | ||||||||
4 | Be | 899.5 | 1757.1 | 14,848.7 | 21,006.6 | |||||||
5 | B | 800.6 | 2427.1 | 3659.7 | 25,025.8 | 32,826.7 | ||||||
6 | C | 1086.5 | 2352.6 | 4620.5 | 6222.7 | 37,831 | 47,277.0 | |||||
7 | N | 1402.3 | 2856 | 4578.1 | 7475.0 | 9444.9 | 53,266.6 | 64,360 | ||||
8 | O | 1313.9 | 3388.3 | 5300.5 | 7469.2 | 10,989.5 | 13,326.5 | 71,330 | 84,078.0 | |||
9 | F | 1681.0 | 3374.2 | 6050.4 | 8407.7 | 11,022.7 | 15,164.1 | 17,868 | 92,038.1 | 106,434.3 | ||
10 | Ne | 2080.7 | 3952.3 | 6122 | 9371 | 12,177 | 15,238 | 19,999.0 | 23,069.5 | 115,379.5 | 131,432 | |
11 | Na | 495.8 | 4562 | 6910.3 | 9543 | 13,354 | 16,613 | 20,117 | 25,496 | 28,932 | 141,362 | |
12 | Mg | 737.7 | 1450.7 | 7732.7 | 10,542.5 | 13,630 | 18,020 | 21,711 | 25,661 | 31,653 | 35,458 | |
13 | Al | 577.5 | 1816.7 | 2744.8 | 11,577 | 14,842 | 18,379 | 23,326 | 27,465 | 31,853 | 38,473 | |
14 | Si | 786.5 | 1577.1 | 3231.6 | 4355.5 | 16,091 | 19,805 | 23,780 | 29,287 | 33,878 | 38,726 | |
15 | P | 1011.8 | 1907 | 2914.1 | 4963.6 | 6273.9 | 21,267 | 25,431 | 29,872 | 35,905 | 40,950 | |
16 | S | 999.6 | 2252 | 3357 | 4556 | 7004.3 | 8495.8 | 27,107 | 31,719 | 36,621 | 43,177 | |
17 | Cl | 1251.2 | 2298 | 3822 | 5158.6 | 6542 | 9362 | 11,018 | 33,604 | 38,600 | 43,961 | |
18 | Ar | 1520.6 | 2665.8 | 3931 | 5771 | 7238 | 8781 | 11,995 | 13,842 | 40,760 | 46,186 | |
19 | K | 418.8 | 3052 | 4420 | 5877 | 7975 | 9590 | 11,343 | 14,944 | 16,963.7 | 48,610 | |
20 | Ca | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 | 10,496 | 12,270 | 14,206 | 18,191 | 20,385 | |
21 | Sc | 633.1 | 1235.0 | 2388.6 | 7090.6 | 8843 | 10,679 | 13,310 | 15,250 | 17,370 | 21,726 | |
22 | Ti | 658.8 | 1309.8 | 2652.5 | 4174.6 | 9581 | 11,533 | 13,590 | 16,440 | 18,530 | 20,833 | |
23 | V | 650.9 | 1414 | 2830 | 4507 | 6298.7 | 12,363 | 14,530 | 16,730 | 19,860 | 22,240 | |
24 | Cr | 652.9 | 1590.6 | 2987 | 4743 | 6702 | 8744.9 | 15,455 | 17,820 | 20,190 | 23,580 | |
25 | Mn | 717.3 | 1509.0 | 3248 | 4940 | 6990 | 9220 | 11,500 | 18,770 | 21,400 | 23,960 | |
26 | Fe | 762.5 | 1561.9 | 2957 | 5290 | 7240 | 9560 | 12,060 | 14,580 | 22,540 | 25,290 | |
27 | Co | 760.4 | 1648 | 3232 | 4950 | 7670 | 9840 | 12,440 | 15,230 | 17,959 | 26,570 | |
28 | Ni | 737.1 | 1753.0 | 3395 | 5300 | 7339 | 10,400 | 12,800 | 15,600 | 18,600 | 21,670 | |
29 | Cu | 745.5 | 1957.9 | 3555 | 5536 | 7700 | 9900 | 13,400 | 16,000 | 19,200 | 22,400 | |
30 | Zn | 906.4 | 1733.3 | 3833 | 5731 | 7970 | 10,400 | 12,900 | 16,800 | 19,600 | 23,000 | |
31 | Ga | 578.8 | 1979.3 | 2963 | 6180 | |||||||
32 | Ge | 762 | 1537.5 | 3302.1 | 4411 | 9020 | ||||||
33 | As | 947.0 | 1798 | 2735 | 4837 | 6043 | 12,310 | |||||
34 | Se | 941.0 | 2045 | 2973.7 | 4144 | 6590 | 7880 | 14,990 | ||||
35 | Br | 1139.9 | 2103 | 3470 | 4560 | 5760 | 8550 | 9940 | 18,600 | |||
36 | Kr | 1350.8 | 2350.4 | 3565 | 5070 | 6240 | 7570 | 10,710 | 12,138 | 22,274 | 25,880 | |
37 | Rb | 403.0 | 2633 | 3860 | 5080 | 6850 | 8140 | 9570 | 13,120 | 14,500 | 26,740 | |
38 | Sr | 549.5 | 1064.2 | 4138 | 5500 | 6910 | 8760 | 10,230 | 11,800 | 15,600 | 17,100 | |
39 | Y | 600 | 1180 | 1980 | 5847 | 7430 | 8970 | 11,190 | 12,450 | 14,110 | 18,400 | |
40 | Zr | 640.1 | 1270 | 2218 | 3313 | 7752 | 9500 | |||||
41 | Nb | 652.1 | 1380 | 2416 | 3700 | 4877 | 9847 | 12,100 | ||||
42 | Mo | 684.3 | 1560 | 2618 | 4480 | 5257 | 6640.8 | 12,125 | 13,860 | 15,835 | 17,980 | |
43 | Tc | 702 | 1470 | 2850 | ||||||||
44 | Ru | 710.2 | 1620 | 2747 | ||||||||
45 | Rh | 719.7 | 1740 | 2997 | ||||||||
46 | Pd | 804.4 | 1870 | 3177 | ||||||||
47 | Ag | 731.0 | 2070 | 3361 | ||||||||
48 | Cd | 867.8 | 1631.4 | 3616 | ||||||||
49 | In | 558.3 | 1820.7 | 2704 | 5210 | |||||||
50 | Sn | 708.6 | 1411.8 | 2943.0 | 3930.3 | 7456 | ||||||
51 | Sb | 834 | 1594.9 | 2440 | 4260 | 5400 | 10,400 | |||||
52 | Te | 869.3 | 1790 | 2698 | 3610 | 5668 | 6820 | 13,200 | ||||
53 | I | 1008.4 | 1845.9 | 3180 | ||||||||
54 | Xe | 1170.4 | 2046.4 | 3099.4 | ||||||||
55 | Cs | 375.7 | 2234.3 | 3400 | ||||||||
56 | Ba | 502.9 | 965.2 | 3600 | ||||||||
57 | La | 538.1 | 1067 | 1850.3 | 4819 | 5940 | ||||||
58 | Ce | 534.4 | 1050 | 1949 | 3547 | 6325 | 7490 | |||||
59 | Pr | 527 | 1020 | 2086 | 3761 | 5551 | ||||||
60 | Nd | 533.1 | 1040 | 2130 | 3900 | |||||||
61 | Pm | 540 | 1050 | 2150 | 3970 | |||||||
62 | Sm | 544.5 | 1070 | 2260 | 3990 | |||||||
63 | Eu | 547.1 | 1085 | 2404 | 4120 | |||||||
64 | Gd | 593.4 | 1170 | 1990 | 4250 | |||||||
65 | Tb | 565.8 | 1110 | 2114 | 3839 | |||||||
66 | Dy | 573.0 | 1130 | 2200 | 3990 | |||||||
67 | Ho | 581.0 | 1140 | 2204 | 4100 | |||||||
68 | Er | 589.3 | 1150 | 2194 | 4120 | |||||||
69 | Tm | 596.7 | 1160 | 2285 | 4120 | |||||||
70 | Yb | 603.4 | 1174.8 | 2417 | 4203 | |||||||
71 | Lu | 523.5 | 1340 | 2022.3 | 4370 | 6445 | ||||||
72 | Hf | 658.5 | 1440 | 2250 | 3216 | |||||||
73 | Ta | 761 | 1500 | |||||||||
74 | W | 770 | 1700 | |||||||||
75 | Re | 760 | 1260 | 2510 | 3640 | |||||||
76 | Os | 840 | 1600 | |||||||||
77 | Ir | 880 | 1600 | |||||||||
78 | Pt | 870 | 1791 | |||||||||
79 | Au | 890.1 | 1980 | |||||||||
80 | Hg | 1007.1 | 1810 | 3300 | ||||||||
81 | Tl | 589.4 | 1971 | 2878 | ||||||||
82 | Pb | 715.6 | 1450.5 | 3081.5 | 4083 | 6640 | ||||||
83 | Bi | 703 | 1610 | 2466 | 4370 | 5400 | 8520 | |||||
84 | Po | 812.1 | ||||||||||
85 | At | 899.003 | ||||||||||
86 | Rn | 1037 | ||||||||||
87 | Fr | 380 | ||||||||||
88 | Ra | 509.3 | 979.0 | |||||||||
89 | Ac | 499 | 1170 | 1900 | 4700 | |||||||
90 | Th | 587 | 1110 | 1978 | 2780 | |||||||
91 | Pa | 568 | 1128 | 1814 | 2991 | |||||||
92 | U | 597.6 | 1420 | 1900 | 3145 | |||||||
93 | Np | 604.5 | 1128 | 1997 | 3242 | |||||||
94 | Pu | 584.7 | 1128 | 2084 | 3338 | |||||||
95 | Am | 578 | 1158 | 2132 | 3493 | |||||||
96 | Cm | 581 | 1196 | 2026 | 3550 | |||||||
97 | Bk | 601 | 1186 | 2152 | 3434 | |||||||
98 | Cf | 608 | 1206 | 2267 | 3599 | |||||||
99 | Es | 619 | 1216 | 2334 | 3734 | |||||||
100 | Fm | 627 | 1225 | 2363 | 3792 | |||||||
101 | Md | 635 | 1235 | 2470 | 3840 | |||||||
102 | No | 642 | 1254 | 2643 | 3956 | |||||||
103 | Lr | 470 | 1428 | 2228 | 4910 | |||||||
104 | Rf | 579.9 | 1389.4 | 2296.4 | 3077.9 | |||||||
105 | Db | 664.8 | 1546.7 | 2378.4 | 3298.8 | 4305.2 | ||||||
106 | Sg | 757.4 | 1732.9 | 2483.5 | 3415.6 | 4561.8 | 5715.8 | |||||
107 | Bh | 742.9 | 1688.5 | 2566.5 | 3598.9 | 4727.8 | 5991.7 | 7226.8 | ||||
108 | Hs | 733.3 | 1756.0 | 2827.0 | 3637.5 | 4940.0 | 6175.1 | 7535.5 | 8857.4 | |||
109 | Mt | 800.8 | 1823.6 | 2904.2 | 3859.4 | 4920.8 | ||||||
110 | Ds | 955.2 | 1891.1 | 3029.6 | 3955.9 | 5113.7 | ||||||
111 | Rg | 1022.7 | 2074.4 | 3077.9 | 4052.4 | 5306.7 | ||||||
112 | Cn | 1154.9 | 2170.0 | 3164.7 | 4245.4 | 5499.7 | ||||||
113 | Nh | 704.9 | 2238.5 | 3023.3 | 4351.5 | 5692.6 | ||||||
114 | Fl | 823.9 | 1601.6 | 3367.3 | 4399.7 | 5847.0 | ||||||
115 | Mc | 538.4 | 1756.0 | 2653.3 | 4679.5 | 5721.6 | ||||||
116 | Lv | 723.6 | 1331.5 | 2846.3 | 3811.2 | 6078.6 | ||||||
117 | Ts | 742.9 | 1785.0– 1920.1 | |||||||||
118 | Og | 839.4 | 1563.1 | |||||||||
119 | Uue | 463.1 | 1698.1 | |||||||||
120 | Ubn | 578.9 | 895.4– 918.5 | |||||||||
121 | Ubu | 429.4 | ||||||||||
122 | Ubb | 540.4 | 1090.4 | 1968.5 | 2618.9 |
第11到20電離能
| 原子序 | 符號 | 名稱 | 11th | 12th | 13th | 14th | 15th | 16th | 17th | 18th | 19th | 20th |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
11 | Na | 鈉 | 159,076 | |||||||||
12 | Mg | 鎂 | 169,988 | 189,368 | ||||||||
13 | Al | 鋁 | 42,647 | 201,266 | 222,316 | |||||||
14 | Si | 矽 | 45,962 | 50,502 | 235,196 | 257,923 | ||||||
15 | P | 磷 | 46,261 | 54,110 | 59,024 | 271,791 | 296,195 | |||||
16 | S | 硫 | 48,710 | 54,460 | 62,930 | 68,216 | 311,048 | 337,138 | ||||
17 | Cl | 氯 | 51,068 | 57,119 | 63,363 | 72,341 | 78,095 | 352,994 | 380,760 | |||
18 | Ar | 氬 | 52,002 | 59,653 | 66,199 | 72,918 | 82,473 | 88,576 | 397,605 | 427,066 | ||
19 | K | 鉀 | 54,490 | 60,730 | 68,950 | 75,900 | 83,080 | 93,400 | 99,710 | 444,880 | 476,063 | |
20 | Ca | 鈣 | 57,110 | 63,410 | 70,110 | 78,890 | 86,310 | 94,000 | 104,900 | 111,711 | 494,850 | 527,762 |
21 | Sc | 鈧 | 24,102 | 66,320 | 73,010 | 80,160 | 89,490 | 97,400 | 105,600 | 117,000 | 124,270 | 547,530 |
22 | Ti | 鈦 | 25,575 | 28,125 | 76,015 | 83,280 | 90,880 | 100,700 | 109,100 | 117,800 | 129,900 | 137,530 |
23 | V | 釩 | 24,670 | 29,730 | 32,446 | 86,450 | 94,170 | 102,300 | 112,700 | 121,600 | 130,700 | 143,400 |
24 | Cr | 鉻 | 26,130 | 28,750 | 34,230 | 37,066 | 97,510 | 105,800 | 114,300 | 125,300 | 134,700 | 144,300 |
25 | Mn | 錳 | 27,590 | 30,330 | 33,150 | 38,880 | 41,987 | 109,480 | 118,100 | 127,100 | 138,600 | 148,500 |
26 | Fe | 鐵 | 28,000 | 31,920 | 34,830 | 37,840 | 44,100 | 47,206 | 122,200 | 131,000 | 140,500 | 152,600 |
27 | Co | 鈷 | 29,400 | 32,400 | 36,600 | 39,700 | 42,800 | 49,396 | 52,737 | 134,810 | 145,170 | 154,700 |
28 | Ni | 鎳 | 30,970 | 34,000 | 37,100 | 41,500 | 44,800 | 48,100 | 55,101 | 58,570 | 148,700 | 159,000 |
29 | Cu | 銅 | 25,600 | 35,600 | 38,700 | 42,000 | 46,700 | 50,200 | 53,700 | 61,100 | 64,702 | 163,700 |
30 | Zn | 鋅 | 26,400 | 29,990 | 40,490 | 43,800 | 47,300 | 52,300 | 55,900 | 59,700 | 67,300 | 171,200 |
36 | Kr | 氪 | 29,700 | 33,800 | 37,700 | 43,100 | 47,500 | 52,200 | 57,100 | 61,800 | 75,800 | 80,400 |
38 | Sr | 鍶 | 31,270 | |||||||||
39 | Y | 釔 | 19,900 | 36,090 | ||||||||
42 | Mo | 鉬 | 20,190 | 22,219 | 26,930 | 29,196 | 52,490 | 55,000 | 61,400 | 67,700 | 74,000 | 80,400 |
第21到30電離能
| 原子序 | 符號 | 名稱 | 21st | 22nd | 23rd | 24th | 25th | 26th | 27th | 28th | 29th | 30th |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
21 | Sc | 鈧 | 582,163 | |||||||||
22 | Ti | 鈦 | 602,930 | 639,294 | ||||||||
23 | V | 釩 | 151,440 | 661,050 | 699,144 | |||||||
24 | Cr | 鉻 | 157,700 | 166,090 | 721,870 | 761,733 | ||||||
25 | Mn | 錳 | 158,600 | 172,500 | 181,380 | 785,450 | 827,067 | |||||
26 | Fe | 鐵 | 163,000 | 173,600 | 188,100 | 195,200 | 851,800 | 895,161 | ||||
27 | Co | 鈷 | 167,400 | 178,100 | 189,300 | 204,500 | 214,100 | 920,870 | 966,023 | |||
28 | Ni | 鎳 | 169,400 | 182,700 | 194,000 | 205,600 | 221,400 | 231,490 | 992,718 | 1,039,668 | ||
29 | Cu | 銅 | 174,100 | 184,900 | 198,800 | 210,500 | 222,700 | 239,100 | 249,660 | 1,067,358 | 1,116,105 | |
30 | Zn | 鋅 | 179,100 | |||||||||
36 | Kr | 氪 | 85,300 | 90,400 | 96,300 | 101,400 | 111,100 | 116,290 | 282,500 | 296,200 | 311,400 | 326,200 |
42 | Mo | 鉬 | 87,000 | 93,400 | 98,420 | 104,400 | 121,900 | 127,700 | 133,800 | 139,800 | 148,100 | 154,500 |