絡合劑
⑵絡合物的穩定性多數不高,因而各級絡合反應都進行得不夠完全;
⑶由於各級形成
常數彼此相差不大,容易得到絡合比不同的一系列絡合物,產物沒有固定的組成,從而難以確定反應的
計量關係和
滴定終點。
有機絡合劑
⑵與金屬離子絡合時可以形成具有環狀結構的
螯合物,在一定的條件下絡合比是固定的。
氨羧絡合劑
簡介
它是一類含有氨基二乙酸—N(CH2COOH)2基團的有機化合物,其分子中含有
氨氮 和羧氧兩種配位能力很強的
配位原子。
條件
一、形成的絡合物要相當穩定,K形≥108,否則不易得到明顯的
滴定終點。
二、在一定反應條件下,絡合數必須固定(即只形成一種
配位數的絡合物)。
四、要有適當的方法確定滴定的計量點。
代表物質
乙二胺四乙酸簡稱EDTA或EDTA酸,常用H4Y表示。白色晶體,無毒,不吸潮。在水中
難溶。在22℃時,每100毫升水中能溶解0.02克,難溶於醚和一般有機溶劑,
易溶於
氨水和
NaOH溶液中,生成相應的鹽溶液。
當H4Y溶解於
酸度很高的溶液中,它的兩個羧基可再接受H+而形成H6Y,這樣EDTA就相當於六元酸,有六級離解平衡。
Ka1 Ka2 Ka3 Ka4 Ka5 Ka6
10-0.90 10-1.60 10-2.00 10-2.67 10-6.16 10-10.26
二、性質:
溶解度小
難溶於酸和有機溶劑,易溶於鹼。所以常用EDTA的二鈉鹽。(Na2H2Y·2H2O)以雙極分子存在。在
強酸溶液中,結合兩個H而形成六元酸H6Y,存在七種型體,H6Y、H5Y、H4Y、H3Y、H2Y、HY和Y,六個
解離常數分布分數的計算與
多元酸的分布分數相同。
滴定時必須控制
酸度。Y與金屬離子形成的絡合物最為穩定。三、
二鈉鹽:
結構:HOOC-CH2 CH2-COONa
N-CH2-CH2-N
NaOOC-CH2 CH2-COOH
特點:二鈉鹽在
水溶液中溶解度較大。二鈉鹽在水溶液中主要存在型體是H2Y。[H]== ==3.8*10 PH==4.42
形成絡合物的廣泛性和穩定性:幾乎能與所有的金屬離子形成絡合物且穩定;
生成的環越多越穩定,一般為五元環。
絡合比簡單,一般為1 1
絡合反應的速率快,易溶於水。絡合物的顏色與金屬離子有關。EDTA與無色金屬離子絡合時形成無色的絡合物;
EDTA與有色金屬離子絡合時形成顏色更深的絡合物;
終點誤差
一、終點誤差:
終點誤差的意義:Et==
設在終點時,加入的滴定劑Y的
物質的量為CY,epVep,溶液中金屬離子M的物質的量為CM,epVep,通過推導可得
2、林邦終點誤差公式:
公式中 == ,決定誤差的正負。
為按計量點時體積計算的金屬離子的濃度。
公式表明:當 一定時,KMY值越大,絡合
滴定突躍越大,終點誤差越小。
若金屬離子未發生副反應,則用 代替 計算.
二、直接準確滴定金屬離子的條件:
影響
絡合反應的因素:⑴、待測金屬離子的濃度CM(也與滴定劑的濃度)有關
⑷、
指示劑的選擇(決定 的大小和檢測終點的敏銳性)
設 == 0.2,顯然只有當滴定突躍不小於0.4個pM單位時,指示劑的變色點才可能落在其中。若要求 ,則得 直接準確滴定金屬離子的可行性判據:三、
絡合滴定中
酸度的選擇與控制:
M + H2Y ===MY + 2H
隨著滴定劑與金屬
離子反應生成相應的絡合物,溶液的酸度會逐漸增高,減小了MY的條件常數,降低
滴定反應的完全程度;而且還可能影響
指示劑的變色點和自身的顏色,導致終點誤差變大,因此酸度對絡合滴定的影響是多方面的,需要加入緩衝溶液予以控制。
常用的緩衝體系:
鹼性:NH3-NH4Cl
注意:選擇
緩衝溶液時,不僅要考慮它的緩衝範圍和
緩衝容量,還要注意可能引入的副反應。
二、單一金屬離子滴定的最高酸度和最低酸度:
1、最高酸度:(最低PH值)
由 知當CM一定時,K至少應達到某一數值(最小值),才有可能對該金屬離子直接準確滴定。由於
酸效應時影響
絡合滴定最主要的因素,假如金屬離子不發生副反應,則 KMY僅受酸效應的影響,其大小由 決定,也就是說溶液的酸度存在著一個高限,這一最高允許
酸度稱為最高酸度
①、lg αYH(max)=lgKMY-lgK'MY(min)
②、當CM(sp)=0.010mol/L,△pM=±0.2時,
得lgK'MY(min)=8
lg αYH(max)=lgK'MY-8
③、
酸效應曲線(林邦曲線):橫坐標用lg (lgKMY)表示,縱坐標是各金屬離子對應的滴定最高酸度。
作用:A、查得曲線上所標離子的lgKMY
B、找到每種離子在指定條件下(CM,sp==0.010mol/L, == 0.2, )可被準確滴定的最低PH值。
C、了解各離子相互干擾的情況:曲線右下方的離子干擾左上方離子的滴定;但在左上方離子存在下,可用控制酸度的方法滴定右下方離子
2、最低酸度(最高PH值):將金屬離子開始生成
氫氧化物沉澱時的酸度作為
絡合滴定的最低酸度。
3、適宜酸度範圍:最高酸度和最低酸度之間的酸度範圍稱為適宜酸度範圍。
4、最佳酸度:在滴定某離子的最高酸度和最低
酸度之間,究竟選擇哪一酸度最為合適,還要結合
指示劑的適宜酸度來進行選擇。如果在所用的酸度下滴定時,指示劑所指示的終點與計量點最為接近,那麽這個酸度就可認為是滴定的最佳酸度。一般介於適宜酸度之間。(pMep==pMsp時的酸度)
注意:金屬離子的滴定並非一定要在適宜的酸度範圍內進行,若有合適的
絡合劑(防止金屬離子
水解),也可以在其他酸度下進行
提高方法
一、分步滴定的可行性判據:
1、分步滴定:
設溶液中只有兩種金屬M和N共存,他們都能與
EDTA絡合,但KMY>KNY。當用EDTA進行滴定時,M離子首先與之反應。若KMY、KNY相差到一定程度,就有可能準確滴定M而不受N離子的干擾。這種情況稱為分步滴定。
2、條件討論:
設M、N的
分析濃度分別為CM和CN,按計量點溶液體積計算時的分析濃度各為CM,SP和CN,SP。此時滴定劑在溶液中有兩種副反應——
酸效應和共存離子效應。
== -1
如果M離子能被分步滴定,那麽到達計量點時N離子與Y的
絡合反應就可以忽略不計,[N]≈CN,SP。
⑴、在較高的
酸度下滴定M離子,由於
EDTA的酸效應是主要的,即 ≥ ,則N離子與Y的
副反應可以忽略,
≈ ,則
此時可認為N的存在對M的
滴定反應沒有影響,與單獨滴定M離子時的情況相同。
⑵、由於滴定M時的酸度較低, ≤。Y的
酸效應可被忽略,而N離子與Y的副反應起主要影響,因此
== ==CN,SPKNY
若CM=CN,可得:
如要求N離子不干擾,同時按照 == 0.2, 的 要求來滴定M離子,則得: △lgK≥6 ——能否準確分步滴定的條件
當△lgK足夠大時,分步滴定實際是通過控制不同的
滴定酸度來實現的。由於金屬離子
EDTA絡合物的形成
常數不同,滴定的最高允許酸度和適宜的酸度範圍也各不相同。當溶液中不止存在一種金屬離子時,通過控制滴定酸度使M離子能EDTA定量絡合,而其他離子基本不能與之形成穩定的絡合物(同時也不與
指示劑顯色),從而達到選擇滴定的目的。
大多數金屬離子的KMY相差不多,甚至有時KMY較KNY還小,無法通過控制
酸度進行選擇滴定。由於共存離子影響還與其濃度有關,由此藉助某些試劑與共存離子的反應使其
平衡濃度大為降低,由此減小以至消除它們與Y的副反應,從而達到選擇滴定的目的,這種方法稱為掩蔽法。
1、絡合掩蔽法:掩蔽劑是一種
絡合劑,在一定的條件下它與N離子形成較穩定的絡合物(最好是無色或淺色的),但不與或基本不與M
離子反應。有兩種情況:
①、N離子的濃度[N]已減至很小,致使 ≥ ,即N已不構成干擾。
②、
掩蔽劑L對N離子的掩蔽並不完全,此時能否選擇滴定M離子則取決於KMY的大小。
例如,用
EDTA測定水中的Ca、Mg時,Fe、A1等離子的存在對測定有干擾,可加入
三乙醇胺作為掩蔽劑。三乙醇胺能與Fe、A1等離子形成穩定的絡合物,而且不與Ca、Mg作用,這樣就可以消除Fe和Al的干擾。
2、
沉澱掩蔽法:利用
沉澱反應降低干擾離子的濃度,不經分離沉澱直接進行滴定,這種消除干擾的方法稱為沉澱掩蔽法。
例如,在Ca、Mg共存的溶液中,加入
NaOH使溶液的pH>12,Mg形成Mg(OH)2沉澱,不干擾Ca的滴定。
應該指出,沉澱掩蔽法,不是理想的掩蔽方法,因為它尚存在著如下缺點。
(1)一些沉澱反應進行得不完全,掩蔽效率不高。
(2)由於生成沉澱時,常有“
共沉澱現象”,因而影響滴定的準確度,有時由於對
指示劑有
吸附作用,而影響終點的觀察。
(3)沉澱有顏色或體積很大,都會妨礙終點的觀察。因此,
沉澱掩蔽法的套用不很廣泛。
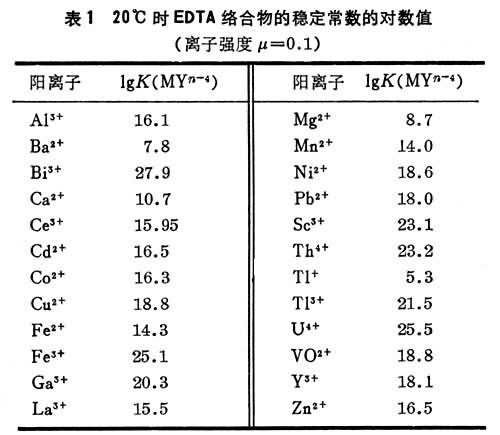
例如,logKFeY-=25.1,logKFeY2-=14.33
表明Fe與
EDTA形成的絡合物比Fe與EDTA形成的絡合物要穩定得多。在pH=l時,用EDTA滴定Bi、Zr、Th等離子時,如有Fe存在,就會干擾滴定。此時,如果用
羥胺或
抗壞血酸(維生素C)等還原劑將Fe還原為Fe,可以消除Fe的干擾,但是,在pH=5-6時。用EDTA滴定Pb、Zn等離子,Fe即使還原為Fe仍不能消除其干擾,而需用其他方法消除其干擾。因為PbY、ZnY的形成
常數與FeY的形成常數相差不大。
有些高價離子,在溶液中以
酸根離子形式存在時,有時不干擾某些組分的滴定,則可將低價氧化為高價狀態,以消除其干擾。
氧化還原掩蔽法,只適用於那些易發生氧化還原反應的金屬離子、並且生成的還原型物質或氧化型物質不干擾測定的情況。因此只有少數幾種離子可用這種掩蔽方法。
4、採用具選擇性的
解蔽劑:加入某種解蔽劑,使被掩蔽的金屬離子從相應的絡合物中釋放出來的方法,稱為解蔽。
在滴定Pb後的溶液中,加入甲醛或
三氯乙醛破壞[Zn(CN)4],釋放出來的Zn,可用EDTA繼續滴定,Cu(CN)3比較穩定,用甲醛或三氯乙醛難以解蔽。但是,要注意甲醛的用量(通常1:8
甲醛溶液加5毫升),否則,Cu(CN)3也可能有部分被破壞,影響Zn的測定結果。
在實際分析中,用一種掩蔽的方法,常不能得到令人滿意的結果,當有多種
離子共存時,常套用幾種
掩蔽劑或
沉澱劑,這樣才能獲得高度的選擇性。
例如,測定土壤中Ca、Mg時,Fe、A1、Mn及Cu等重金屬離子嚴重干擾測定。在弱鹼性條件下,Fe、A1、Mn等以
氫氧化物沉澱析出,沉澱是棕紅色,嚴重影響
滴定終點的觀察,故常用
鹽酸羥胺和
三乙醇胺來消除Fe、A1、Mn的干擾。
四、選用其他的滴定劑:
CyDTA亦稱DcTA,它與金屬離子形成的絡合物,一般比相應的EDTA絡合物更為穩定。但是,CyDTA與金屬離子的絡合速度比較慢,往往使
滴定終點拖長,且價格較貴,一般不常使用。但是,它與A1的絡合速度相當快,用CyDTA滴定Al,可省去加熱等手續(EDTA滴定A1要加熱)。不少廠礦實驗室採用
CyDTA測定A1。
CyDTA與W、Mo、Nb、Ta等金屬離子的絡合能力較弱,所以,在pH=5—5.5時,雖有W、Mo存在,也可用CyDTA滴定Cu、Fe、Co、Ni等。在Nb、Ta存在的情況下,加過量的CyDTA,於pH=5.0-5.2時,以CuSO4
標準溶液測定Ti。
2、TTHA(三乙基四胺六乙酸)
TTHA為三乙基四胺六乙酸的簡稱,它是一個六元酸,有四個胺基和六個
羧基,共10個絡合
原子,因而它與不少金屬離子,在室溫下形成1:1或2:1的
螯合物。尤其是與A1形成的螯合物更穩定,在25℃時,放置10-15分鐘,就能形成A1:TTHA=2:1的螯合物。由於A12—TTHA的絕對形成
常數logAl-TTHA=28.6,比Mn2—TTHA的logMn-TTHA=21.9大得多,改選用TTHA作滴定劑滴定A1時可在大量Mn存在下進行。這是
EDTA所不及的。TTHA已用於測定礦石中0.4%以上的A1,結果滿意。
與EDTA相比,其中四個
乙酸基為四個丙酸基所替代。金屬離子與EDTP形成六原子環的
螯合物,因此,穩定性普遍地較EDTA絡合物色但是Cu—EDTP絡合物仍有相當高的穩定性。
因此,控制一定的pH值,用EDTP滴定Cu時,Zn、Cd、Mn、Mg均不干擾。
方式套用
1、這是
絡合滴定中最基本的方法。這種方法是將被測物質處理成溶液後,調節
酸度,加入
指示劑(有時還需要加入適當的輔助
絡合劑及
掩蔽劑),直接用
EDTA標準溶液進行
滴定,然後根據消耗的EDTA標準溶液的體積,計算試樣中被測組分的含量。採用直接滴定法,必須符合以下幾個條件:
①符合單一金屬離子準確滴定的條件,即滿足lgCM,SPKMY≥6的要求,
絡合反應的速率快。
②有變色敏銳的指示劑指示終點,且不受金屬離子的封閉。如A1對許多指示劑產生“封閉”作用:因此不宜用直接滴定法。有些金屬離子(如Sr、Ba等)缺乏靈敏的
指示劑,所以也不能用直接
滴定法。
| 被滴定離子
|
PH=1;
| Bi
|
PH=1.5-2.5
| Fe
|
PH=2.5-3.5
| Th
|
PH=5-6
| Zn,Pb,Cd及稀土
|
PH=9-10
| Zn,Mn,Cd及稀土
|
PH=10
| Mg
|
PH=12-13
| Ca
|
二、
返滴定法:在進行
絡合反應的條件下,有些金屬離子不能全部滿足上述直接滴定的三個條件,此時可考慮採用返滴定法測定。
返滴定法,就是將被測物質製成溶液,調好
酸度,加入過量的
EDTA標準溶液(總量c1V1),再用另一種標準金屬離子溶液,返滴定過量的EDTA(c2V2),算出兩者的差值,即是與被測離子結合的EDTA的量,由此就可以算出被測物質的含量。這種滴定方法,適用於無適當
指示劑或與EDTA不能迅速絡合的金屬離子的測定。
作為返滴定法的金屬離子,它與EDTA絡合物的穩定性要適當。既應有足夠的穩定性以保證滴定的準確度,一般又不宜比待測離子與
EDTA的絡合物更為穩定。否則在返滴定的過程中,它可能將被測離子從其絡合物中置換出來,造成測定結果偏低。
三、
置換滴定法:利用
置換反應生成等物質的量的金屬離子或EDTA,然後進行滴定的方法,稱為置換滴定法。即,在一定
酸度下,往被測試液中加入過量的EDTA、用金屬離子滴定過量的EDTA,然後再加入另一種
絡合劑,使其與被測定離子生成一種絡合物,這種絡合物比被測離子與EDTA生成的絡合物更穩定,從而把EDTA釋放(置換)出來,最後再用金屬離子
標準溶液滴定釋放出來的EDTA。根據金屬離子標準溶液的用量和濃度,計算出被測離子的含量。這種方法適用於多種金屬離子存在下測定其中一種金屬離子。
1、置換出金屬離子:
如被測定的離子M與
EDTA反應不完全或所形成的絡合物不穩定,這時可讓M置換出另一種絡合物NL中等物質的量的N,用EDTA溶液滴定N,從而可求得M的含量。
例如Ag與EDTA的絡合物不夠穩定(lgKAgY=7.32),不能用EDTA直接滴定。若在含Ag的試液中加入過量的Ni(CN)4,反應定量轉換出Ni,在pH=10的氨性
緩衝溶液,以
紫脲酸銨為
指示劑,用EDTA
標準溶液滴定轉換出來的Ni。反應為:
Ag+ Ni(CN)4= 2Ag
(CN)2+ Ni
2、置換出EDTA:
將被測定的金屬離子M與干擾離子全部用
EDTA絡合,加入選擇性高的
絡合劑L以奪取M,並釋放出EDTA:
MY + L = ML +Y
反應完全後,釋入出與M等物質量的EDTA,然後再用金屬
鹽類標準溶液滴定釋放出來的EDTA,從而即可求得M的含量。例如測定
錫青銅中的錫,先在試液中加入一定且過量的EDTA,使四價錫與試樣中共存的鉛、鈣、鋅等離子與EDTA絡合。再用鋅離子溶液返
滴定過量的EDTA後,加入
氟化銨,此時發生如下反應,並定量轉換出EDTA。用鋅
標準溶液滴定後即可得錫的含量。
SnY + 6F =SnF6 + Y
Zn+ Y= ZnY
有些金屬離子(如Li、Na、K、Rb、Cs、W、Ta等),和一些非金屬離子(如SO4、PO4等),由於不能和
EDTA絡合或與EDTA生成的絡合物不穩定,不便於
絡合滴定,這時可採用間接滴定的方法進行測定。
例如PO4的測定,在一定條件下,可將PO4沉澱為MgNH4PO4,,然後過濾,將沉澱溶解.調節溶液的pH=10,用
鉻黑T作
指示劑,以EDTA標堆溶液來
滴定沉澱中的Mg,由Mg的含量間接計算出磷的含量。 名稱
絡合滴定法
complexometric titration
滴定方法
滴定方法主要有以下4種:①直接滴定。即用標準
EDTA溶液直接滴定金屬離子,以一適當
指示劑確定終點;由於反應過程釋出H+,須使用
緩衝溶液以維持pH恆定。對在控制pH下易
水解的金屬,還須加入輔助
絡合劑以抑制之。②回滴法。對某些金屬,容易水解或與EDTA絡合緩慢,或者沒有適於直接滴定的指示劑,可加入過量EDTA,然後用一適當金屬回滴。③置換滴定。若待測金屬MⅠ能參與
置換反應且各穩定常數值符合>>108,則MⅠ可定量地置換,然後用EDTA滴定,從而間接求出MⅠ。另一種
置換滴定法是用一種比EDTA更強的絡合劑HnZ置換MⅠ-
EDTA絡合物中的EDTA,用MⅡ滴定。④間接滴定。主要用於滴定那些與EDTA弱絡合的
陽離子,或不與EDTA絡合的陰離子。例如,在適宜條件下,加入一定量的鉍鹽沉澱
磷酸根為磷酸鹽,然後用EDTA滴定過量的鉍而間接測得磷。
絡合滴定使用的
指示劑多為
金屬指示劑。這些金屬指示劑必須要與金屬絡合後呈相當深的顏色,絡合物的lgK>5才有足夠的靈敏度;指示劑絡合物的穩定性要比EDTA絡合物的穩定性約低3個lgK單位,終點才敏銳。
此外,在同一pH下,游離指示劑與指示劑絡合物要有顯著不同的顏色。金屬指示劑中能產生螢光的則稱為金屬
螢光指示劑。也可以使用儀器確定終點,如
電位分析法,
庫侖滴定法,
安培滴定法,分光光度
滴定法等,既可提高靈敏度和準確度,也可用於測定微量元素。