緩衝溶液指的是由弱酸及其鹽、弱鹼及其鹽組成的混合溶液,能在一定程度上抵消、減輕外加強酸或強鹼對溶液酸鹼度的影響,從而保持溶液的pH值相對穩定。
基本介紹
- 中文名:緩衝溶液
- 外文名:buffer solution
- 成分:通常為弱酸和它的共軛鹼
- 作用:降低pH變動幅度
- 生物意義:維持生物的正常pH值和生理環境
定義及來源
緩衝原理
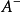
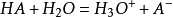
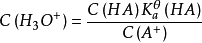
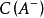
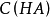
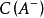
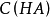
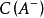
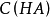
常見組成
pH計算
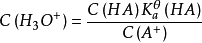
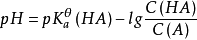
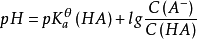
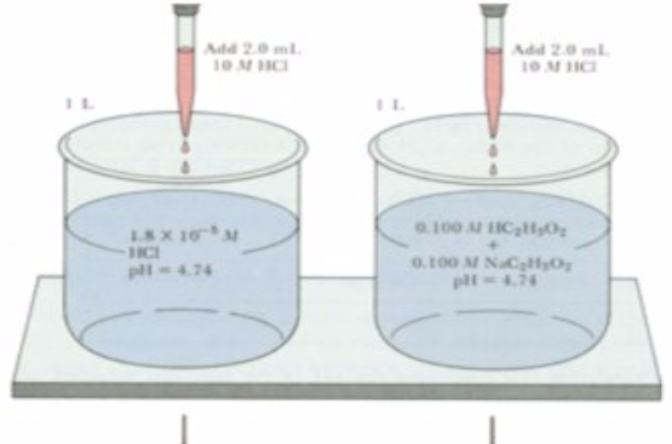
緩衝溶液指的是由弱酸及其鹽、弱鹼及其鹽組成的混合溶液,能在一定程度上抵消、減輕外加強酸或強鹼對溶液酸鹼度的影響,從而保持溶液的pH值相對穩定。
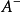
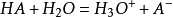
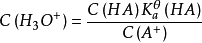
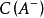
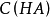
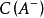
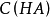
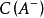
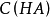
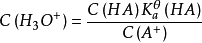
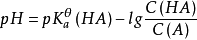
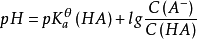
緩衝溶液指的是由弱酸及其鹽、弱鹼及其鹽組成的混合溶液,能在一定程度上抵消、減輕外加強酸或強鹼對溶液酸鹼度的影響,從而保持溶液的pH值相對穩定。...
當往某些溶液中加入一定量的酸和鹼時,有阻礙溶液pH變化的作用,稱為緩衝作用,這樣的溶液叫做緩衝溶液。弱酸及其鹽的混合溶液(如HOAc與NaOAc),弱鹼及其鹽的混合溶液...
緩衝劑是能被用來控制高溫高壓狀態下,或常溫常壓下,氣體或液體逸度的固體組合,它可以是固態的也可以是液態的。化學工程中的緩衝劑常稱為酸鹼穩定劑,一般是鹽類,...
標準緩衝溶液是一種溶液。標準緩衝溶液性質穩定,有一定的緩衝容量和抗稀釋能力,常用於校正pH計。...
緩衝溶液(Buffer Solution)是一種能在加入少量酸或鹼和水時大大減低pH變動的溶液。...... 緩衝溶液(Buffer Solution)是一種能在加入少量酸或鹼和水時大大減低pH...
磷酸鹽緩衝液(Phosphate Buffered Saline,簡稱PBS)是常用的用於生物學研究的一個緩衝溶液。...
從緩衝作用的原理可知,緩衝溶液一般由具有足夠濃度及適當比例的共軛酸鹼對組成。組成緩衝溶液的共軛酸鹼對的兩種物質合稱為緩衝對(buffer pair)。...
伯瑞坦-羅賓森(Britton-Robinson)是由磷酸、硼酸和醋酸(H3PO4-HAc-H3BO3)混合而成,向其中加入不同量的氫氧化鈉可以組成pH範圍很寬的緩衝溶液,pH1.8~11.9 ...
PBS是磷酸緩衝鹽溶液(phosphate buffer saline)一般作為溶劑,起溶解保護試劑的作用。它是生物化學研究中使用最為廣泛的一種緩衝液,主要成分為Na2HPO4、KH2PO4、...
正常人血漿的pH值為7.35~7.40。血漿PH值的相對恆定性有賴於血液內的緩衝物質以及正常的肺、腎功能。血漿的緩衝物質包括NaHCO3/H2CO3、蛋白質鈉鹽/蛋白質和...
通常把緩衝溶液能發揮緩衝作用(緩衝比0.1-10)的PH範圍稱為緩衝範圍。。...... 通常把緩衝溶液能發揮緩衝作用(緩衝比0.1-10)的PH範圍稱為緩衝範圍。而超過該范...
檸檬酸鹽緩衝液主要成分為檸檬酸和磷酸氫鈉,常用於免疫分析。...... 檸檬酸鹽緩衝液主要成分為檸檬酸和磷酸氫鈉,常用於免疫分析。目錄 1 緩衝溶液 2 CPBS 3...
PBS溶液又稱磷酸鹽緩衝溶液,一般選擇Na2HPO4和KH2PO4配製,因為鈉鹽溶解的較慢。根據不同pH的溶液,稱量不同質量的磷酸鹽,也可以用pH計調溶液的pH。PBS一般用作...
一般弱酸或弱鹼與其鹽(強電解質)的混合物顯有緩衝作用,具有這種作用的系統稱為緩衝系統。在緩衝系統中雖有的以固態加入,但大多數情況全部物質都進行溶解,此稱為...
buffer value 根據緩衝溶液的組成,經測量或計算所得的pH值。是一種溶液緩衝效能的單位。 ...
HEPES buffer緩衝溶液的配製方法關於HEPES 緩衝溶液的配製,不同的文獻資料有不同的說法。根據用途,一種是單純的HEPES+NaOH,另一種是HEPES+鹽。各種配製方法總結如...
套用 配製緩衝溶液 目錄 1 緩衝特性 2 製備 3 套用 Tris緩衝特性 編輯 Tris為弱鹼,在25℃下,它的pKa為8.1;根據緩衝理論,Tris緩衝液的有效緩衝範圍在pH7.0...
