分析化學中,在化學計量點前後±0.1%(滴定分析允許誤差)範圍內,溶液參數將發生急劇變化,這種參數(如酸鹼滴定中的pH)的突然改變就是滴定突躍。
基本介紹
- 中文名:滴定突躍
- 外文名:Sudden leap of titration
分析化學中,在化學計量點前後±0.1%(滴定分析允許誤差)範圍內,溶液參數將發生急劇變化,這種參數(如酸鹼滴定中的pH)的突然改變就是滴定突躍。


分析化學中,在化學計量點前後±0.1%(滴定分析允許誤差)範圍內,溶液參數將發生急劇變化,這種參數(如酸鹼滴定中的pH)的突然改變就是滴定突躍。...
<突躍術語由來> 突躍論的誕生,以法國數學家勒內·托姆勒內·托姆(Renethom1923—)於1972年發表的《結構穩定性和形態發生學》一書的問世作為標誌。“突變”一詞,...
酸鹼滴定法是指利用酸和鹼在水中以質子轉移反應為基礎的滴定分析方法。可用於測定酸、鹼和兩性物質,是一種利用酸鹼反應進行容量分析的方法。用酸作滴定劑可以測定鹼...
滴定分析中,當滴定至等當點時,往往沒有任何外觀效果可供判斷,常藉助於指示劑的顏色變化來確定終止滴定,此時指示劑的變色點,即為滴定終點。...
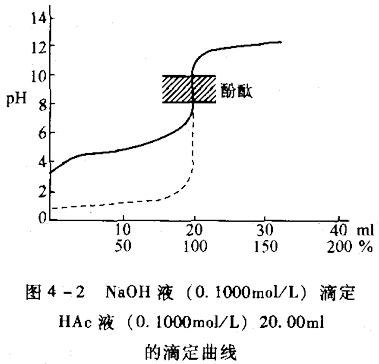
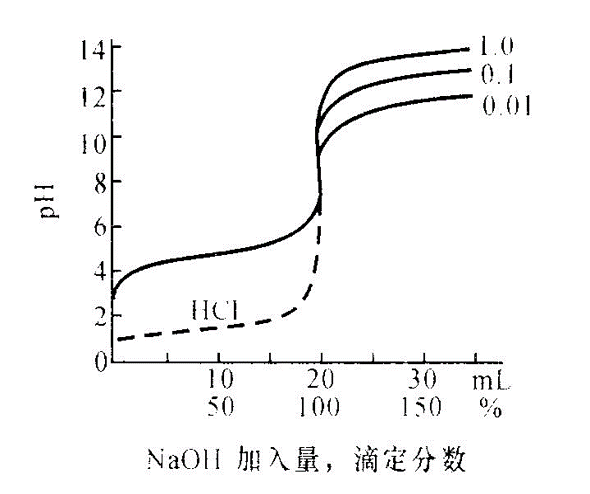
(見容量分析)過程中溶液性質。滴定曲線大致:①用濃度的對數函式表示(如圖1和圖2 中的pH和pZn,p即常用對數的負值)。由曲線等當點附近的變化,可以判定能否用指示...
自動電位滴定儀除可進行電位滴定法,包括酸鹼滴定,氧化還原滴定,沉澱滴定,絡合滴定和非水滴定外,也可進行恆pH測量。通過選件可進行光度滴定,極化滴定, 容量法卡氏...
強鹼滴定弱酸是一種化學研究方法。...... (1)滴定突躍範圍較小,pH值范在7.75~9.70之間。(2)計量點的pH值不是7而是8.72,計量點落在鹼性範圍內。這是因為滴...
非水滴定即在非水溶劑中進行的滴定分析方法。一些很弱的酸或鹼以及某些鹽類,在水溶液中進行滴定時,沒有明顯的滴定突躍,難於掌握滴定終點;另外還有一些有機化合物...
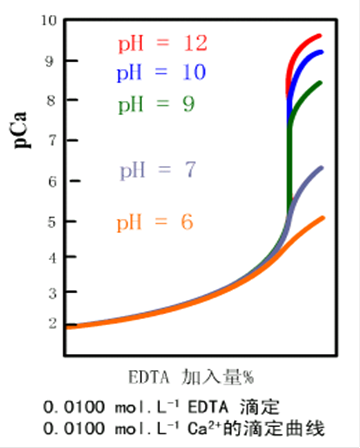
在酸鹼滴定中,隨著滴定劑的加入,溶液的 發生變化,在化學計量點附近,溶液的 PH發生突變,形成滴定突躍.與此相似,在絡合滴定中,隨著滴定劑(EDTA)的加入, ,到計量...
酸鹼滴定就是利用酸和鹼在水中以質子轉移反應為基礎的滴定分析方法。可用於測定酸、鹼和兩性物質。其基本反應為H﹢+OH﹣=H2O也稱中和法,是一種利用酸鹼反應進行...
絡合滴定法是以絡合反應為基礎的滴定分析方法稱。它主要以氨羧絡合劑為滴定劑,這些氨羧絡合劑對許多金屬有很強的絡合能力。...
電位滴定是利用溶液電位突變指示終點的滴定法。在滴定過程中,被滴定的溶液中插入連線電位計的兩支電極,一支為參比電極,另一支為指標電極。與直接電位法相比,電位...
化學滴定分析答案、滴定分析法的準確度比較高,其相對誤差約為±0.2%。...... 14、為什麼滴定突躍越大越容易檢測?任何檢測方法都有一定的誤差(不確定度)。...
電位滴定法(potentiometric titration)是在滴定過程中通過測量電位變化以確定滴定終點的方法,和直接電位法相比,電位滴定法不需要準確的測量電極電位值,因此,溫度、液體...
