理化特性
主要成分: 純品
爆炸上限%(V/V):42.6
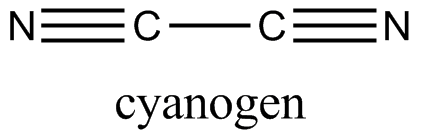 氰的化學結構式
氰的化學結構式 健康危害
氰的刺激性比
氰化氫略弱,而毒性則小得多。氰的
輕度中毒,病人出現乏力、頭痛、頭昏、胸悶及黏膜刺激症狀;嚴重中毒者,呼吸困難,
意識喪失,出現
驚厥,最後可因
呼吸中樞麻痹而死亡。
燃爆危險
本品易燃,劇毒,具
刺激性。燃燒時發出紫紅色火焰,燃燒生成二氧化碳和
一氧化氮。
危險特性
與空氣混合能形成
爆炸性混合物。遇明火、高熱能引起燃燒爆炸。其蒸氣比空氣重,能在較低處擴散到相當遠的地方,遇火源會著火回燃。遇水或水蒸氣、酸或酸氣產生劇毒的煙霧。若遇高熱,容器內壓增大,有開裂和爆炸的危險。
氰化物特指帶有
氰基(CN)的化合物,其中的碳原子和氮原子通過叄鍵相連線。這一叄鍵給予氰基以相當高的穩定性,使之在通常的化學反應中都以一個整體存在。因該
基團具有和
鹵素類似的化學性質,常被稱為
擬鹵素。一般將其
無機化合物歸為氰類,
有機化合物歸為
腈類。
通常為人所了解的
氰化物都是無機氰化物,俗稱山奈,山埃(來自英語音譯“Cyanide”),是指包含有氰根離子(CN-)的無機鹽,可認為是氫氰酸(HCN)的鹽,常見的有氰化鉀和氰化鈉。它們多有劇毒,故而為世人熟知。另有有機氰化物,是由氰基通過單鍵與另外的碳原子結合而成。視結合方式的不同,有機氰化物可分類為腈(C-CN)和
異腈(C-NC),相應的,氰基可被稱為腈基(-CN)或異腈基(-NC)。
分類
氫氰酸,HCN,是
氰化氫氣體的水溶液,(HCN)是一種無色、帶有淡淡的苦杏仁味氣體。有趣的是,有四成的人根本就聞不到它的味道,僅僅因為缺少相應的基因。易溶於水、
酒精和
乙醚。易在空氣中均勻彌散,在空氣中可燃燒。氰化氫在空氣中的含量達到5.6~12.8%時,具有爆炸性。氰化氫為氣體,其水溶液稱氫氰酸。氫氰酸屬於劇毒類。其主要套用於電鍍業(
鍍銅、鍍金、鍍銀)、
採礦業(提取金銀)、船艙、倉庫的煙燻滅鼠,製造各種樹脂單體如丙烯酸
樹酯、甲基丙烯酸樹酯等行業,此外也可在製備氰化物的生產過程中接觸到本物質。
氰化鉀和氰化鈉都是無色晶體,在潮濕的空氣中,
水解產生氫氰酸而具有苦杏仁味。
氰化物擁有令人生畏的毒性,可以說,只要用舌頭舐它一下就會中毒。人們在電影或電視上不止一次看到,間諜在被捕時突然咬一下衣領中預藏的氰化鉀,立即就會死去。這並非戲劇誇張,一般人只要一次誤服0.1克左右氰化鈉或氰化鉀就會中毒死亡,敏感的人甚至吃進0.06克就可以致死。這種
急性中毒可以在幾分鐘之內
猝死。因而,氰化物被稱為“謀殺者毒藥”。
氰化物的毒性主要由其在體內釋放的氰根而引起。氰化物可由呼吸道和消化道攝入體內。氰根離子在體內能很快與細胞色素氧化酶中的三價
鐵離子結合,抑制該酶活性,使組織不能利用氧。當大量吞入或吸入高濃度氰化物時,中毒者隨即倒地,意識喪失,瞳孔放大,迅速死亡。吞服氰化物較少者,開始感到咽喉緊縮、強烈恐懼、胸內抑悶、眩暈、嘔吐、眼睛凸出,肌肉痙攣、脈搏快而弱,最後因呼吸麻痹而死,前後不過20分鐘左右。攝入體內低濃度的氰化物,一部分轉化成硫氰酸鹽隨尿排出體外,一部分逐漸在體內蓄積,久而久之,引起慢性中毒。患者頭痛失眠、四肢乏力、容易疲勞、胸部與上腹有壓迫感,血壓下降。
產生
氰化物並非化學家的創造,恰恰相反,它們廣泛存在於自然界,尤其是生物界。氰化物可由某些細菌,真菌或藻類製造,並存在於相當多的食物與植物中。例如,在杏、桃、李、枇杷、櫻桃、梅等核仁中,以及在木薯、嫩毛筍、茅膏菜及嫩高粱葉中,都含有一種叫氰甙的物質,可使人中毒,最常見的是吃苦杏仁中毒。在植物中,氰化物通常與糖分子結合,並以含氰糖苷(cyanogenic glycoside)形式存在。木薯中就含有含氰糖苷,在食用前必須設法將其除去(通常靠持續沸煮)。水果的核中通常含有氰化物或含氰糖苷。如杏仁中含有的苦杏仁苷,就是一種含氰糖苷,故食用杏仁前通常用溫水浸泡以去毒。
人類的活動也導致氰化物的形成。 環境中的氰化物主要來自工業“三廢”,也有含氰的殺蟲劑或藥劑污染的,但以前者為主。汽車尾氣和香菸的煙霧中還有燃燒某些塑膠也會產生氰化氫。氫氰酸是製造
丙烯腈的原料,每生產10噸丙烯腈約排放50-100公斤氫氰酸。氰化鈉、氰化鉀用於金屬電鍍、礦石浮選、染料,製藥、金屬著色、鉑金精煉等工業。顯而易見,水域一旦被
氰化物污染,其後果不堪構想。 .
採礦業
在
廣義酸鹼理論中,氰離子(CN-)被歸類為
軟鹼,故而可與軟酸類的低價
重金屬離子形成較強的結合。基於此,氰化物被廣泛套用於濕法冶鍊金、銀等不活潑的金屬。
氰化物被大量用於黃金開採中,因為金
單質由於氰離子的
絡合作用降低了其氧化電位從而能在鹼性條件下被空氣中的氧氣氧化生成可溶性的金酸鹽而溶解,由此可以有效地將金從
礦渣中分離出來,然後再用活潑金屬比如鋅塊經過
置換反應把金從溶液中還原為金屬(參見濕法冶金)。
有機合成
氰化物在有機合成中是非常有用的試劑。常用來在分子中引入一個氰基(CN-),生成有機氰化物,即腈。例如紡織品中常見的腈綸,它的化學名稱是
聚丙烯腈。腈通過水解可以生成
羧酸;通過還原可以生成胺,等等。可以衍生出其它許多的
官能團來。
中毒原理
中毒原因
無機和有機氰化物在工農業生產中套用廣泛,尤其是電鍍工業常用氰化物,故易獲得,常被用於自殺或他殺。民間常有食用大量處理不當或未經處理的苦杏仁、木薯而致意外中毒者。
毒理作用
氰氣(C2N2)一般通過呼吸道進入人體,在人體中的水發生如下反應 (此反應與鹵素
單質與水反應類似) 解離出劇毒的氰根離子:
HCN=H++CN-;
氰的鹽類進入人體後亦能解離出氰根離子,如:
KCN=K++CN-;
氰離子能抑制組織細胞內42種酶的活性,如
細胞色素氧化酶、
過氧化物酶、
脫羧酶、
琥珀酸脫氫酶及
乳酸脫氫酶等。其中,細胞色素氧化酶對氰化物最為敏感。氰離子能迅速與氧化型細胞色素氧化酶中的三價鐵結合,阻止其還原成二價鐵,使傳遞電子的氧化過程中斷,組織細胞不能利用血液中的氧而造成內窒息。中樞神經系統對缺氧最敏感,故大腦首先受損,導致中樞性呼吸衰竭而死亡。此外,氰化物在消化道中釋放出的氫氧根離子具有
腐蝕作用。吸入高濃度氰化氫或吞服大量氰化物者,可在2~3分鐘
內呼吸停止,呈“電擊樣”死亡。氰離子與血液中的Fe2
+結合形成[Fe(CN
-)6]4
-,使血液運輸氧的能力下降6CN
- + Fe2
+ = [Fe(CN
-)6]4
-。
毒理學
氰化物毒性:6級
毒性等級劃分【致死量如下】
6級 劇毒 少於5mg/kg 少於7滴
5級 極毒 5-50mg/kg 7滴至1勺
4級 很毒 50-500mg/kg 1勺至1盎司
3級 有毒 0.5-5g/kg 1盎司至1品脫或1磅
2級 輕毒 5-15g/kg 1品脫至1夸脫
1級 微毒 15g/kg以上 1夸脫或2.2鎊以上
人類的活動也導致氰化物的形成。汽車尾氣、香菸的煙霧中和燃燒某些塑膠也會產生氰化氫。
中毒量致死量
口服氫氰酸致死量為0.7~3.5mg/kg;吸入的空氣中氫氰酸濃度達0.5mg/L即可致死;口服氰化鈉、氰化鉀的致死量為1~2mg/kg。成人一次服用苦杏仁40~60粒、小兒10~20粒可發生中毒乃至死亡。未經處理的木薯致死量為150~300g。
臨床表現
大劑量中毒常發生閃電式昏迷和死亡。攝入後幾秒鐘即發出尖叫聲、發紺、全身痙攣,立即呼吸停止。小劑量中毒可以出現15~40分鐘的中毒過程:口腔及咽喉麻木感、流涎、頭痛、噁心、胸悶、呼吸加快加深、脈搏加快、心律不齊、瞳孔縮小、皮膚黏膜呈鮮紅色、抽搐、昏迷,最後意識喪失而死亡。
屍檢所見
由於血中有
氰化正鐵
血紅素形成,故屍斑、肌肉及血液均呈鮮紅色。死亡迅速者,全身各臟器有明顯的窒息徵象。口服中毒者,消化道各段均可見充血、水腫,胃及十二指腸黏膜充血、糜爛、壞死,胃內及體腔內有苦杏仁味。吸入氰化物中毒死亡者,
大腦、海馬、
紋狀體、
黑質會有充血水腫,神經細胞變性壞死,並有
膠質細胞增生,心、肝、腎實質細胞濁腫等症狀。
解救
簡介
急性氰化物中毒的病情發展迅速,故急性中毒的搶救應分秒必爭,強調就地套用
解毒劑。
1.口服中毒者,可用1:2000高錳酸鉀溶液洗胃,並刺激咽後壁誘導催吐洗胃;
2.吸入中毒者,應立即撤離現場、移至空氣新鮮、通風良好的地方休息;
3.用亞硝酸異戊酯1-2支擊碎後倒入手帕,放在中毒者的口鼻前吸入,每2分鐘一次,連用5-6次;
4.對症搶救。發生循環、呼吸衰竭者給予強心劑、升壓藥,呼吸興奮劑,吸氧等;皮膚燒傷者,可用高錳酸鉀溶液沖洗,然後用
硫化銨溶液洗滌;
5.經上述現場急救之後,應立即送醫院救治,切不可延誤。
解毒機制
高鐵血紅蛋白形成劑如亞硝酸鹽可使血紅蛋白迅速形成高鐵血紅蛋白,後者三價鐵離子能與體內游離的或已與細胞色素氧化酶結合的氰基結合形成不穩定的
氰化高鐵血紅蛋白,而使酶免受抑制。氰化高鐵血紅蛋白在數分鐘又可解離出氰離子,故需迅速給予供硫劑如硫代硫酸鈉,使氰離子轉變為低毒
硫氰酸鹽而排出體外。
使用方法
立即將
亞硝酸異戊酯1~2支(0.2~0.4ml)包在清潔的布內壓碎,給予吸入15~30秒鐘,5分鐘後可重複一次,總量不超過3支。小兒每次劑量為1支。本藥用後在體內只形成少量變性
血紅蛋白,故僅作為應急措施。
3%
亞硝酸鈉10~15ml靜注,每分鐘注入2~3ml。小兒給予6~10mg/kg。以上兩藥均能降低血壓,有循環障礙者慎用。
用同一針頭以同一速度注入25~50% 硫代硫酸鈉20~50ml。小兒給予0.25~0.5g/kg。必要時一小時後重複半量或全量,以後酌情重複使用。輕度中毒者單用此藥即可。
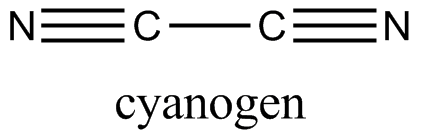 氰的化學結構式
氰的化學結構式