基本介紹
- 中文名:等溫過程
- 外文名:isothermal process
- 基本屬性:系統溫度不變
- 擴展屬性:系統內能不變
- 學科:熱力學
介紹
相關規律
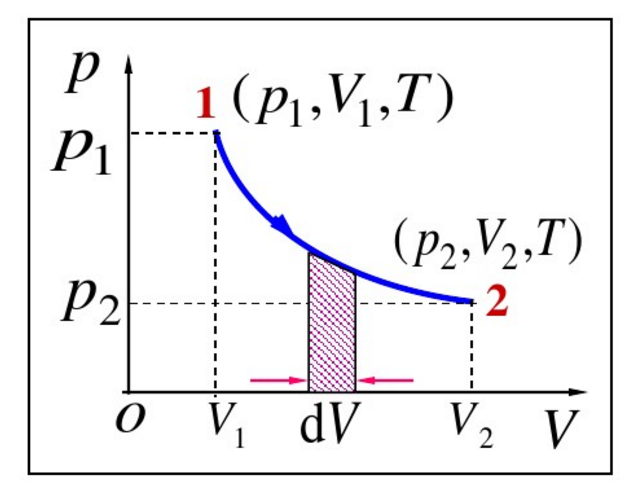
波義耳定律
卡諾循環
熱力學勢
辨析
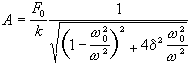 等溫過程
等溫過程

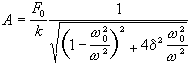 等溫過程
等溫過程等溫過程是熱力學過程的一種,即是指熱力學系統在恆定溫度下發生的各種物理或化學過程。在整個等溫過程中,熱量的傳遞使系統與其外界處於熱平衡狀態。...
為在環境的作用下,系統從一個平衡狀態變化到另一個平衡狀態的過程。在化工熱力學中,對熱力學過程的描述包括系統狀態的變化、經歷的途徑以及系統與環境間能量的交換...
等溫變化重點是通過實驗使學生知道並掌握一定質量的氣體在等溫變化時壓強與體積的關係,理解p-V圖像的物理意義,知道玻意耳定律的適用條件。...
等溫技術(英語:Isothermal Technology)是指高熱傳導介質以熱波熱共振傳熱的方式,使得傳熱元器件或物質,其熱能的輸入端與輸出端即時實現無溫差現象,亦即熱阻為零的熱...
等溫熱處理是一種新的熱處理技術。等溫熱處理後的工件,具有淬透性好,硬度高,機械性能好,變形小和表面有金屬光澤等優點,熱處理後可以省去磨削、噴砂等清理工序。...
等容過程又稱定容過程,是系統的體積始終保持不變的過程。等容過程的特點是體積V=恆量。對理想氣體而言,等容的準靜態過程中壓強與溫度的關係,可由理想氣體狀態...
等溫結晶 (isothermal crystallization)在恆定溫度條件下的結晶過程。它是研究和表征高聚物結晶行為常用的實驗方法之一。從等溫結晶曲線可獲得該溫度下結晶速率和結晶...
等溫輸送,是指在使用輸油管道進行石油輸送過程中不進行加熱的輸送工藝,由於使用該種輸送工藝時,油品和管道的溫度與周圍土壤溫度相等,故名為“等溫”,等溫輸送適合...
等溫淬火是指工件淬火加熱後,若長期保持在下貝氏體轉變區的溫度,使之完成奧氏體的等溫轉變,獲得下貝氏體組織的淬火方式。等溫淬火實際上是分級淬火的進一步發展,...
擠壓模模孔內金屬的變形溫度始終保持恆定的擠壓工藝。採用等溫擠壓可使整個製品頭尾的幾何尺寸、表面質量和內部組織及物理性能等都達到最佳效果,大大提高生產率。如果...
"過程",事物發展所經過的程式;階段。在質量管理學中"過程"定義為:利用輸入實現預期結果的相互關聯或相互影響的一組活動。介紹“過程”,事物發展所經過的程式;階段...
定溫過程又稱等溫過程。定溫過程是熱力學過程的一種,即是指熱力學系統在恆定溫度下發生的各種物理或化學過程。在整個定溫過程中,熱量的傳遞使系統與其外界處於熱...
等溫鍛造的主要特點是模具與成形件處於基本相同的溫度,因此常需要帶有模具加熱及控溫裝置。等溫鍛造特別適合於那些鍛造溫區窄的難變形材料,如高溫合金、鈦合金、粉末...
等溫壓縮1(isothermalcompression) 氣體溫度在壓縮的過程中保持不變稱為等溫壓縮。在理想情況下,可看成是可逆壓縮過程。工程上的處理為壓縮機加水冷卻系統,經壓縮後...
等溫退火是用來代替完全退火和不完全退火的新的退火方法,是以較快的速度冷卻到A1以下某一溫度,保溫一定時間使奧氏體轉變為珠光體組織,然後空冷,處理後所得到的組織...
等溫退火工藝是將鋼件加熱到臨界溫度以上30~50℃(亞共析鋼加熱到Ac3以上,共析鋼和過共析鋼加熱到Ac1以上)保持一定時間,使其奧氏體化和奧氏體均勻化。然後...
熱力系統在某種因素推動下發生狀態變化的過程。熱力過程的特點反映在過程方程上,過程方程描述受特定過程約束的熱力狀態參數間的函式關係,由此可得出系統變化前後的狀態...
“等溫氣體”是天文學專有名詞。來自中國天文學名詞審定委員會審定發布的天文學專有名詞中文譯名,詞條譯名和中英文解釋數據著作權由天文學名詞委所有。...
定壓過程是指熱力學過程中壓力保持不變的過程,工程上使用的加熱器、冷卻器、燃燒器、鍋爐等很多熱設備是在接近定壓的情況下工作。定壓過程中由於壓力不變,其技術...
絕熱過程是一個絕熱體系的變化過程,即體系與環境之間無熱量交換的過程。...... 絕熱過程是一個絕熱體系的變化過程,即體系與環境之間無熱量交換的過程。...
吸附等溫式是在溫度固定的條件下,表達吸附量同溶液濃度之間關係的數學式。由於表面吸附,造成在溶液與氣相的交界處存在著一個濃度和性質與兩體相不同的表面薄層,它...
吸附等溫曲線是指在一定溫度下溶質分子在兩相界面上進行吸附過程達到平衡時它們在兩相中濃度之間的關係曲線,是用來反映食品物料中水分活性與水分含量關係的平衡曲線。...
